半胱氨酸消减丙烯酰胺的机理及消减工艺在薯条中的应用
黄才欢,李 丹,龙成艳,郑 洁,龚启宙,欧隽滢
(1.暨南大学食品科学与工程系,广东广州 510632;
2.中山洪力健康食品产业研究院有限公司,广东中山 528430;
3.暨南大学食品安全与营养研究院,广东广州 510632)
丙烯酰胺(acrylamide,AA)是一种公认的神经毒素和潜在的致癌物[1],并表现出一定的具有生殖毒性[2]和免疫毒性[3]。自2002在薯片中检测出大量丙烯酰胺以来,咖啡、方便面、饼干和曲奇等食品中均被检出大量的丙烯酰胺[4],其平均暴露量为0.4~1.6 μg/kg/d,其中薯片占比最高,达到23%[5]。高温加工食品的安全性引起人们极大关注。
近年来,人们致力于减少丙烯酰胺形成的研究,发现丙烯酰胺主要形成途径是天冬酰胺与还原糖(或活泼羰基化合物)发生美拉德反应[6],适当控制工艺条件、添加食品添加剂和配料两种措施均可减少制品中的丙烯酰胺。Liyanage等[7]通过浸泡、烫漂、发酵等方式降低原料中游离天冬氨酸和还原糖含量来减少丙烯酰胺的形成;Krishnakuma等[8]综述了通过控制加工温度、时间和水分活度等工艺条件抑制丙烯酰胺的形成;另外,氨基酸[9]、酶制剂[10]、多酚类[11]和益生菌[12]等物质均被用于控制丙烯酰胺的形成。氨基酸作为良好的亲核试剂,可与丙烯酰胺发生迈克尔加成反应,从而显著减少丙烯酰胺的含量。半胱氨酸是食品中常见的氨基酸,可用于面包、乳制品、肉制品和面糖制品中。我国GB 2760-2014食品添加剂使用标准中,L-半胱氨酸既可作为天然香料用于改善食品风味,又可作为面粉处理剂改善面团特性[13]。美国、加拿大和日本等国家的食品法律法规允许把L-半胱氨酸用作面包添加剂。L-半胱氨酸分子中同时含有氨基和巯基,具有较强的亲核能力和很强的抗氧化性。在高温条件下,往油中加入少量半胱氨酸能防止油脂氧化的发生[14]。此外,L-半胱氨酸能通过迈克尔加成反应和美拉德反应与羟甲基糠醛(HMF)发生反应,从而降低高温加工食品中内源性危害物HMF的含量[15]。Yoshioka等[9]研究了罐装牛奶咖啡中赖氨酸残基和半胱氨酸残基可显著降低制品中丙烯酰胺的含量,且在牛奶蛋白中检测出含赖氨酸丙烯酸和半胱氨酸丙烯酸的硫化物。过去十多年,大多数研究主要着眼于丙烯酰胺的消减,而对消减产物的报道不多。
前期研究表明,半胱氨酸与丙烯酰胺在160 ℃反应15 min后,其对丙烯酰胺的消除率可达94.6%,采用液相色谱-质谱联用仪可检测到由一分子半胱氨酸与一分子丙烯酰胺形成的物质信号(m/z 193,ESI+)[16]。因半胱氨酸分子中的α-NH2和侧链上的-SH与丙烯酰胺均可发生加成反应,推测L-半胱氨酸是通过亲核反应形成加合物来消减体系中的丙烯酰胺。基于对食品安全的考量,有必要明确新生成的加合物结构,并评价加合物会否产生新的食品安全隐患。本研究优化了半胱氨酸与丙烯酰胺加合物形成的反应条件,结合采用常压和高压柱层析法制备出高纯度的加合物,综合运用紫外、质谱与核磁共振等现代波谱技术解析加合物的结构,并采用体外细胞(Caco-2)实验初步评价其细胞毒性。以液相色谱-质谱联用的多反应监测模式(MRM)测定了市售和自制薯片(油炸前经不同浓度半胱氨酸溶液浸泡过)中丙烯酰胺、丙烯酰胺-半胱氨酸加合物的含量,探究采用L-半胱氨酸控制高温加工食品中丙烯酰胺形成的可行性,为有效控制食品中内源性化学危害物提供一种新思考。
1 材料与方法
1.1 材料与仪器
丙烯酰胺(Acrylamide,AA)(99%)、半胱氨酸(Cysteine,Cys)(99%) 北京百灵威科技有限公司;甲醇 色谱纯,美国Mallinckrodt Baker公司;重水(D2O) Cambridge Isotope Laboratories;磷酸氢二钠、磷酸二氢钠 分析纯,天津市大茂化学试剂厂;反相硅胶(A-HG) 日本东京YMC有限公司;鲜切薯片(A、B、C 3个不同品牌) 兴安超市;0.45 μm聚醚砜微孔滤膜、0.22 μm尼龙微孔滤膜 天津津腾实验设备有限公司。
Welch 液相色谱柱Ultimate XB-C18(10×250 mm,5 μm) 上海屹立利科学仪器有限公司;Waters液相色谱柱 Atlantis T3(4.6×150 mm,5 μm)、Waters Alliance e2695液相色谱仪(配备2998 PDA检测器)美国沃特世公司;磁力搅拌器 巩义市予华仪器有限责任公司;精密电子天平 广州市艾安得仪器有限公司;三重四级杆液质联用仪(LC-MS8045,配备电喷雾离子源) 日本岛津制作所;N-1300型旋转蒸发仪 东京理化器械株式会社;Scientz-10N型真空冷冻干燥机 宁波新芝生物科技有限公司;X500R QTOF型高分辨质谱仪 美国SCIEX公司;600 MHz Avance III型核磁共振仪 瑞士布鲁克公司。
1.2 实验方法
1.2.1 半胱氨酸对丙烯酰胺的消减反应 配制5.0 mmol/L Cys和0.5 mmol/L AA溶液,各取2.0 mL置于10.0 mL具塞不锈钢钢管中,密封,取2.0 mL纯水以及2.0 mL 0.5 mmol/L AA溶液作为空白对照组,两组反应在160 ℃恒温油浴下加热20 min,取出试管并在冰水浴中冷却;反应液经0.45 μm微孔滤膜过滤,置于1.5 mL样品瓶,备用,每个样品三次平行。反应液中AA的含量测定方法采用Yu等[16]报道的液相色谱法,制作标准曲线的AA浓度依次为0、0.1、0.2、0.3、0.4和 0.5 mmol/L。根据标准曲线计算出反应液中实验组(a1)和空白对照组(a2)剩余的AA浓度,并计算反应中AA的消除率。

式中:a1:加入 Cys后 AA浓度平均值;a2:空白对照组AA浓度平均值。
1.2.2 消除反应条件的优化
1.2.2.1 反应体系pH的选择 分别用pH为6.0、7.0和 8.0磷酸盐缓冲溶液配制 AA和Cys溶液(25.0 mmol/L)设置了3个不同pH的反应体系,于120 ℃油浴反应3 h,采用液相色谱法测定加合物含量。因加合物的生成量与其在液相谱图上的峰面积成正比,为此以加合物峰面积大的反应体系进行后续实验。
1.2.2.2 反应温度的选择 把pH7.0的AA和Cys溶液分别置于温度为90、120、150与180 ℃的油浴中反应3 h,生成物采用液相色谱法测定,以加合物峰面积最大的反应温度进行后续实验。
1.2.2.3 反应时间的选择 把一定量pH7.0的AA和Cys溶液分别在120 ℃油浴反应 1、2、3和 4 h后,生成物采用液相色谱法测定,选择加合物峰面积最大的反应时间进行后续实验。
1.2.2.4 物料比 把一定量pH7.0的AA和Cys溶液混合,使其浓度比分别为1:0.5、1:1、1:3和1:5,120 ℃油浴反应3 h,采用液相色谱法测定加合物的含量,比较不同物料比对丙烯酰胺-半胱氨酸加合物生成量的影响,选出最佳物料比制备加合物。
1.2.3 液相色谱法检测加合物 参考Jiang等[17]的方法鉴定反应产物。色谱条件:色谱柱为Waters Atlantis T3,4.6 mm×150 mm,5 μm。HPLC 分析程序:流动相A为色谱级甲醇,B为0.1%乙酸水溶液;分析条件:流动相VA:VB=2:98,流速0.4 mL/min,进样体积0.5 μL,柱温40 ℃,检测波长205 nm,根据加合物的保留时间进行定性;并采用面积归一化计算加合物纯度。
1.2.4 加合物的制备与分离
1.2.4.1 半胱氨酸与丙烯酰胺加合物的制备 根据优化的结果选择合适的反应条件制备加合物,采用减压浓缩法把反应液浓缩至约为3.0 mL,加入到20.0 mL甲醇,抽滤;再用10.0 mL甲醇洗涤固体样品,抽滤,把2次得到的滤液合并,减压浓缩,得浓缩液和固体,备用。以液相色谱法分别测定浓缩液和固体中加合物的量。
1.2.4.2 反相硅胶柱层析法分离加合物 参照邹照佳等[18]的方法,采用常压柱层析法分离加合物,固定相为A-HG反相硅胶。样品用3.0 mL 5.0%的甲醇水溶液溶解后湿法上样,分别以5.0%、10.0%、20.0%、40.0%和60.0%的甲醇水溶液进行梯度洗脱,收集各洗脱组分,用液相色谱法监测各组分中加合物的含量。
1.2.4.3 高效液相色谱法纯化加合物 采用半制备色谱柱 Ultimate XB-C18柱(10 mm×250 mm,5 μm)在Waters e2695进一步纯化反相硅胶柱层析收集到的加合物。色谱条件:流动相V甲醇:V水=2:98;流速:1.0 mL/min;柱温:25 ℃;检测波长:210 nm;进样量:50.0 μL。按不同的保留时间收集到4个组分:组分A(11.8~13.0 min)、组分 B(13.4~14.7 min)、组分C(14.8~16 min)和组分 D(16.5~18.4 min),并以液质联用法(LC-MS)测定这4个组分的分子量。
1.2.5 加合物的结构表征
1.2.5.1 分子量的确定 将1.0 mg纯化后的加合物溶于纯水中,用液相色谱仪测定样品的纯度,并得到加合物的紫外光谱图;LC-MS法测其一级、二级质谱图;高分辨质谱法(HRMS)测得其相对分子质量。LC-MS条件:色谱柱为Atlantis T3,4.6 mm×150 mm,5 μm;流动相A为色谱级甲醇,B为0.1%乙酸水溶液;分析条件:流动相VA:VB=2:98,流速0.4 mL/min,进样体积0.5 μL,柱温40 ℃,检测波长205 nm;离子源为电喷雾离子源(ESI),正离子模式,扫描范围为m/z 50~500;源温度为300 ℃,去溶剂化温度为250 ℃,毛细管电压为4000 V,扫描速率为1000 Da/sec,碰撞能量为15 eV。
1.2.5.21H和13C核磁共振谱检测 取15.0 mg化合物溶于0.55 mL氘代甲醇中,用核磁共振仪分别测定化合物的氢谱(1H,600M)、碳谱(13C,200M)和Dept-135谱图。
1.2.6 加合物的细胞毒性实验 采用MTT法[19]分别测定Cys、AA及加合物对人肠道细胞Caco-2的细胞毒性。用含有10%胎牛血清的RPMI-1640培养基培养 Caco-2细胞,把细胞密度调节到5.0×105个/mL置于培养瓶中,往96孔细胞培养板上加入100.0 μL细胞悬液,细胞悬液共分3组,分别以不同浓度的半胱氨酸、丙烯酰胺、加合物孵育细胞及空白对照组,每个浓度设置3个复孔;并设一组空白对照组(设三个复孔)。加样后,参照Zou等[20]方法培养细胞,置于培养箱分别培养24和48 h,用适量的PBS溶液冲去化合物并移除PBS溶液,每孔加入含有 5.0 mg/mL MTT 的培养基 200.0 μL,37 ℃ 再培养4 h。终止培养后,移除培养液,加入150.0 μL DMSO溶液,振荡10 min,在酶标仪上测定570 nm处光密度值(OD值)。

式中:A1为加药组OD值平均值;A2为对照组OD值平均值。
1.2.7 消减工艺在薯片加工中的应用 为了比较Cys对薯片中AA的消减作用,分别测定市售薯片及经不同浓度Cys溶液预处理的自制薯片中加合物和AA的含量。
1.2.7.1 薯片的制备 自制薯片参照郭鸿阳等[21]的方法进行前处理,将清洗干净的马铃薯去皮,用刨刀切成0.25 cm厚的均匀薄片,称取4份样品,每份150.0 g,先用去离子水清洗薄片表面的淀粉,再用含Cys的水溶液浸泡马铃薯片 60 min(浸泡液中Cys的浓度分别为0、1.0、3.0和5.0 g/L,对应编号为自制1、2、3、4(自制1为空白对照,即油炸前只用纯水浸泡的),沥干水分后,用165 ℃的花生油炸5.0 min,沥去表面的油,备用。
1.2.7.2 薯片中丙烯酰胺和加合物的提取和含量测定 分别称取4.0 g薯片,研碎,索氏抽提法除油,再分别用20.0、10.0和10.0 mL 10.0%甲醇水溶液在常温振荡提取3次,合并提取液,8000 r/min离心,收集上清液,用0.22 μm微孔滤膜过滤,参考刘刚等[22]的方法用岛津HPLC-MS仪器测定,采用具有灵敏、准确和特异性强的MRM模式对其进行定量分析,平行三次。
HPLC色谱条件:色谱柱(Waters Atlantis T3,4.6×150 mm,5 μm);流动相 A:色谱级甲醇,流动相B:0.1%乙酸水溶液;初始比例VA:VB=2:98,流速:0.5 mL/min,进样体积为 10.0 μL,洗脱程序:0~2 min,2.0% B~100.0% B;2~8 min,100.0% B~100.0% B;8~10 min,100.0% B~2.0% B;10~18 min,2% B。质谱条件:ESI+,采用多反应监测(MRM)模式;源温度300 ℃,去溶剂化温度250 ℃,毛细管电压4000 V,扫描速率1000 Da/sec,碰撞能量为7.0~23.0 eV,Dwell time均为100.0 ms。丙烯酰胺和加合物的定量离子对和定性离子对如表1所示。AA标准曲线的浓度依次为:0、10.0、20.0、40.0、60.0、80.0、100.0 μg/L;目标加合物标准曲线的浓度为:0、10.0、20.0、40.0、60.0、80.0、100.0、120.0 μg/L。
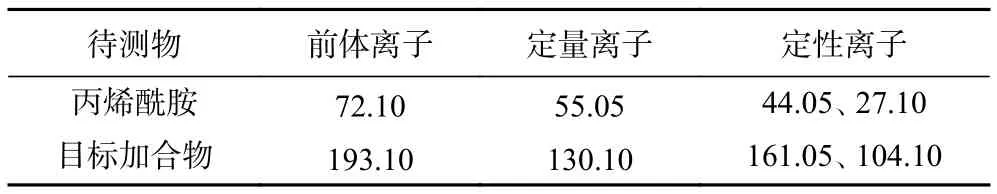
表1 丙烯酰胺和加合物的定性定量离子对Table 1 Qualitative ion pair, quantitative ion pair of AA and target adduct
1.3 数据处理
数据采用Microsoft Excel处理,用平均数±标准差(mean±SD)表示,方差分析和Duncan's显著性差异分析采用SPSS22.0软件处理,每组实验重复三次。
2 结果与分析
2.1 半胱氨酸对丙烯酰胺的消减及加合物的发现
Cys与AA在160 ℃下反应20 min后,由HPLC测量结果可知,样品中AA含量明显降低,其消减率为61.87%±4.3%,AA定量标准曲线为y=82.947x-1.8369,R2=0.9998。
另外,在生成物的液相色谱图中发现除了Cys和AA的峰外,还出现了1个新的峰,其保留时间为 13.5~14.2 min(图1);通过 HPLC-MS(ESI+)检测可知,新出现的峰含有m/z 193的组分;由文献报道可知[23-24],当Cys与AA发生迈克尔加成反应,可形成分子量为192的物质。
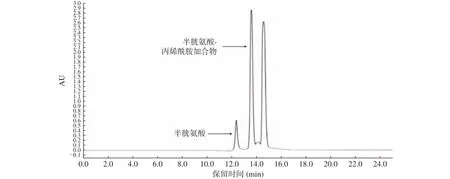
图1 加合物的液相分离色谱图Fig.1 Liquid separation chromatogram of adducts
2.2 加合物制备条件的优化
在液相色谱图中以新生成物的峰面积为指标,比较不同反应体系、反应温度、反应时间和物料比对加合物形成的影响。结果显示(图2),在3个体系中,pH7.0体系中可检测到加合物的峰面积最大,其次是pH6.0的弱酸性体系,可见中性条件下更有利于加合物的生成;随着反应时间从1 h增加至3 h,AA逐渐减少,加合物的峰面积也明显增大,但4 h时,加合物的峰面积却略少于3 h时;比较反应温度对加合物峰面积的影响,当反应温度为120 ℃时,加合物的峰面积最大,150和180 ℃反应后,其加合物的量均略低于120 ℃下的反应;当AA与Cys的物料比为1:3时,目标加合物的峰面积最大(见图2D)。综合考虑以上情况,后续制备条件确定为pH7.0、120 ℃、反应3 h、物料比为1:3。
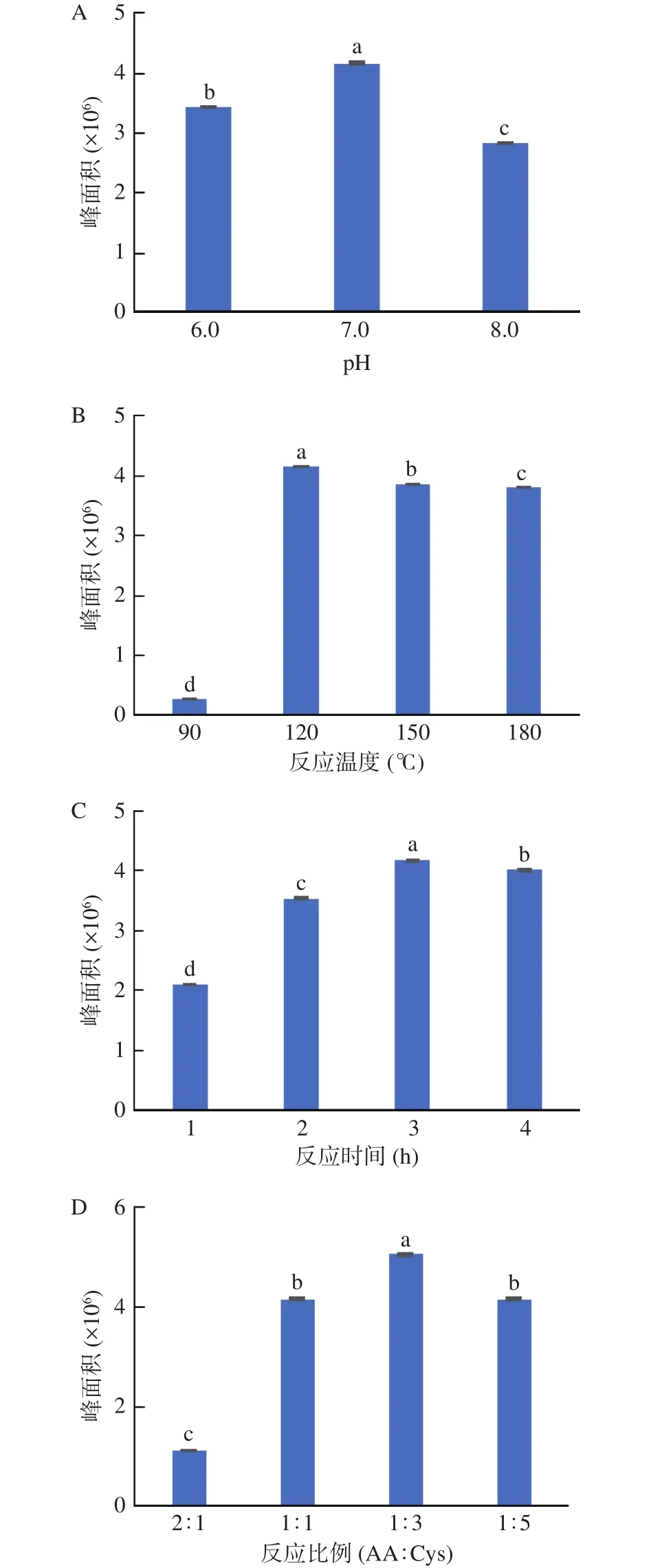
图2 反应条件对加合物形成的影响Fig.2 Effects of reaction conditions on adduct formation
2.3 加合物的纯化与结构表征
2.3.1 高效液相色谱法纯化目标加合物 经HPLC检测可知,在用10%甲醇洗脱反相硅胶柱时,收集的组分中加合物纯度可达60%,采用半制备色谱法进一步纯化后,收集到的4个组分中,组分B中目标加合物的纯度可达95%以上;另外,在组分D中也检测到另一质荷比为193的组分,但其含量不高,未能分离得到足够的量进行结构鉴定。
2.3.2 目标加合物的结构表征 采用冷冻干燥法得到的目标加合物是白色固体,其紫外光谱的最大吸收波长为196 nm,可知其含有羰基;其高分辨质谱(图3)的分子离子峰为193.0645 [M]+,拟合得到的分子量为193.0641,分子式为C6H9NO3S,其不饱和度为2。

图3 目标加合物的高分辨质谱图(ESI+模式)Fig.3 High resolution mass spectrometry of the target adduct(ESI+ mode)
加合物的1H NMR中(图4A和表2):在高场区有 3 个亚甲基信号(δH=2.62,2.86,3.06 和 3.18 ppm),1个次甲基信号(δH=3.95 ppm);因H-4和H-5相互偶合裂分,均为td峰;H-2与H-3发生偶合裂分,形成dd峰,由于其与酰胺基相连,位于低场。13C NMR和DEPT谱(图4B~图4C和表2)数据也证实了化合物中有 2 个羰基碳(δC=177.23,172.81 ppm),3 个亚甲基(δC=32.08,27.02 和34.66 ppm),1 个次甲基(δC=53.54 ppm);其中亚甲基δC=34.66 ppm和次甲基δC=53.54 ppm是原半胱氨酸部分的基团,δC=177.23 ppm的羰基碳则是归属于酰胺基上;结合二级质谱中碎片离子的分析结果(图5,表2)和文献报道[25-26],该目标化合物的结构确定为:2-氨基-3-(3-氨基-3-氧代-丙基)硫烷基-丙酸。
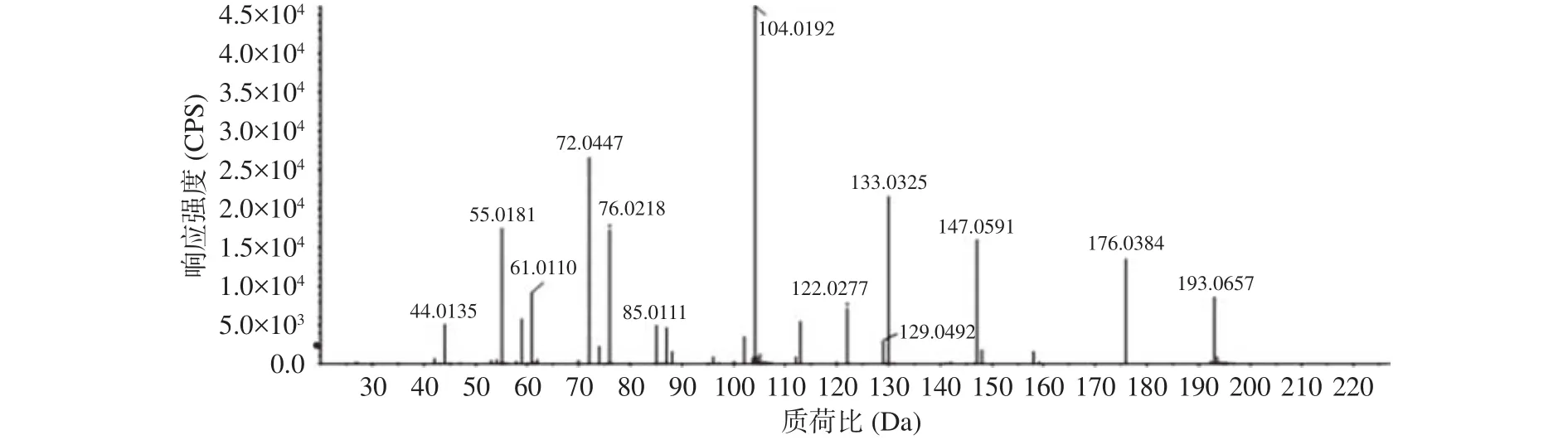
图5 加合物高分辨二级质谱图(ESI+模式)Fig.5 Adduct high resolution secondary mass spectrometry (ESI+ Mode)

表2 加合物的核磁共振信息及其碎片结构Table 2 NMR information and fragment structure of adduct
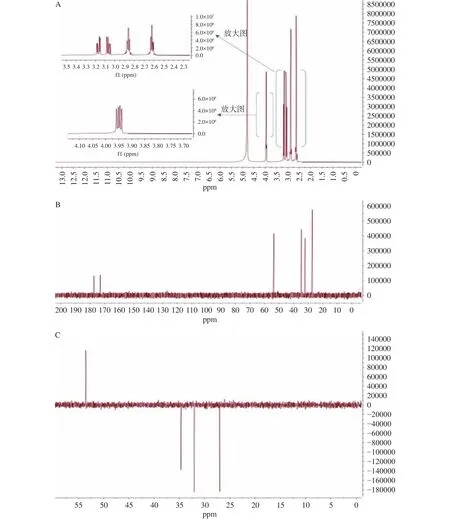
图4 目标加合物的核磁谱图(氘代甲醇)Fig.4 NMR spectra of the target adduct (deuterium methanol)
Zamora等[27]研究了氨基酸与丙烯酰胺反应的机制,表明可通过迈克尔加成将氨基化合物添加到丙烯酰胺中,从而产生相应的3-(烷基氨基)丙酰胺。由此推测出其反应机理(图6):半胱氨酸的巯基具有强亲核性,在一定条件下可与含α,β-不饱和羰基化合物(丙烯酰胺)发生加成反应。

图6 目标加合物的形成机理Fig.6 Formation mechanism of target adduct
2.4 加合物的细胞毒性
AA的潜在危害已为人们所熟知,前期研究表明,Cys可有效抑制或消除高温加工食品中的AA[28-29];由上述研究可知其消除机理是Cys与AA形成加合物,但所形成加合物的安全性未知。
本研究采用Caco-2细胞对Cys、AA和加合物的安全性进行探索(图7)。孵育 24 h后,AA的IC50为3.55 mmol/L;48 h后,其IC50为2.65 mmol/L;半胱氨酸-丙烯酰胺加合物浓度在8.0 mmol/L时,经24和48 h后孵育后,细胞存活率均在80%以上,其毒性明显低于AA。由此可见,加合物的形成可明显降低AA的细胞毒性。

图7 半胱氨酸、丙烯酰胺和加合物孵育Caco-2细胞24 h(A)、48 h(B)对细胞存活率的影响Fig.7 Effects of cysteine, acrylamide and adduct on cell viability of Caco-2 cells incubated for 24 h (A) and 48 h (B)
2.5 消减工艺在薯片加工中的应用
Cys是食品中的半限制氨基酸,基于其对AA的高效消减作用,且消减后可与AA生成加合物,本研究以纯化后的半胱氨酸-丙烯酰胺加合物为标准品,采用MRM模式建立AA和加合物标准曲线,分别测定了3种品牌的鲜切薯片和4种由Cys预处理的自制薯片中AA和加合物的含量。
AA的标准曲线是 Y=405467X+5042.57(R2=0.996),加合物的标准曲线是Y=3e-09X+0.001(R2=0.997),薯片中AA和加合物的含量如表3所示。自制薯片1的AA含量是0.617 mg/kg,未检出加合物;自制薯片2中AA和加合物含量分别为0.204和0.036 mg/kg,其AA含量较薯片1降低了67%;当浸泡液中Cys浓度增加至0.3%时,自制薯片3中未检出AA,加合物含量0.043 mg/kg,是自制薯片中含量最高的。推测当浸泡液中的Cys为0.5%时,有效地抑制了美拉德反应,使AA形成量降低,进而减少了加合物的形成。市售的3个不同品牌薯片中AA含量在0.472~0.523 mg/kg,加合物未检出,这可能是因为Cys在马铃薯中的含量极少,致使薯片中未能检测出加合物。综上,Cys预处理的薯片中AA含量明显低于未经预处理的,且可测到一定量的加合物,可见Cys可有效降低薯片中AA的含量,消减的AA部分以丙烯酰胺-半胱氨酸加合物的形式存在。

表3 不同预处理的薯片中丙烯酰胺和半胱氨酸-丙烯酰胺加合物的含量Table 3 Contents of acrylamide and cysteine-acrylamide adducts in different potato chips
3 结论
Cys可有效消减AA的含量,并形成加合物。通过优化制备条件,得到纯度高达95%的半胱氨酸-丙烯酰胺加合物,该加合物是由1分子Cys巯基与1分子AA烯基通过加成反应形成。加合物在Caco-2细胞上的细胞毒性明显低于AA。在油炸前用0.3% Cys溶液浸泡的马铃薯片,其AA含量明显降低,且可检出一定量的半胱氨酸-丙烯酰胺加合物。可见,在薯片加工中Cys可通过与AA发生加成反应形成加合物,从而实现消减丙烯酰胺的目的。虽然薯片中半胱氨酸-丙烯酰胺加合物的检出量明显低于AA的消减量,AA的其它消减途径有待更深入的探讨,但本研究的方法为高温加工食品中内源性污染物的风险控制提供了一个新的视角。

