天然多糖提取、纯化及生物活性研究进展
王文丽,张金玲,魏亚宁,桑雨梅,薛宏坤
(河北大学中医学院,河北保定 071000)
植物是一个巨大而多样性的草本物种群,具有不同的形态特征、质地和分布。它们的叶、茎、花、果实和块根中含有不同的生物活性化合物,包含多糖、多酚、酚酸、各种维生素、膳食纤维和大量矿物质等[1]。依据《世界维管植物》在2020年统计数据发现,全世界植物已超过37万种,以被子和双子叶植物为主。巨大的植物物种为多糖来源提供重要的物质基础。此外,真菌一般都是高等真菌的子实体,味道鲜美,营养丰富,含有丰富的蛋白质、多糖、维生素等成分,具有良好的营养价值和药用价值,备受人们的喜爱。近年来随着健康饮食理念的兴起,真菌中的一些生物活性成分越来越受到人们的重视。多糖是真菌最主要的活性成分之一。多糖是由10个以上的单糖分子脱水和缩合形成的,每个单糖分子通过糖苷键连接,并可用通式(C6H10O5)n表示[2]。多糖来源广泛,几乎存在于所有植物、真菌、动物、微生物和其他生物体中。随着科学技术的不断发展和提取分离技术的持续创新,多糖结构和构效关系逐渐被人们所认识。此外,多糖的生物活性研究也取得了很大进展。天然多糖结构复杂多样,具有多种生物学活性,如在抗氧化、抗肿瘤、抗衰老、抗病毒、调节免疫、调节肠道菌群、降血糖、降血脂和改变食品风味等方面具有优异的生物活性,同时多糖还可以降低合成化学品的毒性、致畸性和潜在致癌性[3-5]。因此,多糖的研究越来越被研究者所重视。
近10年来,研究者报道了许多类型的天然多糖,同时越来越多的研究发现不同来源的天然多糖对人类健康具有特定生物活性。为阐明多糖的构效关系,首先对天然多糖提取和纯化进行大量研究。在此基础上,进一步探究多糖的生物活性。然而目前关于天然多糖提取、纯化和生物活性全面的综述报道有限。鉴于此,本文系统阐述天然多糖不同的提取和纯化方法及其生物活性,具体流程如图1所示。综述结果以期为天然多糖进一步高效开发和利用提供重要参考。

图1 植物多糖提取、分离纯化和生物活性示意图Fig.1 Process for extraction, purification, and bioactivity of polysaccharides from plant
1 多糖提取的研究现状
提取是分离生物活性多糖的最重要环节。目前关于多糖提取国外文献较多,提取方法主要包括溶剂提取法(Solvent extraction,SE)、超声辅助提取法(Ultrasound assisted extraction,UAE)、微波辅助提取法(Microwave assisted extraction,MAE)、酶辅助提取法(Enzyme assisted extraction,EAE)、双水相提取法(Aqueous two-phase extraction,ATPE)和超声辅助双水相提取法(Ultrasonic assisted aqueous twophase extraction,UAATPE)等[6],上述提取方法的优缺点如表1所示。
1.1 溶剂提取法(SE)
SE是多糖提取中最常用的方式之一,该方法需要较长的提取时间、较高的提取温度和液料比,并通过多次提取达到更高的多糖回收率。此外,该方式同时具有操作简单、不需特殊设备和易于控制等优点。因此,SE已被成功用于榛蘑[7]、灵芝[8]、石榴[9]和红枣[10]等多糖的提取[11]。此外,该技术还用于不常见野生水果(印度苦瓜、山竹和西番莲)多糖的提取[12-14]。大量研究表明采用SE分离的植物多糖为细胞外多糖,其原因是在SE过程中,通过加热的方式使提取液温度升高,该过程不能破坏植物细胞壁和细胞膜,使得细胞内的多糖无法溶出,故该方式获得的植物多糖为胞外多糖[15-16]。通过该方式获得的多糖提取液常与乙醇沉淀结合,然后通过透析和冷冻干燥获得粗多糖,进一步通过不同纯化方式获得均一组分的多糖,最后探究均一多糖的生理活性。
1.2 超声辅助提取法(UAE)
UAE是具有发展潜力的多糖提取技术之一,其原理是利用超声产生高速和强烈的空化效应促使植物细胞壁和细胞膜破裂,加快细胞内多糖的溶出,从而达到强化提取多糖的目的[17]。该技术的优缺点如表1所示。在UAE植物多糖的研究中,当超声频率高于100 kHz,高频的超声波会破坏糖苷键,导致多糖发生降解;相反,当超声频率低于20 kHz,超声产生的空化效应无法破裂植物细胞壁,达不到强化提取多糖的目的[18]。因此,在多糖超声提取过程中,超声频率通常选择在20~100 kHz范围内。目前,该技术已被广泛应用于多糖的提取。曹丹等[19]采用UAE灰树花多糖,通过均匀设计法优化得到灰树花多糖提取工艺参数为:超声功率500 W、提取时间64 min、提取温度43 ℃和液料比1:31 g/mL,该条件下,灰树花多糖提取率为23.06%。杨燕敏等[20]利用UAE红枣多糖,依据响应面法(Response surface methodology,RSM)优化其提取工艺参数,所得的最优工艺参数:超声功率、超声温度、料液比和超声时间分别为200 W、48 ℃、1: 16 g/mL和24 min,所得多糖得率为3.11%±0.45%。Song等[21]利用UAE代替热水提取法提取枸杞多糖,通过RSM优化得到最佳工艺参数组合为:提取时间80 min、提取温度73 ℃、料液比1:38 g/mL和超声功率185 W,在此条件下,枸杞多糖得率为12.54%±0.12%,经对比发现该方式所得多糖得率明显高于热水提取法。Luo等[22]以红曲米为原料,采用UAE其中的水溶性非淀粉多糖,经优化得到最佳工艺参数:水料比、提取温度、提取时间和超声功率分别为40:1 mL/g、62 ℃、75 min和200 W,多糖得率为3.37%±0.78%。通过分析国内外UAE多糖文献发现,与传统的SE相比,超声在一定程度上具有强化提取天然多糖的效果,但在UAE过程中,超声产生的空化效应和机械效应可能会破坏多糖结构。因此,为发挥超声提取的优势,必须要严格控制超声条件。

表1 多糖提取方法的优缺点Table 1 Advantages and disadvantages of polysaccharides extraction methods
1.3 微波辅助提取法(MAE)
MAE是多糖提取的新兴技术,其原理是利用频率在300 MHz~300 GHz的电磁波对物料进行选择性加热。微波辐照导致细胞膜和细胞壁被破坏,并增强分子的极化[23]。与传统方法相比,MAE具有萃取效率高、溶剂消耗量低、产率高和节能环保等优点[24]。陈晓辉等[25]利用MAE火麻仁多糖,得到最佳提取条件:微波功率、提取时间和料液比分别为250 W、6 min和1:60 g/mL,该条件下,多糖提取率取得最大值11.11%。Al-Dhabi等[26]以扎恩门废果种子为原料,采用MAE其中多糖,经RSM优化获得最佳提取工艺参数:料液比1:15 g/mL、微波功率515 W、pH3.2。在该条件下,多糖得率为4.71%±0.02%。Chen等[27]通过MAE紫菜中的多糖,得到最优工艺参数组合为:水料比28.98:1 mL/g,微波功率77.84 W和提取时间14.14 min。Xu等[28]采用MAE五味子多糖,通过RSM优化获得最佳提取工艺参数组合为:料液比1:0.03 g/mL、微波功率700 W和萃取时间20 min,多糖得率为15.75%。通过分析以上文献发现,微波辐射可破坏细胞壁,降低多糖的传质阻力,进而提高多糖得率。但微波选择性加热会导致提取液产生局部高温,使得多糖结构发生改变,降低多糖得率。微波产生局部高温导致多糖结构发生改变这一共性问题,制约微波在多糖提取领域的应用。
1.4 酶辅助提取法(EAE)
与传统技术相比,EAE是一种快速、绿色和具有发展潜力的多糖提取方法,该方法的优缺点如表1所示。利用不同酶(木瓜蛋白酶、果胶酶和纤维素酶等)降解植物细胞壁,使细胞内多糖由内向外的传质阻力降低,扩散系数增加,从而达到强化提取多糖的目的[29]。因此,该技术已被广泛应用于不同来源多糖的提取。温思萌等[30]利用EAE茯苓中多糖,经RSM优化获得最佳工艺参数为:酶解时间130 min、酶解温度55 ℃、pH5和酶的添加量为6%。在此条件下,多糖得率可达8.69%。丁霄霄等[31]以灵芝为原料,采用复合酶纤维素酶、半纤维素酶、木瓜蛋白酶法从灵芝中提取多糖,最终获得最佳提取工艺参数为:复合酶比例 3.5%:4.0%:3.0%、酶解pH5.7、温度 50℃和时间 81 min,多糖得率为 3.73%。Chai等[32]使用酶法提取槲寄生叶多糖,经单因素实验和正交试验设计得出最佳工艺参数为:固液比1:40 g/mL、酶浓度2.5%、酶解时间40 min、酶解温度 50 ℃和酶促 pH5,多糖产率为 21.83%±0.45%。通过上述研究可知EAE具有众多优点,但也存在一些缺点,在EAE提取过程中,提取条件难以控制和酶易失活。因此,EAE方式仍需要在未来进一步研究。
1.5 双水相提取法(ATPE)
ATPE是指把两种聚合物或一种聚合物与一种盐的水溶液混合在一起,利用其不相溶性形成两相[33],其原理如图2所示。近年来,ATPE由于其产率高、环境友好、易于放大、成本低以及对分子生物活性的损害小等优点,逐渐从生物分子的分离扩展到小分子的萃取[34]。双水相体系(Aqueous two-phase system,ATPS)作为一种新型的萃取溶剂(表2),由于具有双相萃取能力,可在一步过程中分离纯化天然产物中的多种化合物,是一种更绿色、更高效的预处理溶液。特别是短链醇与无机盐组成的ATPS,其具有粘度低、易分离、溶剂可循环利用等优点,在中草药活性成分提取中得到广泛应用[35]。李化等[36]采用ATPE五味子多糖,通过优化最终得到最优提取工艺参数为:药液量、K2HPO4用量、PEG6000用量和离心时间分别为5 mL、1.0 g、1.8 g和9 min,该条件下所得实验值与理论预测值偏差3.94%。祁小妮等[37]选乙醇/(NH4)2SO4ATPS提取红景天中多糖,获最佳提取工艺参数为:料液比1:22.5 g/mL、提取温度50 ℃和提取时间37.5 min,在此条件下,红景天多糖得率为16.64%。党金宁等[38]采用乙醇/(NH4)2SO4ATPS提取蕨麻多糖,经RSM优化得出最佳提取条件为:料液比1:35 g/mL、提取温度55 ℃和提取时间60 min,该条件下,蕨麻多糖得率为14.46%±0.12%。刑健敏等[39]采用双水相提取法从芦荟中提取多糖,选择聚乙二醇/(NH4)2SO4作为ATPS,通过优化得芦荟多糖得率为75.63%。通过上述研究发现利用ATPE多糖得率明显优于传统的SEM,但如何快速寻找最适的双水相体系仍需进一步深入研究。

表2 双水相体系分类Table 2 Classification of aqueous two-phase system

图2 双水相提取法原理装置图Fig.2 Schematic device diagram of aqueous two-phase extraction method
1.6 超声辅助双水相提取法(UAATPE)
UAATPE是将UAE和ATPE相结合的一种新型的提取方法,该方法提取效率明显优于单一的UAE和ATPE。UAATPE已被广泛应用于不同植物多糖的提取当中。尹明松等[40]采用UAATPE从槟榔中提取多糖,利用RSM优化得到最佳工艺参数为:料液比1:20 g/mL、超声温度70 ℃和超声时间40 min,多糖得率达4.52%±0.25%。巫永华等[41]利用UAATPE从牛蒡中提取多糖,选用(NH4)2SO4/聚乙二醇(PEG)6000体系作最适双水相体系,采用RSM优化得到最佳工艺参数为:料液比0.04:1 g/mL、浸提温度49 ℃、浸提时间2.6 h和超声时间31 min,该条件下,牛蒡多糖提取率为32.35%±0.85%。Ji等[42]以红枣为原料,选用(乙醇/(NH4)2SO4)作双水相体系,采用UAATPE提取其中多糖,经优化得最佳工艺条件为:提取时间、提取温度、物料比和超声功率分别为38 min、48 ℃、1:30 g/mL和70 W。在该条件下,红枣多糖得率为8.18%。Zhang等[34]利用UAATPE大卫百合多糖,选用乙醇/K2HPO4双水相体系,经优化,获得多糖最佳工艺参数为:液固比25:1 mL/g、提取时间 10 min、提取温度 60 ℃、pH11和超声功率190 W,多糖得率和纯度分别为36.58%和84.71%。综上研究发现与传统的UAE和ATPE对比,采用UAATPE多糖所得的多糖得率和纯度均显著高于UAE和ATPE。
2 多糖纯化的研究现状
植物多糖分离是萃取过程中最繁琐的过程,一般而言,粗多糖提取液首先经过乙醇沉淀,除去与多糖相连的蛋白质、脂质、核酸、色素和其他小分子。因此,为获得均一多糖组分,分离纯化必不可少。目前,多糖的分离纯化国外文献较多,纯化手段众多,如大孔树脂法、阴离子交换色谱法、凝胶色谱法和膜分离法等。以下分别综述几种分离纯化多糖的方法。
2.1 大孔树脂纯化法
大孔吸附树脂法是一种常用的有机化合物的初步纯化方法,通过选用合适的吸附、解析条件进行初步纯化。当待分离的样品进入大孔树脂后,大孔树脂可吸附其有效成分,除去其杂质,进而达到纯化的目的[43]。Hu等[44]利用大孔树脂法纯化美加苔草粗多糖,经研究发现其最佳纯化条件为:洗脱体积2.74 BV、流速1.88 BV/h和样品浓度2.10 mg/mL,纯化的综合评分为63.59%±1.56%。Yang等[45]使用AB-8大孔树脂从山茶饼提取物中纯化茶籽多糖,在最佳的吸附和解吸条件下,茶籽多糖的收率和纯度分别为18.7%和89.2%。潘峰等[46]利用S-8树脂纯化山茱萸果实多糖,获得最佳纯化工艺条件为:样品浓度4.41 mg/mL、初始pH5、吸附环境温度24.3 ℃和流速2.0 BV/h,此时多糖保留率、色素清除率和蛋白清除率分别为55.05%、49.21%和68.97%。大孔吸附树脂法可再生重复利用、吸附效果好、适用范围广。但是大孔吸附树脂品种、规格繁多,且无法获得高纯度化合物单体。因此,无法大规模用于工业化纯化活性成分。
2.2 阴离子交换色谱纯化法
离子交换色谱法(ion exchange chromatography,IEC)是一种将离子交换原理和液相色谱技术相结合的纯化方法。孙延芳等[47]利用DEAE-25纤维素和Sephadex G-75凝胶层析柱的方法对芒果粗多糖进行分离纯化,并利用HPGPC分析其单糖组成。张志宏等[48]利用 Amberlite FPA90Cl阴离子和Amberlite FPC3500H阳离子两种离子交换色谱法进行联合纯化,在此基础上,进一步利用离子交换纤维素DEAE Cellulose DE-52柱对黄瓜子多糖进行分离纯化,依次通过上述方法纯化后,最终获得3种多糖。刘鑫等[49]利用DEAE-Sepharose阴离子交换柱层析碧螺春多糖,获得产物再经Sepharose CL-6B凝胶柱层析进一步纯化,最终获得中性高纯度的多糖。龚雯等[50]利用DEAE-纤维素阴离子交换法对金花茶多糖进行分级纯化,获得三个级分。通过IEC分离纯化多糖,多糖的纯度得到显著提升,但分离过程繁琐,制备量小,不适用大规模分离纯化多糖。
2.3 凝胶色谱纯化法
凝胶色谱法(Gel permeation chromatography,GPC)是一种高效、快速、操作简单、分离效果好的分离方法。肖健等[51]利用DEAE GPC对龙胆多糖粗品进行纯化,通过纯化后最终得到两种产物 F1和F2,其得率分别为14.1%和63.4%。罗晶洁等[52]利用Sephadex-G50纯化桑叶粗多糖,经纯化后最终得到两种不同组分分别为MLP1和MLP2,在此基础上,进一步通过高效凝胶色谱纯化MLP1和MLP2,最终纯化后得到两种组分的纯度分别为94.55%和96.64%。申明月等[53]采用高效凝胶渗透色谱纯化茶叶多糖,获得最佳工艺条件为:上样量5 mL和超纯水洗脱流速2.6 mL/min。Ren等[54]分别采用大孔树脂法、阴离子交换色谱法和凝胶色谱法纯化藜麦多糖,发现凝胶色谱法纯化效果最好,多糖得率为90.12%。通过分析上述文献发现,GPC可使多糖的纯化显著提高,但该方法操作复杂、制备量低和微量活性成分易损失。因此,多糖分离纯化仍需开发新技术用于工业上大规模纯化天然多糖。
2.4 膜分离法
膜分离法的原理是由于不同的滤膜具有不同的分子量截留孔径,将待分离样品在一定的操作压力下循环分离,从而达到分离效果。国内外学者对多糖膜分离法主要聚焦于截流3500、5000和8000 kDa的多糖馏分[4,48]。邢健敏等[39]采用膜分离法截留芦荟多糖3500 kDa和5000 kDa的多糖馏分,研究发现3500 kDa馏分含量高于5000 kDa的多糖馏分。Tang等[43]先通过膜分离法截流3500 kDa丹参多糖馏分,然后进一步通过大孔吸附树脂法和阴离子交换色谱纯化法纯化丹参多糖馏分,最终得到两种单一组分的多糖,其纯度均在95%以上。
单纯采用膜分离法无法得到高纯度多糖馏分,通常膜分离法与其它分离手段联用获取高纯度多糖馏分。目前,由于分离纯化手段的限制,很难快速、大量分离制备高纯度单一的天然多糖馏分。因此,多糖的分离纯化手段仍需进一步深入研究。
3 多糖活性的研究现状
近十年关于植物多糖活性研究较多,主要集中在抗氧化、抗衰老、抗肿瘤、降血糖、调节肠道菌群和调节免疫六个方面,不同来源的植物多糖的具体生物活性如图3所示。在此基础上,本文统计万方和Science Direct两个数据库从2012~2021年期间多糖活性的国内外科学论文发表数量,统计结果如图4所示。由图4可获得以下三点信息:a.关于多糖抗氧化和抗衰老方面的科学论文发表数量,国内多于国外。但国外针对多糖活性研究报道主要聚焦于抗肿瘤、降血糖和调节免疫三个方面,而国内研究较少;b.国内外关于多糖调节肠道菌群的研究报道均较少;c.随年份增加多糖生物活性的研究报道呈现上升趋势,科学论文发表数量逐年增长。
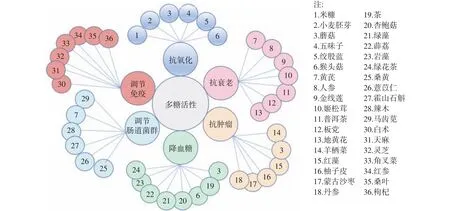
图3 不同来源多糖的生物活性Fig.3 Polysaccharides bioactivities from different sources

图4 所统计2012年~2021年多糖活性国内外论文发表数量Fig.4 Statistics of the number of papers published at home and abroad on polysaccharides activity from 2012 to 2021
3.1 抗氧化活性
多糖通过清除过量的活性氧、减少脂质过氧化和提高抗氧化酶活性,发挥抗氧化活性。李德灵等[55]比较连续动态逆流和热水提取两种方法对香菇多糖抗氧化活性的影响。结果表明当香菇多糖质量浓度在1.5 mg/mL时,香菇多糖对O2-、OH和DPPH自由基的抗氧化能力比热水回流提取法提高38.75%、52.36%和36.82%。许海燕等[56]研究桦菌芝多糖的抗氧化性,发现其具有较好的抗氧化活性,该活性随多糖浓度升高而增强。Cao等[57]研究臭椿多糖四个组分(DAP1、DAP2、DAP3和 DAP4),研究发现DAP2和 DAP3对 ABTS+、DPPH和 OH自由基具有较强的清除能力。Zhang等[58]研究不同的脱色方法对灰树花多糖抗氧化作用的影响,发现过氧化氢脱色可激活灰花树多糖的抗氧化活性。Chen等[59]经研究发现黄瓜多糖具有很强的清除OH自由基和铁离子还原的能力,具有较高的抗氧化活性。ROS是一种含氧中间代谢物,包括氧自由基和非自由基。氧自由基包括氧的一电子还原产物超氧阴离子自由基(·O2-)、三电子还原产物羟自由基(·OH)、过氧自由基(ROO·)和一氧化氮(NO·)等,天然多糖的体外抗氧化活性的机制可能与其ROS捕获能力有关。
3.2 抗衰老活性
多糖具有清除自由基、抑制衰老基因表达和调控细胞周期的功能。因此,多糖可以有效地抵抗衰老。刘平平等[60]研究三七发酵液多糖抗衰老活性,发现发酵三七多糖可显著降低胞内活性氧水平,同时提高细胞I型胶原蛋白含量,进而发挥抗衰老作用。张诗山等[61]研究南非紫菜多糖对抗衰老活性的影响,研究发现多糖可显著提高衰老小鼠SOD、GSHPx的活力和总抗氧化能力。Ding等[62]经研究发现沙棘多糖TLH-3显著抑制丙二醛的形成,并提高小鼠肝脏和血清中超氧化物歧化酶和过氧化氢酶的活性。Li等[63]研究双孢蘑菇水溶性多糖的抗衰老活性,发现多糖通过增加抗氧化酶、减少脂质过氧化、改善器官功能和释放脂质代谢,达到抗衰老作用。Wang等[64]经研究发现山药多糖通过修复器官功能和提高klotho基因在衰老小鼠体内的表达起到抗衰老作用。综上可知,多糖可以通过提高细胞内抗氧化酶活性、抑制衰老基因表达和调控细胞周期来发挥抗衰老作用。
3.3 抗肿瘤活性
多糖通过直接抑制肿瘤和间接抑制肿瘤两个方面发挥抗肿瘤作用。谢飞等[65]研究野生蝉花多糖的抗肿瘤活性及其作用机制,研究发现多糖在体内外均可显著抑制肿瘤细胞生长的作用,并呈剂量效应,其作用机制是抑制Caspase途径和死亡受体途径达到抗肿瘤效果。钟闰等[66]研究杜氏盐藻胞外多糖对宫颈癌细胞的毒性及生长的抑制作用,研究发现多糖显著抑制Hela细胞增殖,并呈剂量效应,同时改变细胞形态和降低细胞活力。Corso等[67]对多糖抗乳腺癌的研究进行综述,研究发现多糖可以通过抑制细胞增殖、促进血管生成、加速乳腺癌细胞凋亡和阻断细胞周期等途径发挥较好的抗肿瘤效果。Deng等[68]经研究发现枸杞多糖抗肿瘤活性与其分子量相关,中等分子量的枸杞多糖是发挥抗肿瘤作用的主要活性部位。Feng等[69]经研究发现凤尾参多糖在体外可抑制S180肿瘤细胞的增殖并诱导细胞凋亡,也可诱导肿瘤细胞的凋亡。通过上述文献分析发现,天然多糖可在一定程度上抑制肿瘤细胞生长,其作用机制主要通过抑制肿瘤细胞凋亡和阻断细胞周期,激活线粒体凋亡通路相关蛋白表达来发挥抗肿瘤效果。
3.4 降糖活性
多糖可以通过胰岛素的作用或其它途径来发挥较好的降糖功效。刘丹奇等[70]研究红茶、枸杞和桑叶三种多糖的降糖活性,研究发现红茶多糖降糖效果明显优于枸杞多糖和桑叶多糖,同时三种多糖均对肝脏无毒性。吴亚楠等[71]对蒲公英粗多糖降糖进行研究,发现其主要通过促进葡萄糖的消耗、肝糖原的增加和保护损伤的胰岛细胞发挥降糖作用。Li等[72]评价不同浓度和不同分子量的山药多糖的降血糖作用,研究发现分子量越低和浓度越大,降糖活性越好。Liu等[73]经研究发现党参中性多糖在体内可缓解Ⅱ型糖尿病小鼠的的氧化应激,并改善其脂质代谢能力,达到较好的降糖效果。Wu等[74]评价不同提取方式下获得的南瓜多糖降糖效果,研究发现水提下获得的南瓜粗多糖对Ⅱ型糖尿病小鼠有极强的降糖效果。上述文献已经证实多糖通过抑制细胞氧化应激的发生,增加糖代谢途径和阻止血糖来源来发挥降糖活性。天然多糖为降糖药物开发提供重要的物质基础。
3.5 调节肠道菌群
多糖可通过调节肠道菌群、保护肠黏膜和增加短链脂肪酸的含量,从而发挥益生元的作用。多糖调节肠道菌群机制图如图5所示。随着人们对健康生活的追求,越来越多的研究者探究多糖如何通过调节肠道菌群来发挥较强的生物学活性。张廷婷等[75]经研究发现黑木耳通过调节肠道菌群达到降脂的作用,具体机制是通过增加盲肠内短链脂肪酸的含量,促进血脂代谢。杨明琛等[76]研究黄精多糖对Ⅱ型糖尿病小鼠的作用,发现其可显著提高肠道菌群的丰富度和多样性,也可改变菌群物种组成结构。李珊等[77]研究非淀粉多糖调节肠道菌群治疗代谢性疾病,发现其被肠道内的微生物菌群发酵,选择性地刺激肠道内微生物的增殖和活性,改善肠道菌群的环境,从而治疗或预防代谢性疾病。Fu等[78]研究党参多糖调节免疫抑制小鼠的肠道微生物群,发现其在膜免疫损伤和抑制病原菌定植方面具有重要作用。Wang等[79]研究枸杞多糖对免疫抑制小鼠肠道微生物群的影响,发现其在肠道中几乎不被吸收,即枸杞多糖可能与肠道微生物相互作用。Ge等[80]对饮食多糖调节肠道菌群进行概述,发现其可影响肠道微生物数量,进而帮助管理结肠和宿主健康。通过分析上述文献发现,天然多糖可通过增加盲肠内短链脂肪酸的含量、强化血脂代谢、抑制病原菌生产和提高肠道菌群的丰富度和多样性来发挥益生元的作用,促进人体健康。

图5 多糖调节肠道菌群机制示意图Fig.5 Schematic diagram of the mechanism of polysaccharide regulating intestinal bacteria
3.6 调节免疫活性
多糖免疫调节作用具有多途径、多环节、多靶点的特点。多糖在调节免疫方面发挥了重要作用,具体作用机制如图6所示。吴磊等[81]研究白莲莲子皮多糖调节免疫的活性,发现其通过刺激巨噬细胞释放NO 和细胞因子(TNF-α、IL-6、IL-1β)来增强免疫调节活性。郝敏等[82]经研究发现黑木耳胞外多糖具有促进肠道内有益菌群增殖,增加短链脂肪酸含量及上调血清抗炎因子水平的作用。谌淑平等[83]探究五种食用菌多糖复配物的免疫调节活性,发现不同食用菌多糖的复配物均可调节巨噬细胞RAW264.7的免疫活性。Wang等[84]研究脐带苔藓多糖对小鼠巨噬细胞RAW264.7的免疫作用,发现其可明显促进巨噬细胞的增殖和吞噬活性。Fan等[85]研究黄芪、白术和芝麻三种多糖在体外对鸡巨噬细胞的免疫调节活性,发现白术多糖与芝麻多糖相比,芝麻多糖对鸡巨噬细胞的免疫作用更强。综上分析发现多糖主要通过增强巨噬细胞的增殖和吞噬活性来发挥其免疫调节活性。
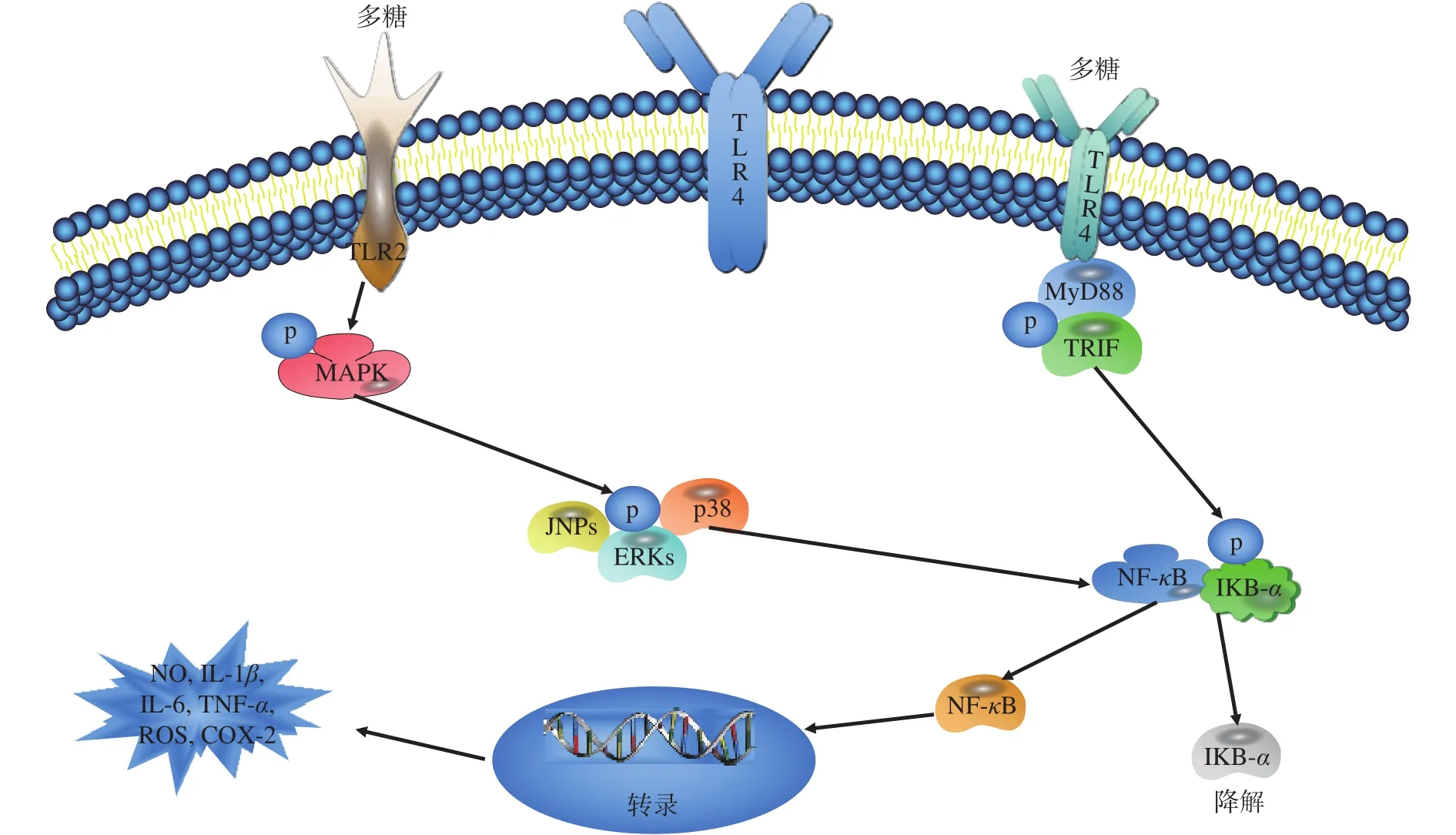
图6 真菌多糖调节免疫机制示意图Fig.6 Schematic diagram of immune mechanism regulated by fungal polysaccharides
4 结论与展望
本文综述不同植物来源多糖的提取和纯化方法及其生物活性,多糖活性主要综述了抗氧化、抗衰老、抗肿瘤、降血糖、调节肠道菌群和调节免疫六个方面,充分展示了多糖可作为功能性因子,被广泛应用于医药、保健品、化妆品和食品等领域。对植物多糖提取现状进一步分析及发现现有的多糖提取方式均存在一定不足,虽然UAE、MAE、EAE、ATPE和UAATPE在一定程度上提高了多糖提取效率和得率,但利用上述方法从植物中大规模提取多糖仍然存在一定局限。因此,仍需进一步开发更高效的提取方式用于工业化提取多糖,粗多糖中的杂质在一定程度上会影响其生物活性。目前多糖纯化主要聚焦在柱色谱和凝胶色谱,存在分离步骤繁琐和制备量小等缺点。因此,需要开发一种新型、快速、环保的分离纯化方法来除去粗多糖中的杂质。关于植物多糖的理化特性、结构与生物活性关系及其作用的分子机制仍需进一步深入研究。总之,本研究综述表明生物活性植物多糖在未来的食品和生物医学等领域应用中具有潜在的作用,同时为多糖深加工和产品开发提供更多的科学和理论依据。

