酶促类蛋白反应的研究进展
李云亮,周安奇,阮思煜,马海乐
(江苏大学食品与生物工程学院,江苏镇江 212013)
类蛋白是指氨基酸单体或其衍生物通过酰胺键连接形成类似天然蛋白质结构的聚氨基酸[1],可通过直接热聚合[2]、氨基酸开环聚合法[3]等方法合成。在食品科学领域中,类蛋白可通过酶促类蛋白反应(Enzyme catalyzed plastein reactions,ECPC)形成。ECPC具体指在适宜的条件下,将浓缩的蛋白水解物在蛋白酶的作用下形成凝胶状蛋白类物质的过程,可被认为是蛋白质水解过程的逆反应。ECPC的反应过程分为三步:a.水解反应,用酸或者蛋白酶在合适pH下对底物蛋白质进行水解;b.浓缩,利用减压蒸馏、喷雾干燥等方式将水解后的产物进行浓缩;c.合成反应,将浓缩物,或者其他原料来源的氨基酸加入,并用蛋白酶催化反应[4-6]。
国外对ECPC的研究开展的比较早,对其反应机制、影响条件及应用等有很多的报道[7]。近些年,国内对于ECPC的研究也越来越多,该反应已经被应用于大豆蛋白[8]、乳蛋白[9]、鱼酶促类蛋白[10]等改性蛋白生产中,取得了良好效果。ECPC不仅弥补了天然蛋白的氨基酸组成结构缺陷,提高了蛋白质功能性,还改善了蛋白水解物的风味,为食品行业提供了新的蛋白质来源。
鉴于ECPC的营养性、功能性和安全性等优点所体现出来的广阔前景,本文主要概述了ECPC发生的机理,讨论了影响反应的主要因素和反应产物的特性,并总结了该反应的部分用途,为更好地了解和利用该反应提供理论依据。
1 ECPC反应机理
ECPC作为蛋白酶解反应的逆反应,有关其主导机制一直存在很大争议,目前主流的ECPC反应机制包括:物理聚合作用、缩合反应和转肽作用,其中缩合反应和转肽作用涉及到新肽键的生成,即蛋白质水解物通过类蛋白反应能生成原料蛋白质中没有的新肽段,具有很大研究价值。
物理聚合作用:1976年,Michiko等[11]提出,疏水基之间相互作用是ECPC发生的主要原因。上世纪90年代初,Andrews等[12]使用衍生自酪蛋白的肽作为底物,研究了类蛋白合成反应的各个方面,证明该反应是一个纯粹的熵驱动的物理聚集过程,物理键的疏水作用是整个酶促反应的关键步骤。曲玲玲[13]用扫描电镜和原子力显微镜观测到ECPC过程中大豆蛋白-酪蛋白复合物的形貌及尺寸均发生变化,认为疏水相互作用在大豆多肽和酪蛋白非磷酸肽的结合中起到了至关重要的作用。梁雪[14]也发现在ECPC过程中有疏水相互作用和氢键的参与。物理聚合作用主要涉及蛋白质高级结构的变化,但是形成的相互作用力比较弱。此外,物理聚合作用导致疏水性增加,从而更易将反应产物从反应中分离出来。
缩合和转肽作用:有研究者认为,合成类蛋白反应是单纯的动力学驱使的蛋白质水解反应的逆反应,通过酶催化多肽和氨基酸底物再次发生缩合作用,转化成新的蛋白质或分子量较大的聚合肽。这一作用在加入端基封闭氨基酸的试验中得到验证,另外封闭肽的氨基比羧基对类蛋白的合成影响更大[15],然而也有研究表明封闭肽的氨基和羧基末端只会稍微降低类蛋白的产量[9]。这表明,缩合作用在不同类蛋白反应中贡献不一样,也可能还有其他机制[16]。彭新颜等[7]认为ECPC实际上就是一种转肽过程,肽键断裂和形成的过程导致氨基酸残基重排。在类蛋白反应过程中,肽分子通过转肽的作用,将疏水性氨基酸转化为疏水性多肽,并逐渐形成不溶于水的类蛋白产物[14]。赵谋明[6]认为,ECPC仅仅是由浓缩反应形成新的肽键或转肽作用产生是不恰当的,要证明是哪一种机制占主导地位需要分析产物的平均分子量是否增加,以及生成的不溶性物质是否与分子量的增加有关。缩合和转肽作用主要涉及的是多肽分子一级结构的变化,可通过分子标记来监测具体是哪种作用在起作用。
ECPC机制复杂,同一个反应中多种机制相互作用,要明确具体哪一种机制在反应中起主要作用仍需进一步深入研究。随着科技的革新和进步,核磁共振、质谱、高效液相色谱等分析技术可以进一步帮助解析其机理。
2 影响ECPC条件
影响ECPC的因素很多,如酶的种类、底物浓度、反应温度、反应pH等,选择适宜的反应条件、控制水解反应将更有利于ECPC的进行,部分学者通过研究该反应总结出来的最适反应条件如表1所示。
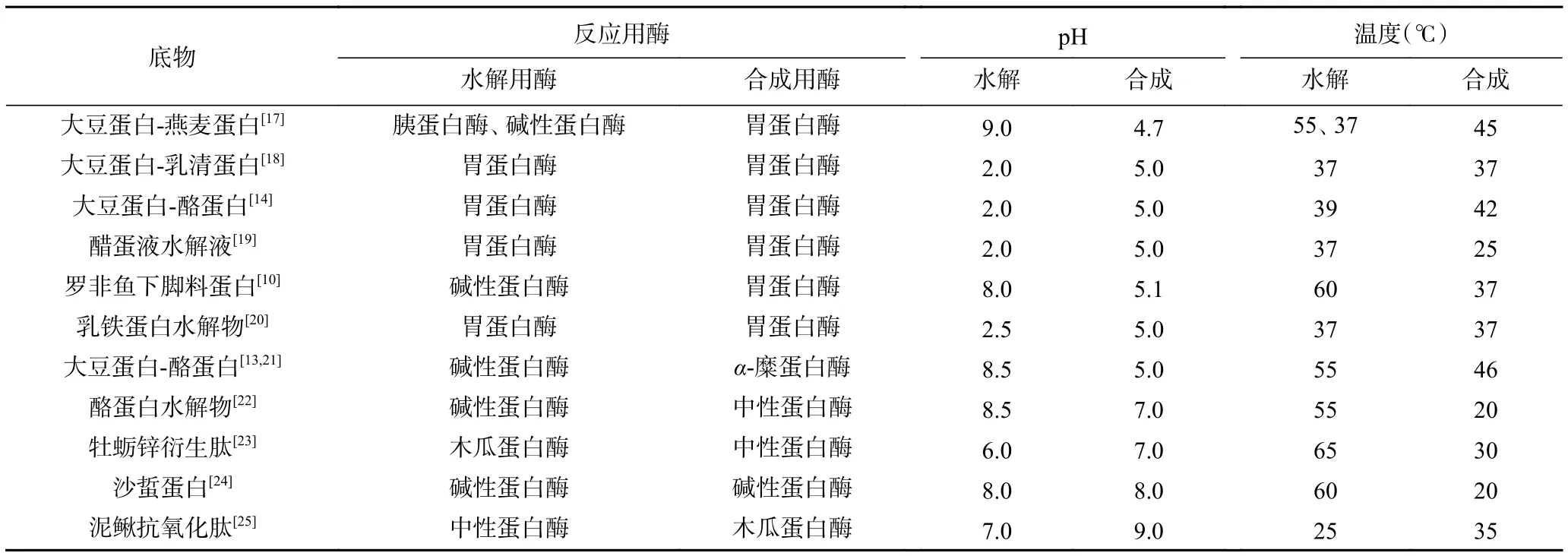
表1 ECPE反应条件Table 1 Reaction condition of ECPC
2.1 酶的种类
酶是影响ECPC至关重要的因素。酶的种类有很多,通常选用内切蛋白酶,如胰蛋白酶、木瓜蛋白酶、胃蛋白酶等来进行ECPC,而较少选择外切蛋白酶[26],这是因为工业上采用的水解酶通常为内切酶。不同类型原料进行ECPC所适用的蛋白酶有所不同。Li等[27]在研究碱性蛋白酶和木瓜蛋白酶对猪血红蛋白和肉蛋白水解物形成类蛋白反应的影响时,发现碱性蛋白酶比木瓜蛋白酶可以诱导更多的肽经过疏水相互作用聚集。周丽杰[28]通过对比胃蛋白酶、胰蛋白酶、木瓜蛋白酶和中性蛋白酶催化获得的类蛋白反应产物的性质,发现经木瓜蛋白酶催化得到的修饰产物的血管紧张素转移酶(ACE)抑制率比其他三种蛋白酶要高,达到70.37%。相同的原料在不同蛋白酶催化下获得类蛋白产物产率也有所差异,鹿波[29]采用碱性蛋白酶和胰蛋白酶分别催化酪蛋白水解物合成类蛋白,产物产率分别为71.4%和64.37%。ECPC中,水解和合成采用的酶可以一致,也可不同。两个过程都采用一种酶可以有效减少水解作用的影响,这是因为易被水解的键在水解过程中已经被水解断[6]。
整体看来,考虑到酶既具有水解蛋白又具有合成蛋白的能力,在进行合成反应的时候,则需要尽可能地减少酶的水解作用,这时就会选择改变反应条件来调整反应的进行,由于不同蛋白酶的最适反应条件有所不同,所以需要针对不同的反应原料和反应条件选择最为恰当的蛋白酶。比如当pH为5.0左右时,胃蛋白酶的水解能力最弱,这时以胃蛋白酶水解产物为底物,选择胃蛋白酶催化合成反应的产物得率比其他酶要高[6]。目前,也有学者尝试采用固定化酶来催化类蛋白反应,取得了较好的合成效果[18]。但是,关于利用复合酶制剂来催化该反应的报道比较少,很大可能是因为复合酶之间会相互影响,机制不明确,不利于ECPC的有效控制。
2.2 底物浓度
底物浓度对整个ECPC的影响很大,当反应体系中底物浓度低于7%时,ECPC进程停止,反应体系中以水解反应为主;当底物浓度逐渐增加,反应体系逐渐变为以合成反应为主[30]。王晗欣等[31]的报道证实了这一观点,认为当底物浓度低时,会发生蛋白水解作用,导致ECPC产率下降;但是当底物浓度过高时,混合物粘性增加,阻碍了酶的催化作用,也会影响ECPC的进行。徐薇等[22]在研究底物浓度对酪蛋白水解物ECPC的影响时,发现当底物浓度超过40%时,由于黏度过大,修饰后样品的游离氨基变化量减少,因此,该反应最适底物浓度应在7%~40%之间。相关研究表明,类蛋白合成时,底物浓度从11%~43%范围内类蛋白产量呈线性增加[32]。酶的水解和合成能力各有不同,能适应的底物浓度范围也有所差异,也会影响产物的合成[33]。综上所述,在较低的底物浓度条件下,酶的水解作用起主导作用,随着底物浓度的增加,合成作用逐渐加强,当底物浓度到达一定高度的时候,由于反应体系粘度增加,酶的运动被限制,其催化作用也被减弱。
2.3 反应温度
反应体系温度直接影响着蛋白酶的活性,是影响ECPC速率的关键因素。随着温度的升高,蛋白酶活性先增加后减少,ECPC产率也呈现先加快后减慢的趋势。当温度较低时,蛋白酶的活性受到抑制;但是温度升高到一定程度时,蛋白酶将变性失活,同样不利于ECPC的进行[34]。朱晓杰等[35]在研究温度对海地瓜蛋白酶解物ECPC的影响时得出相同的结论,发现在45 ℃时,游离氨基减少速率最快,而温度继续升高时,游离氨基减少速率反而降低,说明温度过高可能会导致蛋白酶失活, 不利于ECPC的进行。汪敬科[36]认为,ECPC在热力学上是一个放热反应,温度升高并不能增加反应产率,低温下更有利于平衡向生成肽键方向移动,但是反应温度过低又会导致反应速率下降。从总体上来看,蛋白质的水解反应和类蛋白的合成反应的最佳温度相差不大,其最佳的反应温度是由反应使用的酶的特性来决定,酶的最适反应温度决定反应的最适温度。目前常用的酶固定化手段和改进方法,使酶的最适作用温度提高[37]或者耐低温等极端温度的能力也更强[38],有效扩宽了酶的使用范围。
2.4 反应pH
ECPC的最适pH往往与水解反应的最适pH不同,也是影响ECPC的重要因素,如表1所示,根据水解反应的最适pH与合成反应的最适pH的差值-ΔpH,可将酶分为 3 类:胃蛋白酶型:ΔpH>0,即合成最适pH大于水解最适pH;α-糜蛋白酶型:ΔpH<0,即合成最适pH小于水解最适pH;中性蛋白酶型:ΔpH=0,即合成最适pH等于水解最适pH;而胰蛋白酶在任何pH范围内均不能催化生成类蛋白产物[14]。有学者提出,每种酶在水解反应中都存在最适的pH;而在类蛋白的合成反应中却不存在这个情况[26],这可能是因为很多的寡肽和蛋白质的等电点都在pH 4.0~7.0范围内。总而言之,酶的合成反应与水解反应最适宜的反应pH不同,合成反应最适的pH与水解产物的等电点密切相关。
2.5 其他
伴随着反应的进行,蛋白酶逐渐失活,因此,反应时间也是一个影响ECPC的因素[23]。另外,反应体系中的有机溶剂也对反应有一定程度的影响。在反应体系中添加有机溶剂可以降低底物的粘度,诱导疏水性氨基酸更多地暴露出来,形成疏水相互作用从而促进反应的进行[26]。有研究表明,底物的疏水性和亲水性对反应也有影响,认为随着疏水性的增强,反应速度越快,但是,疏水性过高会对反应起不利作用,因为底物难溶于水从而无法参与反应[39]。1974年,Tanizama等[40]通过研究水含量对固定化的胰凝乳蛋白酶催化N-苯酰化-L-酪氨酸-β-硝基苯胺水解的影响,认为含水量越低越有利于反应。除此之外,底物成分也会影响反应的进行。以玉米醇溶蛋白水解物合成类蛋白时,最有效的底物主要成分是四肽、五肽和六肽,平均分子质量分别为685和1043 Da的部分是效果最好的基质[6]。向反应中添加氨基酸酯比单纯增加游离氨基酸量或催化氨基酸衍生物更有利于推动反应进行[39]。综上所述,ECPC是一个各种因素共同决定的反应,特别ECPC是一个酶催化的反应,影响酶的条件也同样会影响反应的进行。
3 酶促类蛋白反应的产物特性
ECPC产物特性与蛋白质原料和蛋白质的水解物相比有较大差异。Bengt等[41]发现有些类蛋白反应物不溶于水、盐酸、氢氧化钠和3~9的pH缓冲溶液中,但是可以完全溶解于50%的乳酸或者柠檬酸溶液中,微溶于50%的乙酸溶液中。此外,Gololobov等[42]在利用α-胰蛋白酶和木瓜蛋白酶催化大豆蛋白水解时,发现水解产物不发生平均分子量的变化,但是,类蛋白反应发生后,氨基酸序列发生重排。也有研究表明,反应过程中,分子量相对较小的多肽混合物会相互作用合成大分子的肽。张雅丽等[8]以大豆蛋白水解物和芝麻蛋白水解物为底物进行ECPC,获得了分子量约为10000 Da的类蛋白产物。孙辉等[43]利用类蛋白反应修饰酪蛋白水解物,得到的产物中也存在分子质量较大的肽分子。此外,类蛋白反应产物同样可以被动物消化吸收。研究表明,当色氨酸通过类蛋白反应连接到水解蛋白上后,富含色氨酸的类蛋白反应物中色氨酸和游离色氨酸的生物利用率无显著差异[33]。姚玉静等[44]在进行大鼠喂食实验时,发现类蛋白反应产物的消化吸收率与其他天然蛋白质并无区别。类蛋白反应通过改变蛋白水解物的多肽序列,可以有目的性地向原料蛋白中导入含硫氨基酸、色氨酸、蛋氨酸等,使产物的氨基酸组成模式更接近联合国粮农组织和世界卫生组织推荐的必需氨基酸模式[14]。
4 酶促类蛋白的应用
4.1 蛋白质水解物的脱苦
蛋白质水解物的苦味强度受疏水氨基酸的含量、肽的分子量、水解酶的种类和水解度等多方面的影响[45]。研究表明,蛋白质水解后的苦味源于肽中大量疏水性氨基酸的暴露,如苯丙氨酸、脯氨酸、亮氨酸、酪氨酸等[46]。对于小麦面筋水解物而言,在前2 h内,水解反应逐渐释放疏水性氨基酸,苦味增加;随着反应的不断进行,长链的苦味肽含量逐渐减少,苦味下降[47]。此外,当疏水性氨基酸位于C、N端时苦味较低,位于肽链非端基位置时,表现出的苦味最大,以游离形式存在时苦味最低[48]。蛋白质水解得到的苦味物质的多肽分子量一般低于6000 Da,500~1000 Da范围内的肽段苦味最强[47-48]。
目前,常用的蛋白质水解物脱苦方法包括选择性分离[49]、包埋掩盖法[50]、ECPC法[51]和酶法脱苦[52-55]。范巍巍[56]利用中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶和动物蛋白酶酶解鳕鱼骨头,发现经碱性蛋白酶处理得到的产物风味最差,经木瓜蛋白酶处理后得到的酶解液苦味值最低。Synowiecki等[57]研究发现牛红细胞的蛋白水解物与谷氨酸进行类蛋白反应,水解产物的苦味显著降低。刘小蕾[58]利用共沸异丁醇萃取、类蛋白反应和加明胶一起酶解三种方法对猪骨汤酶解液脱苦,当类蛋白反应脱苦时,以风味蛋白酶为转肽酶,ECPC进行2 h时,所得酶解液的苦味值最小。侯钰柯等[16]认为蛋白水解物中的疏水性氨基酸残基可以在类蛋白反应中被包埋聚集构成“疏水核”,从而减少蛋白质水解物的苦味。王朋等[59]利用类蛋白反应法和物化法改善蛋白水解液苦味,通过对比发现,类蛋白反应法具有无添加、无毒副作用等优点,应用前景更加广阔。
总体来说,蛋白质的苦味主要来源于水解过程中疏水性氨基酸残基的暴露,由于在苦味强度上, 内切酶效果要强于外切酶效果[59],而蛋白的水解反应更多的采用的是内切酶,所以水解过程中苦味增加更加明显,因此,蛋白水解物的脱苦就显得尤为重要。ECPC能促进底物之间相互作用,减少了疏水性氨基酸残基的暴露,在降低蛋白水解物苦味的问题上效果显著。
4.2 制备活性肽,提高蛋白质的生物效价
生物活性肽是一类具有抗氧化、改善睡眠、免疫调节、抗菌和降血压等功能小分子多肽,其制备方法主要有:从自然界生物体中直接提取、采用酶水解或微生物降解得到和通过化学方法或重组DNA技术合成生物活性肽[45]。目前常用方法是通过蛋白酶水解法来获得生物活性肽[60-62],但是该方法制备的产物的活性受到了原料蛋白的限制,因为无论是酶水解还是微生物降解,都是利用蛋白酶催化水解反应,对蛋白质特定位点上的酰胺键进行水解,获得的肽片段与原料蛋白的氨基酸序列一致,所以无法进一步提高生物活性肽的活性。
ECPC能够将限制性氨基酸连接到多肽中,可以有效改善肽的生物活性。目前的研究主要集中在利用该反应制备ACE抑制肽[63-64]、抗氧化肽[65]和抑菌肽,如表2所示。研究表明,通过类蛋白反应可以添加必需氨基酸或者原料中缺少的某些氨基酸,弥补原料蛋白氨基酸组成不均衡的缺陷,合成具备特定功能的蛋白质,达到改善蛋白质的营养组成,提高蛋白质生物效价的目的。高丹丹等[25]在利用木瓜蛋白酶对泥鳅蛋白进行类蛋白反应修饰,结果表明:修饰产物的抗氧化活性是修饰前的1.99倍,DPPH自由基清除率为77.98%±0.08%。同年,高丹丹等[66]在对马铃薯蛋白ACE抑制肽的ECPC修饰研究中发现,当甘氨酸作为外源氨基酸的时候修饰效果最好。Zhao等[67]两人发现碱性蛋白酶催化的类蛋白反应不仅能改善大豆蛋白DPPH自由基清除率,还能改善大豆蛋白水解物的抗氧化性能。马春敏等[20,68]以色氨酸为外源氨基酸,通过类蛋白反应得到乳铁蛋白水解物(LHS),在研究中发现色氨酸修饰物对大肠杆菌的抑菌率较未修饰前提高了45.41%,纯化后的色氨酸修饰物对大肠杆菌的抑菌率较未纯化前提高了29.69%,将色氨酸修饰物均匀涂抹在茶肠制品上可以得到保质期更长、亚硝酸盐含量更低的产品。在对牡蛎肽的类蛋白反应的研究中发现:疏水相互作用是类蛋白反应的主要机理,为开发安全、高效的锌离子补充剂产品提供了新思路[69-71]。

表2 ECPC制备活性肽Table 2 Preparation of active peptides from ECPC
不仅如此,ECPC还可以增强蛋白水解物的胆汁酸结合能力[72-73]。郑玥等[19]在探讨醋蛋液水解物的类蛋白反应修饰及其对胆酸结合能力的影响时发现:ECPC可以提高醋蛋液水解物的胆酸结合能力和对蛋白酶抵抗的能力,并且结合能力最高的修饰产物的结合能力达到102.1%。梁雪[14]利用酶法合成类蛋白,与原料蛋白和水解物相比,合成的类蛋白具有更高的胆汁酸结合能力,类蛋白对牛磺胆酸钠、脱氧胆酸钠、胆酸钠的结合量分别为2.31、2.23和3.05 μmol/100 mg蛋白。温子健[18]通过大豆蛋白-乳清蛋白的类蛋白反应及其结合胆汁酸能力的研究,其结果表明,大豆蛋白-乳清蛋白的类蛋白通过疏水作用合成,能有效提高水解物胆汁酸结合能力。由此证明,ECPC可以有效提高活性或者改善产品质量。
4.3 改善蛋白质的功能性质
蛋白质水解物的功能性质主要包括水合性质(溶解性、持水性、粘度等)、乳化性和起泡性、凝胶作用和成膜性,通过ECPC,水解产物在酶的作用下产生交联,这些性质会得到改善[79]。冯建国[17]利用胃蛋白酶催化大豆蛋白和燕麦蛋白进行类蛋白反应,测得的类蛋白在不同的pH范围内都具有较强的功能性质,尤其是乳化性质和起泡性明显优于原料蛋白。Jiang等[80]研究ECPC修饰小球藻ACE抑制肽的机理,通过差式扫描量热法,发现在类蛋白反应修饰后蛋白的热稳定性增强,并且其热变性温度从120 ℃增加到134 ℃。此外,以水解明胶和蛋氨酸酯为底物,通过ECPC接上氨基酸月桂酯,既可以提高其营养价值,还可以提高改性水解蛋白的乳化性和稳定性[81]。杨杨等[21]通过对大豆蛋白-酪蛋白的类蛋白反应条件进行优化,制备出营养组分更完善、成膜性更好的优质蛋白,为生产营养组分丰富、价格便宜、可降解和可食用的动植物蛋白膜提供理论依据。Willianms等[32]将ECPC应用于霉菌蛋白改性,与常见的胶凝产品蛋白质不同,以相对较差的底物合成获得了不透明、触变的粘性溶液。总而言之,ECPC可以选择较为廉价的蛋白作为原料,改善其功能性质,ECPC产物在广泛的pH范围内具有适用性,在酸性高蛋白饮料、糖果业制造等方面有良好的应用前景。
4.4 提供新的蛋白质来源
最开始,ECPC因为可以利用海藻、微生物、叶蛋白等几乎无成本原料而受到很多人的关注,经过进一步的研究,该反应被应用到更广的范围。任增超等[10]利用胃蛋白酶对罗非鱼下脚料进行酶解蛋白合成类蛋白,为鱼蛋白改性、开发新的蛋白资源提供了新思路。Sukarno等[82]对虎虾消化道中蛋白酶进行研究,发现通过固定化酶进行ECPC修饰获得的产物中,苯丙氨酸含量变得极低,得到的酶促类蛋白产品具有潜在的营养价值,可用于各种配方食品、饲料产品的营养补品,也可以用于苯丙氨酸代谢障碍患者的食品。
ECPC还可以应用于蛋白质回收,制备具有生物学功能的新型蛋白质。Udenigwe等[83]使用不同蛋白酶水解鸡肉蛋白制得的水解物进行类蛋白反应,对鸡肉蛋白进行回收,开发出基于肽的胆汁酸结合树脂,用于调节高脂血症期间的内源性脂质水平。Li等[84]利用醍鱼内源性酶水解和豆粕的固态发酵生产水溶性蛋白粉,蛋白质回收率最高可达91%,为提高动物蛋白利用率提供了方法。Sun等[85]发现模拟胃肠道(GIT)消化后蛋清蛋白水解物的类蛋白反应显著降低了其免疫球蛋白E(IgE)的结合活性,该方法可用于生产结构修饰的免疫球蛋白。
5 结语与展望
本文通过了解ECPC反应机理、性质和影响因素等方面的内容,目的是为了对ECPC有更深层次的认识,为蛋白质的深度利用和高值化提供理论基础。鉴于ECPC能有效地降低底物的苦味值,在多肽产品的研发中可以有效起到改善产品品质和风味的作用,而且ECPC无毒副作用,且能提高蛋白质的效价,提供新蛋白来源,后续可以考虑将该反应应用于功能性食品的研发中,弥补天然食品的缺陷,满足更多人群的营养需求。

