蔬菜中五氯硝基苯和百菌清残留测定的QuEChERS应用与优化
徐纬,刘天洁,黄琴
(1.贵州医科大学 公共卫生学院 环境污染与疾病监控教育部重点实验室, 贵州 贵阳 550025; 2.四川省自贡市疾病预防与控制中心, 四川 自贡 643000)
蔬菜农药残留会对人体健康造成严重影响[1]。五氯硝基苯和百菌清属保护性杀菌剂,前者对蔬菜苗期病害防治效果较好,但其毒性危害、环境污染、农药残留等问题日益突出,已在多个国家被禁用或限制使用[2];后者对多种作物真菌病害具有预防作用,黏着性较好、但残效期长,对生态环境和食品安全具有潜在威胁[3]。我国对蔬菜中五氯硝基苯和百菌清残留均规定了检测方法和限量标准[4-5],但其检测方法的样品前处理操作较为复杂。样品前处理是影响检测速度和准确度的关键环节,目前农药残留检测前处理技术主要有固相萃取、固相微萃取、分散固相萃取(QuEChERS)、凝胶净化、超临界液体萃取及分子印迹技术等[6-7],其中QuEChERS是近年发展起来的一种快速样品前处理技术,其回收率高、分析速度快、溶剂使用量少、操作简便,现已逐步应用于农药残留检测中[8-9]。本文在以前研究基础上[10-16],优化建立了气相色谱-质谱联用仪(GC-MS)测定蔬菜中五氯硝基苯和百菌清残留量的QuEChERS 样品前处理方法,其应用将有利于降低环境污染、保障分析人员健康和促进食品中农药残留监测水平提升。现报道如下。
1 材料与方法
1.1 仪器与试剂
5957C型气相色谱-质谱联用仪(Agilent公司),DN-24W型氮气吹干仪(上海比朗仪器制造有限公司),AL204-1C型分析天平(Mettler Toledo公司),XH-1型涡旋混匀器(江苏康健医疗用品有限公司),543OR型离心机(Eppendorf公司),弗罗里矽固相萃取柱(Florisil-SPE柱,北京振翔科技有限公司),QuEChERS柱(CNW公司)。五氯硝基苯标准品(99.0%,C16730000,Dr.Ehrenstorfer GmbH),百菌清标准品(98.0%,C11510000,Dr.Ehrenstorfer GmbH),正己烷、乙腈、丙酮 (色谱纯)及其他试剂均为分析纯。空白样品为现行农业行业标准DB-1毛细管柱气相色谱电子捕获检测法[5]未检出五氯硝基苯与百菌清残留的蔬菜,检测样品为市场购买蔬菜。
1.2 方法
1.2.1仪器条件 色谱条件:DB-35 MS石英毛细管色谱柱(30 m×0.25 μm×0.25 μm),程序升温(40 ℃保持1 min, 30 ℃/min升温至130 ℃,5 ℃/min升温至250 ℃保持5 min),进样口温度260 ℃,载气为高纯氦气(纯度>99.999%),柱流速1.2 mL/min,不分流进样。质谱条件:EI离子源温度230 ℃,电子能量70 eV,传输线温度280 ℃,溶剂延迟10 min,选择离子扫描(SIM),五氯硝基苯定量离子295、定性离子237和249,百菌清定量离子266、定性离子264和268。
1.2.2标准溶液的配制 精密称取五氯硝基苯和百菌清标准品各0.001 g于10 mL容量瓶中,用正己烷溶解并定容,即得0.100 g/L五氯硝基苯和百菌清混合标准溶液。
1.2.3样品的前处理方法 本研究前处理方法:样品匀浆处理后精密称取15 g,加入氯化钠5 g和正己烷20 mL,涡旋混匀5 min,20~30 ℃超声提取30 min,加入无水硫酸钠8 g,充分振荡,4 000 r/min离心5 min,取上清液10.0 mL经QuEChERS柱净化后,氮气吹至净干,用正己烷定容至1.0 mL,1.0 uL进样测定。现行农业行业标准NY/T 761-2008前处理方法[5]:样品匀浆处理后精密称取25.0 g,加入乙腈50.0 mL,高速匀浆2 min后用滤纸过滤,收集滤液40~50 mL至装有5~7 g氯化钠的100 mL具塞量筒中,剧烈震荡1 min,静置30 min,吸取乙腈溶液10.0 mL于150 mL烧杯中,80 ℃水浴氮气至近干,加入正己烷2.0 mL,倒入预淋洗处理后的Florisil-SPE柱,用5 mL丙酮+正己烷(10+90)冲洗烧杯后淋洗Florisil-SPE柱,重复1次,收集洗脱液,于50 ℃水浴氮吹至<5 mL,用正己烷定容至5.0 mL,1.0 uL进样测定。
2 结果
2.1 QuEChERS条件优化试验
2.1.1提取溶剂的选择 取空白样品,分别加入五氯硝基苯和百菌清各1、3、5 μg,按1.2.3前处理方法操作,并分别以乙腈和正己烷为提取溶剂,在1.2.1条件下测定,比较两者的提取效率,结果显示,正己烷的提取效率优于乙腈。见图1。
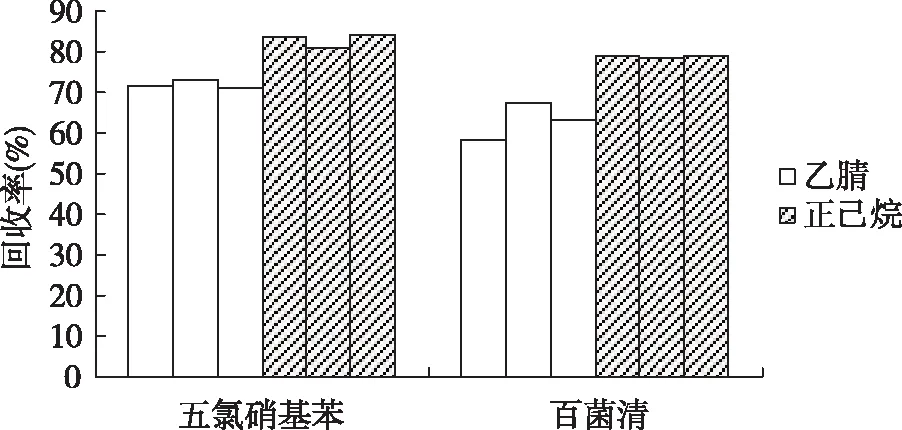
图1 不同溶剂对回收率的影响Fig.1 Effect of different solvents on recovery rate
2.1.2超声温度对提取效率的影响 取空白样品,加入五氯硝基苯和百菌清各3 μg,按1.2.3项下的前处理方法操作,并改变超声温度,在1.2.1条件下测定。结果显示,五氯硝基苯和百菌清的提取效率在20~30 ℃时最高。见图2。
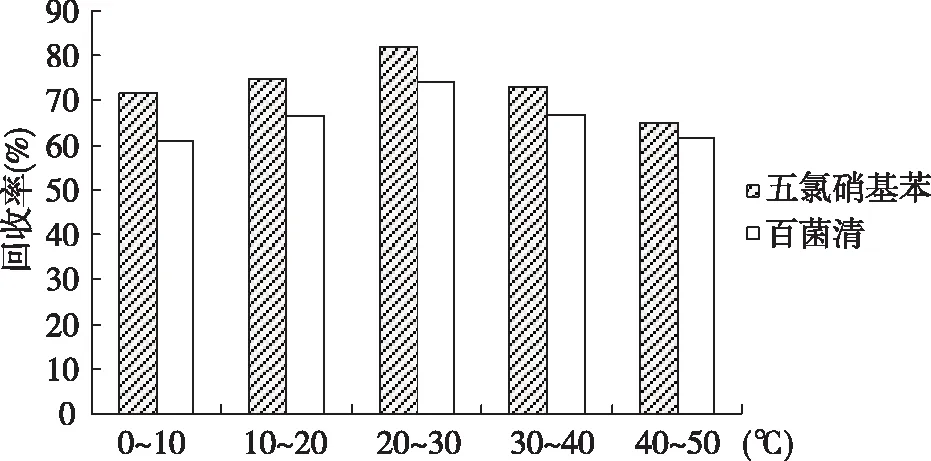
图2 超声温度对提取效率的影响Fig.2 Effect of ultrasound temperature on extraction efficiency
2.2 专属性试验
取15 g空白样品,加入50 μL混合标准溶液,按1.2.3项下的前处理方法操作,按照1.2.1条件采用全扫描模式测定,经NIST谱库检索结果显示,色谱峰1为五氯硝基苯、保留时间为14.128 min,色谱峰2为百菌清、保留时间为14.966 min,两峰完全分离。见图3。
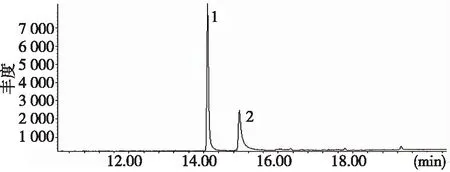
注:1为五氯硝基苯,2为百菌清图3 五氯硝基苯和百菌清总离子流色谱图Fig.3 Total ion chromatography of pentachloronitrobenzene and chlorothalonil
2.3 线性关系试验

2.4 方法检出限试验
取空白样品,分别按1.2.3项下的前处理方法和NY/T 761-2008前处理方法操作,在1.2.1条件下连续测定11次,以3倍信噪比计算五氯硝基苯和百菌清的方法检测限。结果表明,本文选用的前处理方法与NY/T 761-2008前处理方法的五氯硝基苯检出限分别为0.006 7 μg/g和0.007 2 μg/g、百菌清检出限分别为0.003 2 μg/g和0.004 1 μg/g,本文前处理方法相对于NY/T 761-2008前处理方法有较高的灵敏度。
2.5 回收率和精密度比对试验
取同批次蔬菜捣碎匀浆后,精密称取48份样品各15 g,均分为两组,分别按1.2.3项下的前处理方法和NY/T 761-2008前处理方法处理样品, 按照1.2.1条件进行加标回收率和精密度试验,结果显示,本文采用的前处理方法获得的五氯硝基苯和百菌清回收率分别为81.2%~84.1%和78.3%~79.0%,RSD分别为4.9%~6.4%和4.5%~5.4%,满足《实验室质量控制规范食品理化检测》要求[17],相对于NY/T 761-2008前处理方法具有较好的准确度和精密度。见表1。
2.6 样品测定
分别取3个批次的蔬菜样品,按1.2.3方法处理、并在1.2.1仪器条件下测定,五氯硝基苯和百菌清均未检出,符合我国国家标准《GB2763 -2016食品中农药最大残留限量》规定限量要求[4]。

表1 两种前处理方法的回收率和精密度比较(n=6)Tab.1 The comparison of recovery and precision of two pretreatment methods
3 讨论
蔬菜中色素较多,在农药残留测定中将增加基质干扰,使灵敏度降低,且对色谱柱污染较为严重,故在样品前处理中有效去除色素较为关键。本文比较农药残留检测中常用的乙腈和正己烷两种提取溶剂,因乙腈极性较大,并能与水互溶,导致提取液中水溶性色素等杂质增加,故乙腈提取液相对于正己烷提取液颜色较深;另乙腈沸点高于正己烷,故其提取液浓缩时间较长,将增大目标物损失的可能性。从图1可以看出,正己烷对目标物的提取率较高,并能有效分离去除水溶性杂质,缩短样品前处理时间。通过比较QuEChERS和Florisil-SPE两种样品净化方式,QuEChERS净化柱对目标物吸附损失较小,且除杂效果较好,操作较简便,溶剂用量较少,能有效提高检测的灵敏度、精密度和准确度,故其在农药残留检测中将更容易被推广使用。样品前处理过程中,超声温度对农药残留测定结果影响较大,温度过低则目标物提取效率较低,温度过高则目标物挥发损失较大。图2表明,五氯硝基苯和百菌清的超声提取温度在20~30 ℃时较为适宜。
由于近年来农药限制使用及其残留量监测力度加强,且采样时期恰逢雨季,较难在市场上采集到五氯硝基苯和百菌清残留的样品,故样品测定时均未检出五氯硝基苯和百菌清,但从本文专属性、检出限、精密度、回收率等方法学试验和方法比对试验可以看出,本文方法同时测定蔬菜中五氯硝基苯和百菌清残留具有较好的适用性和优越性。本文在前研究基础上,经方法学试验和方法比对试验,优化建立了GC-MS测定蔬菜中五氯硝基苯和百菌清残留量的QuEChERS 样品前处理新方法,该方法具有提取效率高、除杂效果好、操作简便、溶剂使用量少等特点,缩短了样品前处理时间,提高了蔬菜中五氯硝基苯和百菌清检测的灵敏度、精密度和准确度,适用于蔬菜中五氯硝基苯和百菌清残留量同时测定,能为其他农药残留检测提供方法参考,促进食品农药残留监测标准提升,并对QuEChERS前处理方法推广应用具有积极作用。

