Cas9蛋白的克隆表达、分离纯化及多克隆抗体制备*
刘芳, 卢婷, 蔡梦迪, 吴芳草, 陈相好,3, 王彩霞, 崔古贞, 陈峥宏**
(1.贵州医科大学 基础医学院 微生物学教研室, 贵州 贵阳 550025; 2.贵州省普通高等学校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.贵州医科大学 医学检验学院, 贵州 贵阳 550004)
CRISPR-Cas9是近年发展起来的能够在活细胞中进行基因组精确修饰的一种新技术,可快速实现基因的定点敲除、敲入、置换及突变等多项功能,被赋予生命科学领域“游戏规则改变者”的称号[1-4]。CRISPR-Cas9系统主要由gRNA(指导RNA)和Cas9核酸酶两大功能原件组成,gRNA作为“向导”,具有特异性,可通过碱基互补配对原则识别DNA靶位点;Cas9核酸酶作为DNA“剪刀”,可以切割DNA靶位点,从而在靶位点引入DNA损伤。DNA损伤可以激发细胞自身的修复机制,从而实现基因的置换、敲除或敲入等多项功能[3,5]。目前,应用最广泛的CRISPR-Cas9系统是来源于化脓链球菌(Streptococcuspyogenes)的CRISPR-Cas9系统[6],该系统因其基因编辑效率高、打靶精度高、物种差异性低等特点,已在细菌[7-9]、真菌[10-13]、植物[14-15]、动物及人类[16-19]等多个物种中获得广泛应用。利用CRISPR-Cas9系统在同一物种或不同物种中进行基因编辑或功能验证时,往往需要大量Cas9特异性抗体检测基因编辑的效果。因此,本文以来源于化脓链球菌的Cas9(Spy-Cas9)基因序列为模板,设计基因表达载体,并实现其在大肠杆菌中的大量表达;然后,以纯化获得的Spy-Cas9蛋白免疫新西兰大白兔并纯化获得高质量的多克隆抗体,为后续CRISPR-Cas9系统的机理研究和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1菌株、质粒和引物E.coliDH5α、E.coliBL21(DE3)购于天根生化科技有限公司,pWTCas9-NHEJ质粒(携带化脓链球菌Cas9基因)由山东大学微生物学国家重点实验室赠送,pET28a质粒由本实验室保存,PCR扩增Cas9基因所用引物PET28a-Cas9-F为GTCGACGGAGCTCGAATTCGTCAGTCACCTCCTAGCTG-ACTC,PET28a-Cas9-R为GTGGACAGCAAATGGGTCGCGGAATGGATAAGAAATACTCAATAG。
1.1.2主要试剂和仪器 无缝拼接试剂盒(pEASY-Uni Seamless Cloning and Assembly Kit, CU101)购自北京全式金生物技术有限公司,普通琼脂糖凝胶回收试剂盒与质粒小提试剂盒购自北京天根生化科技有限公司,DNA聚合酶购自北京全式金生物技术有限公司,限制性内切酶购自赛默飞世尔科技(中国)有限公司,His-Tag蛋白纯化柱(ProteinIsoNi-NTA Resin)购自北京全式金生物技术有限公司,其他常规分子生物学试剂盒生化试剂均购自国药有限公司。主要仪器包括PCR扩增仪(日本,BIO-Rad 10213型),琼脂糖凝胶电泳仪(北京市六一仪器制造厂,DYY-8C型),蛋白电泳仪(北京君意东方电泳设备有限公司,JY-SCZ2+),核酸蛋白微量分析仪(ND2000),凝胶成像分析仪(北京市六一仪器制造厂,WD-9413B型),电热恒温水浴箱(北京,HH-W21-CR600型),台式高速离心机(上海安亭,TGL-16B),超声波破碎仪(宁波新芝生物科技有限公司)。
1.2 方法
1.2.1pET28a-Cas9表达载体的构建 以pWTCas9-NHEJ质粒为模板、PET28a-Cas9-F/PET28a-Cas9-R为引物,PCR扩增获得Cas9基因全长序列;利用BamHI单酶切质粒pET28a、无缝组装试剂盒构建pET28a-Cas9质粒,将组装产物转化E.coliDH5α;然后利用菌落PCR验证目的质粒 pET28a-Cas9,将验证正确的质粒送至生工生物工程(上海)股份有限公司进行核酸序列测序。
1.2.2Cas9蛋白的诱导表达检测 将质粒pET28a-Cas9转化E.coliBL21(DE3),挑取单菌落接种到4~5 mL含卡那霉素的LB液态培养基中,37 ℃、180 r/min过夜培养,次日取菌液70μL接种到7 mL含卡那霉素的液态LB培养基中,37 ℃、180 r/min培养至菌液OD600=0.5~0.6时,取1 mL菌液12 000 r/min,1 min,-20 ℃冻存沉淀;剩余菌液加入诱导剂IPTG至终浓度为1 mmol/L、37 ℃、180 r/min继续培养,每隔1 h取样检测蛋白诱导表达情况。
1.2.3SDS-PAGE 取上述诱导表达的样品进行SDS-PAGE检测,SDS-PAGE检测方法见参考文献[20]。
1.2.4Cas9蛋白分离纯化及优化 取菌液50 μL接种于100 mL含卡那霉素的LB液态培养基,37 ℃、180 r/min过夜培养,次日将菌液全部移至1 L含卡那霉素的LB液态培养基培养至菌液OD600=0.5~0.6时向其中加入诱导剂IPTG至终浓度为1 mmol/L,诱导3 h后收集菌体。弃上清,按每毫升菌体5~10 mL咪唑平衡缓冲液(10 mmol/L、pH 8.0)的比例重悬菌体,进行超声波破碎(每次10 s、间隔10 s、破碎60 min),然后离心30 min(4 ℃,12 000 r/min)取上清,再用0.45 μm孔径的滤膜过滤上清。利用His-Tag技术进行纯化:(1)装柱(根据待纯化蛋白量的多少,取适量介质加入到层析柱中,静置数分钟待液体流尽),(2)平衡层析柱[取5~10倍柱体积的(10 mmol/L、pH 8.0)咪唑平衡缓冲液于层析柱中,静置数分钟待液体流尽],(3)上样(将样品少量多次加入到层析柱,静置3 min左右再流出),(4)洗涤蛋白,收集流出液[上样结束之后,少量多次加入5~10倍纯化介质(10 mmol/L、pH 8.0)的咪唑平衡缓冲液],(5)洗脱目的蛋白(用含10mmol/L、20mmol/L、50mmol/L不同咪唑浓度的平衡缓冲液依次洗脱10个柱体积),(6)用500 mmol/L的咪唑浓度平衡缓冲液(pH 8.0)洗脱5个柱体积,期间静置30 min,收集流出液并进行SDS-PAGE电泳检测纯化效果。
1.2.5多克隆抗体制备及效价测定 (1)动物免疫,选用4月龄健康雌性新西兰大白兔,体质量2.1 kg。第1次免疫使用弗氏完全佐剂,第2、3、4次免疫使用弗氏不完全佐剂。免疫过程如下:第1次免疫后的第21天、35天进行第2、3次免疫,第3次免疫后的1周时(第42天)采集兔耳静脉血1 mL、ELISA检测抗血清效价;在第49天进行第4次免疫,之后1周时采集兔耳静脉血1 mL、ELISA检测抗血清效价,第57天时进行颈动脉采血检测相同指标。(2)间接ELISA检测抗血清效价,将抗原用碳酸盐(0.05 mol/L、pH=9.6)按0.2 μg/孔包板,4 ℃孵育过夜;取出,用0.05%Tween-20洗板3次(3 min/次),每孔加入100 μL含5%脱脂奶粉的封闭液,37℃、封闭60 min,洗板3次后加一抗(将兔子的血清分别按照1∶1 000倍比稀释,37 ℃ 孵育1 h),洗板3次后加二抗(辣根酶标记山羊抗兔IgG,按照1∶8 000倍比稀释,37 ℃孵育45 min),洗板3次后加入底物溶液(100 μL/孔),反应15 min,再加入100 μL硫酸(2 mol/L)终止反应,使用酶标仪(科华ST-360)在450 nm波长下测定OD值。
2 结果
2.1 pET28a-Cas9质粒构建及验证
利用无缝组装试剂盒将PCR扩增获得的约4.1 kb的目的片段与经BamHI单酶切pET28a载体组装(图1a、1c),转化E.coliDH5α,利用特异性引物PET28a-Cas9-F/PET28a-Cas9-R进行菌落PCR验证。菌落PCR结果表明,获得的单一目的条带与预期大小一致(图1b)。DNA测序表明成功构建Cas9表达载体pET28a-Cas9。
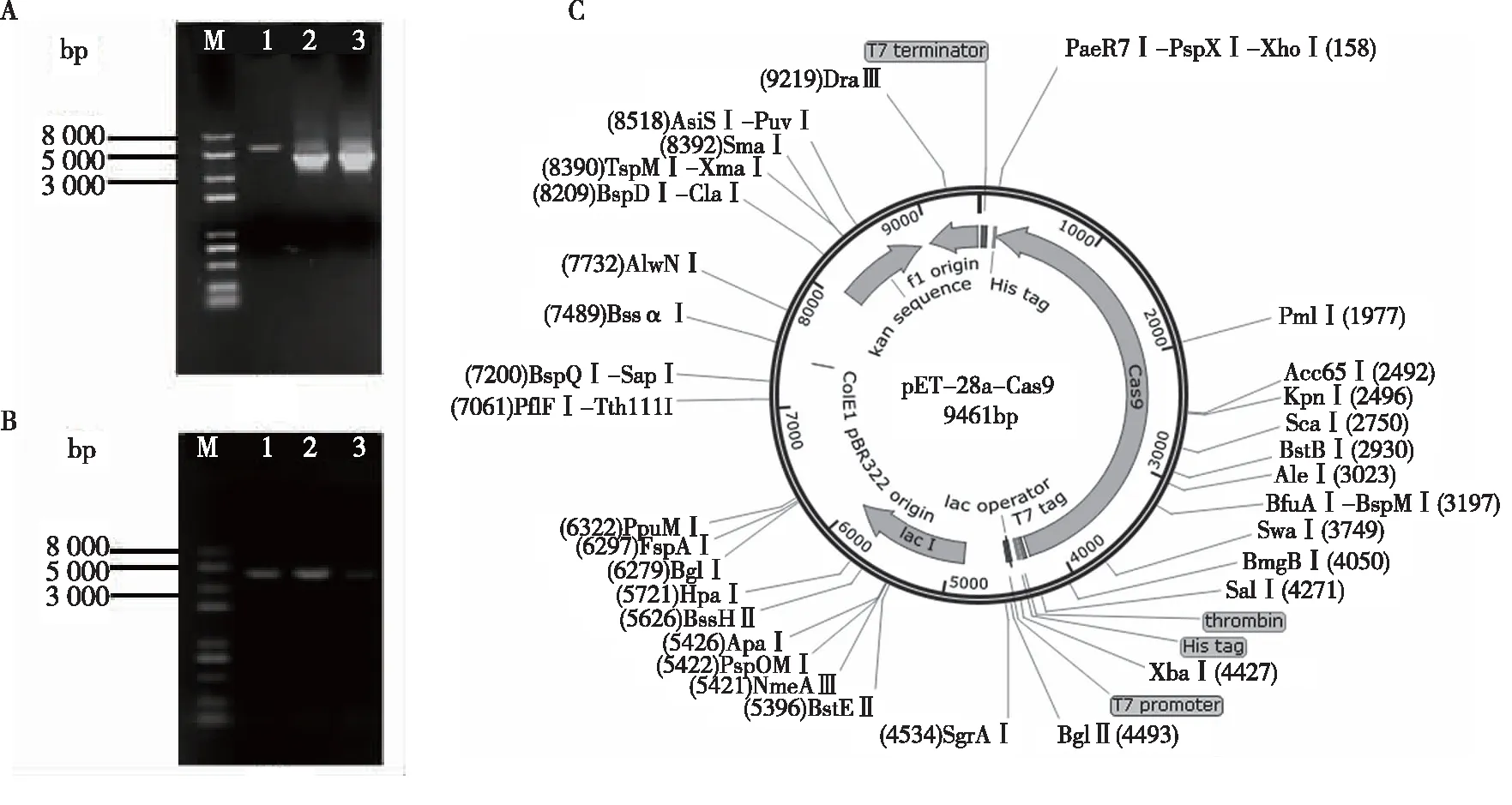
注:M为Trans2K Plus II DNA Marker;A为pET28a酶切电泳图及Cas9基因PCR扩增,泳道1为pET28a经 BamHI 单酶切,泳道2~3为Cas9基因PCR扩增条带;B为菌落PCR凝胶电泳图,泳道1~3为菌落PCR扩增Cas9基因条带,C为pET28a-Cas9质粒图图1 pET28a-Cas9质粒构建及鉴定Fig.1 Construction and identification of pET28a-Cas9 plasmid
2.2 Cas9蛋白诱导表达
将测序验证正确的pET28a-Cas9质粒转化E.coliBL21(DE3),1 mmoL IPTG诱导表达,超声破碎后离心取上清进行SDS-PAGE电泳检测。图2所示,在约160 kDa处出现特异性条带,随着诱导时间的延长,浓度逐渐增加,而空载体并没有特异性条带出现,表明Cas9获得成功表达。
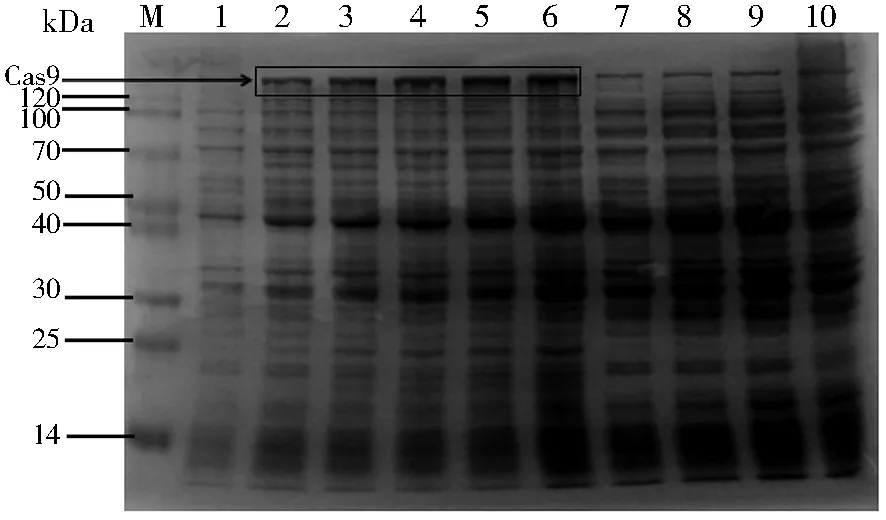
注:M为Blue Plus II Protein Marker,泳道1为pET28a-Cas9 转BL21(DE3)后未加IPTG,泳道2~6为pET28a-Cas9转 BL21(DE3)后经IPTG诱导分别依次隔1 h取样(泳道2、 3、4、5及6分别为IPTG诱导1、2、3、4及5 h),泳道7为 pET28a空质粒转BL21(DE3)后未加IPTG,泳道8~ 10为pET28a空质粒转BL21(DE3)后经IPTG诱 导于1、2及3 h时取样图2 Cas9蛋白的诱导表达Fig.2 Induced expression of Cas9
2.3 Cas9蛋白的分离纯化及优化
将分离纯化得到的 Cas9蛋白洗脱液用SDS-PAGE进行检测,图3所示,洗脱的第2~5柱体积蛋白浓度较高、纯度较好,适合用于后续抗体的制备。
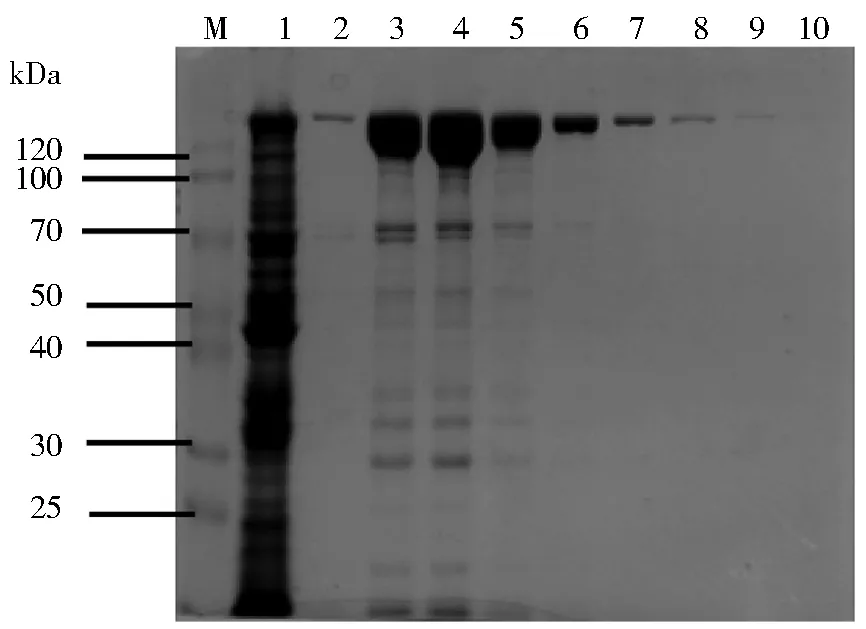
注:M为Blue Plus II Protein Marker,泳道1为未纯化的 细胞破碎上清液,泳道2~10为使用500 mmol/L 咪唑浓度缓冲液依次洗脱的样品图3 Cas9蛋白的分离纯化Fig.3 Isolation and purification of Cas9 protein
2.4 Cas9抗体制备及ELISA效价检测
利用优化的Cas9蛋白纯化方法大量制备Cas9蛋白,然后分别免疫健康雌性新西兰大白兔A、B、C、D,经过3次免疫后4只雌性新西兰大白兔抗血清效价分别为A≥64 K、B≥32 K、C≥32 K、D≥32 K;在第57天时进行颈动脉采血后抗血清效价分别为A≥512 K、B≥64 K、C≥64 K、D≥512 K(表1);最后将获得的血清进行纯化,纯化抗体的效价分别为 A≥128 K、B≥128 K、C≥256 K、D≥256 K(表2)。
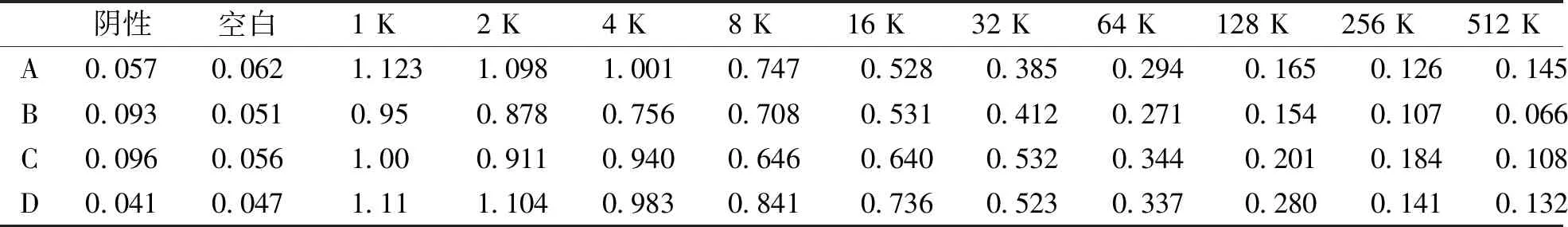
表1 在第57天时颈动脉血标本抗血清效价(OD450)Tab.1 Anti-serum titer detection after carotid blood collection on day 57
注:K表示“千”,血清效价值为≥2.5×阴性值
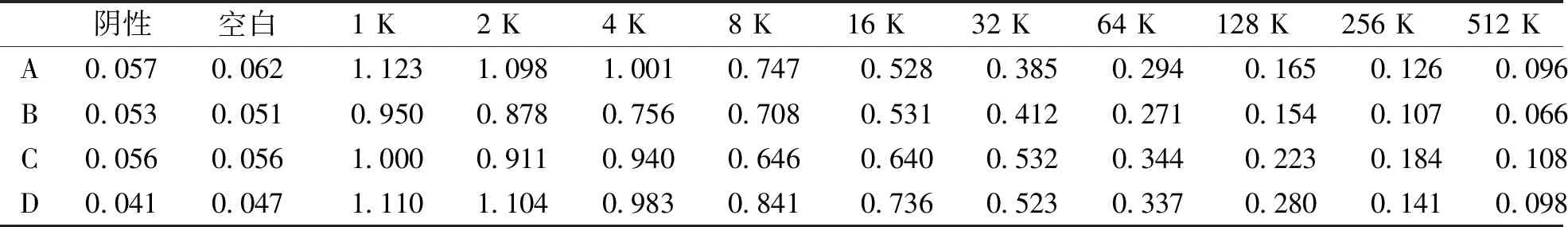
表2 纯化抗体效价检测(OD450)Tab.2 Purified antibody titer assay
注:K表示“千”,血清效价值为≥2.5×阴性值
3 讨论
Cas9蛋白是CRISPR-Cas9基因编辑系统的一个重要原件,约为160 kDa,普遍存在于细菌体内。野生型细菌内Cas9蛋白表达量较低,不足够用于研究,因此通过构建表达载体使Cas9蛋白在细菌体内大量表达。大肠杆菌存在多种蛋白的表达基因,在经过IPTG诱导后会表达出除Cas9蛋白之外的许多杂蛋白,其表达和分离纯化存在一定的困难。目前虽有商业销售的Cas9蛋白抗体,但价格昂贵[21-23]。本文通过优化纯化条件,最终获得了较高纯度的Cas9蛋白,并以此免疫新西兰大白兔,获得多克隆抗体。然而,本研究获得的多克隆抗体其效价不高、且抗体纯化后的效价低于血清效价,这可能与免疫的动物类型、免疫时间间隔、免疫剂量、抗体纯化方法等多种因素有关。因此,在后续的研究中,本研究将进一步优化抗体制备流程,为CRISPR-Cas9基因编辑系统提供更优良的抗体。

