改进的QuEChERS-高效液相色谱-串联质谱法同时测定蔬菜水果中百菌清及其代谢物残留
毕瑞锋, 邓锁成, 付 萌, 张伟伟, 张义霞
(1. 诺安实力可商品检验(青岛)有限公司,山东 青岛 266012;2. 梅里埃营养科学集团(中国) 研发部,山东 青岛 266012)
百菌清是一种广谱高效保护性杀菌剂,广泛应用于水果、蔬菜、水稻等农作物种植过程中真菌性病害的防治。4-羟基百菌清是百菌清的主要代谢物,与百菌清母体相比,4-羟基百菌清的毒性更强[1]。鉴于百菌清对鱼类和两栖类动物有较高风险,且降解产物也可能对地下水有较高污染,自2019 年5 月20 日起,欧盟不再批准百菌清的再评审申请[2]。中国虽然批准百菌清在多种农作物上使用,但要求百菌清残留量低于GB 2763—2021 规定的最大残留限量 (MRL)[3]。与GB 2763—2021 规定的百菌清的残留物定义不同,中国农业农村部规定在农药登记残留试验和植物源性食品膳食风险评估时百菌清的残留物定义为百菌清和4-羟基百菌清,即需要同时检测百菌清和4-羟基百菌清。
百菌清的检测方法主要有气相色谱法[4-8]、气相色谱-质谱法[9-12]、气相色谱-串联质谱法[13];4-羟基百菌清的检测方法主要是液相色谱-电喷雾离子源-串联质谱法[6,8,14]。尽管目前已经有甲酯化衍生-气相色谱法[15]、高效液相色谱法[16]和酶联免疫法[17]等百菌清和4-羟基百菌清的同时检测方法,但这些方法存在操作步骤繁琐、灵敏度低和易受干扰等缺点,实际应用较少,迫切需要建立灵敏度高、专属性好和操作简便的可同时检测百菌清和4-羟基百菌清的分析方法。大气压化学电离源(APCI) 可以实现百菌清分子的软电离,李凌云等[18]采用液相色谱-大气压化学电离源-串联质谱法建立了蔬菜中百菌清的检测方法,不过该方法没有解决百菌清在芸薹属类蔬菜中回收率低的问题。
QuEChERS 方法是近些年发展起来的农药残留检测样品前处理技术,具有操作简便、分析速度快及溶剂用量少等诸多优点,适用于提取蔬菜水果中不同极性范围的农药残留。采用QuEChERS方法提取百菌清时回收率往往偏低,这主要与pH值和基质种类有关。本研究以改进的QuEChERS技术作为前处理方法,采用配备APCI 源的高效液相色谱-三重四极杆串联质谱 (HPLC-MS/MS) 进行检测,建立了蔬菜水果中百菌清及其代谢物4-羟基百菌清残留的快速同时检测方法。
1 材料与方法
1.1 仪器与试剂
AB Sciex 6500 QTRAP 型HPLC-MS/MS 仪,配有APCI 源 (美国AB Sciex 公司);旋涡混合器(德国IKA 公司);Geno/Grinder 组织研磨机 (美国SPEX SamplePrep 公司);X3R 型台式离心机 (美国Thermo-Fisher 公司);50 mL 聚丙烯离心管 (美国BD 公司) 。
百菌清(chlorothalonil,纯度98.51%) 和4-羟基百菌清(chlorothalonil-4-hydroxy,纯度99.0%)标准品 (德国Dr. Ehrenstorfer 公司);乙腈和甲醇(HPLC 级,美国Merck 公司);甲酸铵 (色谱纯,上海安谱实验科技股份有限公司);乙酸 (分析纯,美国Sigma 公司);浓硫酸(分析纯,烟台远东精细化工有限公司);磷酸 (分析纯,国药集团化学试剂有限公司);乙酸钠和氯化钠 (分析纯,江苏强盛功能化学有限公司);无水硫酸镁 (分析纯,西陇科学股份有限公司);试验用水为纯净水。
1.2 样品前处理
准确称取10 g (精确至0.01 g)经均质处理的新鲜蔬菜水果样品,置于50 mL 离心管中,加入1 mL 10%硫酸溶液,涡旋混合1 min,加入10 mL乙腈,置于组织研磨机上剧烈振摇1 min。分别加入1 g 氯化钠和4 g 无水硫酸镁,立即摇散,再置于组织研磨机上剧烈振荡1 min,然后以3 500 r/min离心5 min,取上清液过0.22 μm 尼龙滤膜,待测。
1.3 标准溶液配制及标准曲线绘制
百菌清标准储备液:准确称取10 mg (精确至0.01 mg) 百菌清标准品于10 mL 容量瓶中,用乙酸乙酯溶解并且定容至刻度,于 -18 ℃避光保存。
4-羟基百菌清标准储备液:准确称取10 mg(精确至0.01 mg) 4-羟基百菌清标准品于10 mL容量瓶中,用甲醇溶解并且定容至刻度,于 -18 ℃避光保存。
5 mg/L 标准工作溶液:移取适量标准储备液,用体积分数为1%的硫酸-乙腈溶液配制成质量浓度为5 mg/L 的标准工作溶液,于4 ℃冰箱避光保存。标准工作溶液经28 d 的稳定性考察,百菌清和4-羟基百菌清的损失均小于10%,故将有效期定为28 d。
以结球甘蓝空白样品为例,按照1.2 节的方法提取样品,得到空白基质溶液,用该空白基质溶液将标准工作溶液稀释成0.005、0.01、0.02、0.05、0.1、0.2 mg/L 的系列基质匹配标准溶液,进行HPLC-MS/MS 分析,外标法定量。以百菌清和4-羟基百菌清的峰面积为纵坐标 (y),质量浓度为横坐标 (x),绘制基质匹配标准曲线,权重选择1/x。
1.4 仪器检测条件
色谱条件:Phenomenex Kinetex 色谱柱(100 mm × 2.1 mm,2.6 μm);柱温40 ℃;流动相A 为乙腈,B 为5.0 mmol/L 甲酸铵水溶液;流速0.7 mL/min。梯度洗脱程序:0~0.5 min,10% A;>0.5~5.5 min,10% A~95% A;>5.5~7.5 min,95% A;>7.5~7.6 min,95% A~10% A;>7.6~10.0 min,10% A。进样量1 μL。
质谱条件:APCI 源;负离子扫描模式;多反应监测 (MRM) 模式;气帘气压力1.38 × 105Pa;碰撞气压力6.21 × 104Pa;电晕针电流3 μA;蒸发温度550 ℃;喷雾气压力3.45 × 105Pa。其他质谱参数见表1。
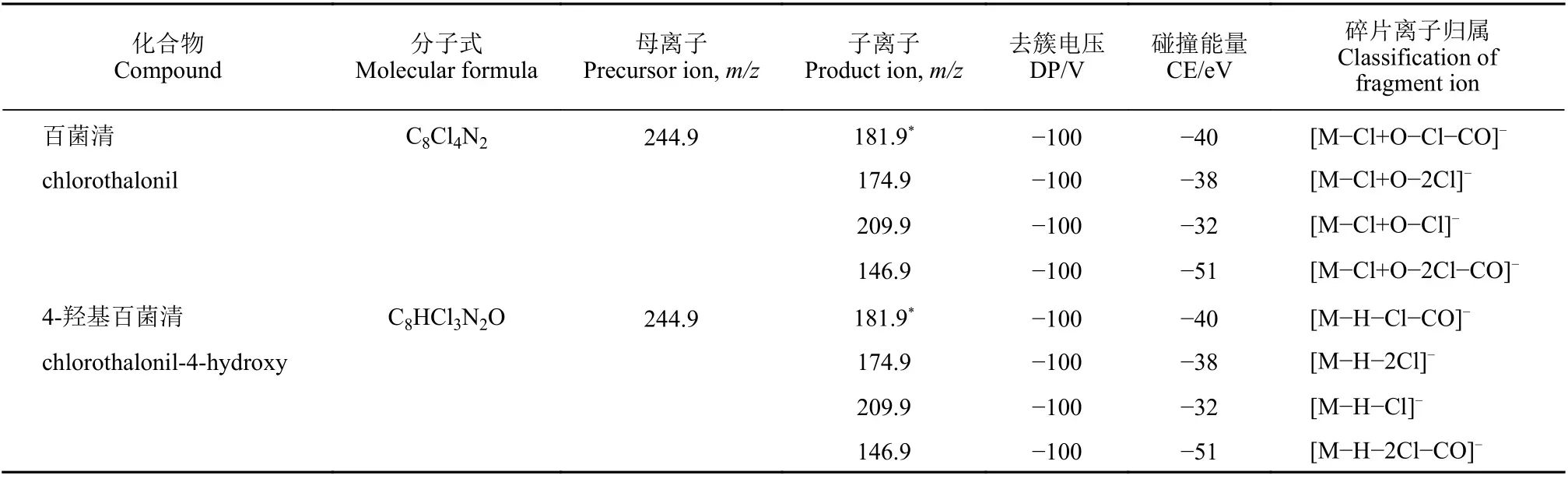
表1 百菌清及其代谢物的质谱参数Table 1 Mass parameters of chlorothalonil and its metabolite
2 结果与分析
2.1 质谱条件的建立
在APCI 负离子模式下,分别对百菌清和4-羟基百菌清标准溶液进行母离子扫描,未检测到百菌清的准分子离子峰,但能检测到比百菌清相对分子量小于19 u 的离子峰m/z244.9、m/z246.9和m/z248.9,同位素丰度比为3 : 3 : 1,根据此结果并结合文献报道[18],可以推测该离子峰是百菌清分子发生脱氯加氧亲核取代反应后的产物离子[M-Cl + O]-,这与4-羟基百菌清扫描得到的准分子离子峰[M-H]-的质荷比及同位素丰度比一致,百菌清和4-羟基百菌清的母离子均为m/z244.9。
进行子离子模式扫描,在百菌清和4-羟基百菌清的二级质谱图中,均得到m/z146.9、m/z174.9、m/z181.9 和m/z209.9 较强的碎片离子。推测m/z209.9 为母离子失去一个Cl 原子后的碎片离子,m/z174.9 为母离子失去两个Cl 原子后的碎片离子,m/z181.9 为母离子失去一个Cl 原子和一个羰基后的碎片离子,m/z146.9 为母离子失去两个Cl 原子和一个羰基后的碎片离子。对去簇电压和碰撞能量进行优化,优化后的质谱参数见表1。在优化后的质谱条件下进行MRM 模式检测,无论是百菌清还是4-羟基百菌清,均是m/z181.9 离子的响应最高,因此选择m/z181.9 作为定量离子,剩余3 个响应较弱的离子m/z174.9、m/z209.9 和m/z146.9 作为定性离子,百菌清和4-羟基百菌清共用定量和定性离子通道。
2.2 色谱条件的建立
考察了甲醇-5 mmol/L 甲酸铵水溶液、乙腈-5 mmol/L 甲酸铵水溶液作为流动相时百菌清和4-羟基百菌清的色谱行为和响应灵敏度。结果显示:有机相无论采用甲醇还是乙腈,两个目标分析物在色谱柱上均能获得良好的保留和分离效果,采用乙腈时两个目标分析物的响应更高,其中4-羟基百菌清的响应为采用甲醇时响应的两倍以上;此外,采用乙腈时仪器系统压力更低。综上,最终选择乙腈-5 mmol/L 甲酸铵水溶液作为流动相。优化后的百菌清及其代谢物的MRM 色谱图见图1。
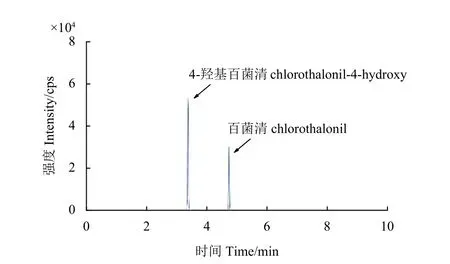
图1 百菌清及其代谢物的MRM 色谱图Fig. 1 MRM chromatogram of chlorothalonil and its metabolite
2.3 前处理方法的优化
百菌清在中性条件下稳定性较差,本研究发现:采用乙腈配制质量浓度为5 mg/L 的百菌清标准溶液,在4 ℃下放置36 h 后,百菌清的浓度降低23.4%,其中14.8%转化为4-羟基百菌清。另有研究发现,采用同样的前处理方式,结球甘蓝、花椰菜等芸薹属类蔬菜基质中百菌清的添加回收率偏低[18],不同样品基质中百菌清的回收率不同。
为提高样品提取过程中百菌清的稳定性和回收率,通常在样品中加入硫酸[4]或者磷酸[5,16],调节提取环境至酸性。本研究中,对传统QuEChERS方法 (AOAC 2007.01) 的前处理步骤进行改进,用硫酸或者磷酸代替乙酸 (0.1 mL)/乙酸钠 (1.5 g) 缓冲盐。选择结球甘蓝作为样品基质,比较了加入不同体积 (0.1、0.5 和1 mL) 10%硫酸或10%磷酸时目标分析物的回收率。为了对比改进效果,同时考察了不添加酸度调节剂和酸度调节剂为乙酸(0.1 mL)/乙酸钠 (1.5 g) 缓冲盐 (传统QuEChERS方法) 时目标分析物的回收率。考察时添加水平为0.2 mg/kg,每处理重复3 次 (n=3) 。
结果 (图2) 发现:1) 对于百菌清,当不添加酸度调节剂时,平均回收率只有10%左右;当添加乙酸/乙酸钠缓冲盐时,平均回收率比不添加酸度调节剂虽有所改善,但回收率和重复性仍比较差,表明传统QuEChERS 方法不适用于结球甘蓝中百菌清的检测;采用10%硫酸溶液作为酸度调节剂,当添加量为0.1 mL 时,百菌清的平均回收率和重复性较差,当添加量大于0.5 mL 时,平均回收率提升到95%以上;采用10%磷酸溶液作为酸度调节剂,添加量为0.1 mL 时,百菌清平均回收率为78%,当添加量大于0.5 mL 时,平均回收率提升到95%以上。2) 对于4-羟基百菌清,不论采用何种酸度调节剂甚至不添加酸度调节剂,回收率都在88%~100%之间,说明酸度调节剂对4-羟基百菌清的回收率影响不大。总之,硫酸和磷酸均可作为酸度调节剂用于QuEChERS 方法检测百菌清和4-羟基百菌清,考虑到QuEChERS 方法中已使用无机盐硫酸镁,故最终选择以10%的硫酸为酸度调节剂,用量为1 mL。无论是在标准工作溶液贮存过程,还是结球甘蓝样品前处理过程,酸性环境中百菌清的稳定性和回收率均更好,因此在检测其他基质样品时均采用酸化乙腈进行提取。
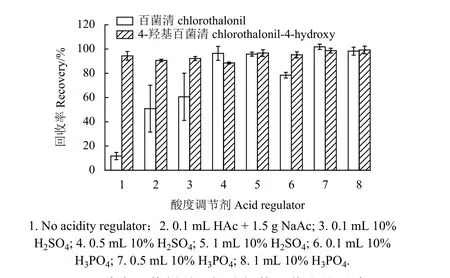
图2 酸度调节剂对目标分析物回收率的影响Fig. 2 Effect of acid regulators on the recoveries of the target analytes
与前人[4-5,16]的前处理方法相比,本研究采用酸化乙腈作为提取溶剂,避免了使用丙酮等不适合直接进行HPLC-MS/MS 分析的提取溶剂,同时省去了溶剂置换和净化等步骤,试验操作更加简单。
2.4 方法的线性范围和定量限
结果 (表2) 表明:百菌清及其代谢物在0.005~0.2 mg/L 范围内线性关系良好,决定系数 (R2) 均大于0.99。选择结球甘蓝空白样品,定量添加标准溶液,按照10 倍信噪比,则百菌清和4-羟基百菌清的定量限均为0.01 mg/kg。

表2 百菌清及其代谢物的线性方程、线性范围、决定系数和定量限Table 2 Linear equations, linear ranges, R2 and LOQs for chlorothalonil and its metabolite
2.5 方法的正确度和精密度
向结球甘蓝、黄瓜、葡萄和苹果4 种基质空白样品中分别添加0.01、0.05 和0.2 mg/kg 3 个水平的百菌清及其代谢物标准溶液,每个水平重复6 次。结果 (表3) 表明:百菌清的平均回收率为83%~104%,相对标准偏差 (RSD) 为1.0%~7.5%,4-羟基百菌清的平均回收率为83%~104%,RSD为0.73%~7.7%,方法的正确度和精密度均满足要求[19]。
表3 百菌清及其代谢物在4 种基质中的添加回收率和相对标准偏差 (n=6)Table 3 Recoveries and RSDs of chlorothalonil and its metabolite spiked in the four matrices (n=6)
2.6 基质效应
通过比较结球甘蓝、黄瓜、葡萄和苹果空白基质匹配标准曲线与溶剂标准曲线的斜率,对基质效应 (Me) 进行评价。当|Me|<20%时可忽略不计;当|Me|>20%时表示存在基质效应,需采用基质匹配标准校正法等方式对基质效应进行校正[20]。本研究表明,百菌清及其代谢物在4 种样品基质中的|Me|值均小于20%,基质效应可忽略,不过为了获得更准确的方法学回收率数据,仍采用基质匹配标准校正法建立工作曲线。
2.7 实际样品测定
采用本研究建立的方法对26 份送至本实验室的蔬菜水果样品进行检测。结果显示:分别有1 份草莓样品、1 份苹果样品和1 份番茄样品检出百菌清,含量分别为0.031、0.015 和0.018 mg/kg;所有样品均未检出4-羟基百菌清。GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》中规定,草莓、苹果和番茄中百菌清的MRL 值分别为5、1 和5 mg/kg[3],根据该标准,本研究所检样品中百菌清的残留量均未超标。
3 结论
采用改进的QuEChERS 方法结合APCI 离子化的高效液相色谱-串联质谱仪,建立了同时测定蔬菜水果中百菌清及其代谢物4-羟基百菌清残留的方法。本方法具有简单快速、准确度高、实用性强等优点。与文献方法[18]相比,本研究解决了百菌清在标准品储存环节和样品前处理过程中易降解的问题,极大提高了方法的可靠性,不仅为开展百菌清的农药登记残留试验和膳食风险评估提供了技术支持,也为蔬菜水果中百菌清的常规监控提供了一种快速手段。

