韭菜灰霉病防治烟剂的筛选与评价
高皓杰, 张兰云, 李桐桐, 赵时峰,李北兴, 慕 卫, 刘 峰*,
(1. 山东农业大学 植物保护学院,山东 泰安 271018;2. 临淄区农业技术服务中心,山东 淄博 255400;3. 莘县农业技术推广中心,山东 聊城 252400)
韭菜灰霉病是我国保护地韭菜上常见的真菌病害,主要由葱鳞葡萄孢菌Botrytis squamosa侵染引起,是典型的气传性病害,易在低温、高湿的情况下发生和流行[1],根据发病症状的不同可分为斑点型、干尖型和湿腐型[2]。叶片作为韭菜的主要食用部分,受灰霉病损害严重,一般可导致减产20 %~30 %,严重时甚至整棚绝产[3],且在采后运输和贮藏期间亦可为害,严重影响着韭菜的产量、品质和经济效益。
目前,施用化学药剂依然是防治韭菜灰霉病最有效的手段,但由于韭菜多种植在低矮的拱棚内,喷雾施药不便操作,所以通常使用烟剂来防治韭菜灰霉病。烟剂受热气化后冷凝成烟雾颗粒,可随空气弥漫分散,在棚室的各个方向和位置沉积,基本不需要借助于机械[4]。烟雾剂颗粒细小,在作物上的沉积密度高[5]。与喷雾施药相比,施用烟剂不仅省力,而且不会增加保护地内的湿度,更有利于防病。目前登记用于韭菜灰霉病的烟剂只有腐霉利,随着使用年限的延长,灰霉病菌对腐霉利的敏感性已有不同程度下降[6],而增加使用频次和剂量又进一步导致了更严重的抗性问题[7],并且由于韭菜收获期很短,很难严格执行农药安全间隔期的规定,因而导致腐霉利残留超标现象普遍[8]。美国环境保护署 (EPA) 认为,腐霉利会对人体内分泌系统产生负面影响[9]。因此,生产上亟待寻找可作为烟剂使用以防治韭菜灰霉病的安全、高效的替代杀菌剂品种。
目前已报道可防治其他蔬菜灰霉病的杀菌剂有咯菌腈、嘧霉胺、乙霉威、异菌脲、啶菌噁唑、氟啶胺、啶酰菌胺、吡唑萘菌胺和氟吡菌酰胺等[10-14],田间施药方式均为喷雾施药。有关这些药剂对韭菜灰霉病菌的抑制活性尚未见报道,能否将其加工成烟剂用于防治韭菜灰霉病亦不明确。因此,本研究对室内抑制韭菜灰霉病菌的高活性杀菌剂品种进行了筛选,并评价了其作为烟剂防治韭菜灰霉病的可行性和安全性,旨在为丰富韭菜灰霉病的防治药剂品种以及田间科学用药提供依据。
1 材料与方法
1.1 供试材料
1.1.1 菌株 于2019 年在山东省泰安市良庄镇韭菜产区随机采集具有灰霉病发病特征的韭菜叶片,在室内采用单孢分离方法进行分离纯化,经形态学和分子生物学鉴定为葱鳞葡萄孢菌Botrytis squamosa[15]。所有菌株于4 ℃下保存,备用。
1.1.2 药剂及试剂 98.5 %腐霉利 (pyocymidone)
原药,四川省宜宾川安高科农药有限责任公司;98 % 嘧霉胺 (pyrimethanil) 原药,95% 咯菌腈(fludioxonil) 原药,98%氟啶胺 (fluazinam) 原药,96%异菌脲 (iprodione) 原药,山东潍坊润丰化工股份有限公司;96%啶菌噁唑 (pyrisoxazole) 原药,沈阳科创化学品有限公司;96% 乙霉威(diethofencarb) 原药,山东亿嘉农化有限公司;以上药剂均用丙酮溶解、稀释,配成1.0 × 104mg/L的母液,于4 ℃黑暗环境下保存,备用。96%氟吡菌酰胺 (fluopyram) 原药,拜耳股份有限公司 (北京) ;96%啶酰菌胺 (boscalid) 原药,山东省潍坊润丰化工有限公司;92% 吡唑萘菌胺(isopyrazam)原药,瑞士先正达作物保护有限公司;以上药剂均用甲醇溶解、稀释,配成1.0 ×104mg/L 的母液,于4 ℃黑暗环境下保存,备用。50%咯菌腈 (fludioxonil) 可湿性粉剂 (WP) ,瑞士先正达作物保护有限公司;50% 啶酰菌胺(boscalid) 水分散粒剂 (WG) ,巴斯夫欧洲公司;10%腐霉利 (pyocymidone) 烟剂 (FU) ,河南省安阳市五星农药厂。
1.1.3 培养基 马铃薯葡萄糖琼脂培养基 (PDA,用于咯菌腈、腐霉利、啶菌噁唑、氟啶胺、乙霉威、异菌脲、啶酰菌胺、氟吡菌酰胺和吡唑萘菌胺的菌丝生长抑制试验) :去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,去离子水1 000 mL;水-琼脂培养基 (WA,用于咯菌腈、腐霉利、嘧霉胺、啶菌噁唑、氟啶胺、乙霉威、异菌脲的孢子萌发抑制试验) :琼脂10 g,葡萄糖20 g,去离子水1 000 mL;酵母膏蛋白胨醋酸盐培养基 (YBA,用于啶酰菌胺、氟吡菌酰胺和吡唑萘菌胺的孢子萌发抑制试验) :酵母膏10 g,细菌蛋白胨10 g,乙酸钠20 g,琼脂15 g,去离子水1 000 mL;天冬酰胺合成培养基 (L-Asn,用于嘧霉胺的菌丝生长抑制试验) :K2HPO41 g,KCl 1 g,MgSO4·7H2O 0.01 g,L-Asn 2 g,葡萄糖20 g,琼脂20 g,去离子水1 000 mL。各培养基中均加入50 mg/L 的链霉素以避免细菌污染。
1.1.4 主要仪器 HD-920 新型洁净工作台 (哈尔滨市东联电子技术开发有限公司北京分公司) ;万分之一分析天平 (北京塞多利亚科学仪器有限公司) ;SPX 型智能生化培养箱 (宁波江南仪器厂);LDZX-50KBS 型立式压力蒸汽灭菌器 (上海申安医疗器械厂) ;Olympus IX-71 光学电子显微镜 (日本奥林巴斯公司) ;Agilent 1200 高效液相色谱仪(HPLC,安捷伦科技有限公司)。
1.2 试验方法
1.2.1 韭菜灰霉病菌对供试杀菌剂的敏感性测定
采用菌丝生长速率法[16]测定9 种杀菌剂对3 株韭菜灰霉病菌菌丝生长的影响,以腐霉利为对照药剂。将灭过菌的培养基冷却至50 ℃左右,将培养基和供试药剂以体积比9 : 1 的比例稀释成梯度浓度,混合均匀后倒入直径为9 cm 的培养皿中,制得系列有效试验浓度的含药培养基平板。其中,吡唑萘菌胺、氟吡菌酰胺、啶酰菌胺、嘧霉胺、异菌脲、乙霉威和腐霉利的最终系列质量浓度均为0、3.125、6.25、12.5、25 和50 mg/L,啶菌噁唑、氟啶胺和咯菌腈的最终系列质量浓度均为0、0.062 5、0.125、0.25、0.5 和1 mg/L。以含有相同体积无菌去离子水的培养基作为对照平板。
灰霉病菌菌落在20 ℃恒温培养箱中培养5 d 后,用直径为5 mm 的打孔器沿边缘打取菌饼,菌丝面向下分别接种于冷却的各平板中央,每处理重复3 次。用封口膜密封,置于20 ℃恒温培养箱中黑暗培养5 d,采用十字交叉法测量各处理的菌落直径,并按公式 (1) 计算各药剂处理对菌丝生长的抑制率 (Id) 。
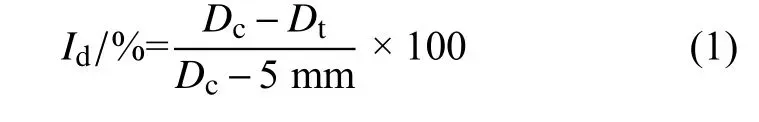
式中:Dc为对照组菌落直径,mm;Dt为处理组菌落直径,mm。
采用孢子萌发法[16]测定10 种杀菌剂对3 株韭菜灰霉病菌孢子萌发的影响,同样以腐霉利为对照药剂。含药培养基平板的制备同菌丝生长抑制作用测定。吡唑萘菌胺、氟吡菌酰胺和啶酰菌胺的最终系列质量浓度均为0、0.125、0.25、0.5、1 和2 mg/L,乙霉威、嘧霉胺、异菌脲、啶菌噁唑、氟啶胺、咯菌腈和腐霉利的最终系列质量浓度均为0、3.125、6.25、12.5、25、50 和100 mg/L。以含有相同体积无菌去离子水的培养基为对照平板。在WA 培养基中加入质量分数为2 %、粉碎后的韭菜叶,接入菌饼,在20 ℃恒温培养箱中培养10 d 后,加入适量无菌水刮洗菌丝,所得悬浮液经3 层灭菌纱布过滤,得到孢子悬浮液。在显微镜下通过血球计数板计数,用无菌水将孢子悬浮液终浓度调至每mL 含1 × 105个孢子。取100 μL 孢子悬浮液均匀涂布至冷却的各平板上,20 ℃黑暗培养10 h 后观察分生孢子萌发情况 (芽管长度超过孢子长度的一半时视为萌发)。每个平板观察20~100 个分生孢子,统计孢子总数及萌发孢子数,根据公式 (2) 计算各药剂处理对孢子萌发的抑制率 (Ig) 。
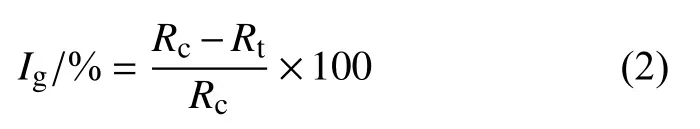
式中:Rc为对照组孢子萌发率,%;Rt为处理组孢子萌发率,%。
1.2.2 烟雾的室内毒力测定 取直径为5 mm 的灰霉病菌菌饼,菌丝面向下接种于冷却的空白PDA 培养基平板,将100 μL 孢子悬浮液均匀涂布于空白WA 培养基平板上,开盖放入如图1 所示的试材放置区内。称取0.01 g 有效成分的原药置于载药罐中,用酒精灯在锡箔纸下方对药剂加热,药剂受热后产生的烟雾在密闭空间里弥漫并最终沉积在菌丝生长和孢子萌发抑制试验平板上。以未经烟雾处理的菌丝和孢子平板为对照。6 h后取出平板并用封口膜密封,置于20 ℃恒温培养箱中黑暗培养。孢子萌发抑制试验平板在培养箱中培养10 h 后取出,于显微镜下观察孢子的萌发情况,每个平板观察20~100 个分生孢子,记录孢子总数及萌发孢子数,并根据公式 (2) 计算各处理的孢子萌发抑制率;菌丝生长抑制试验平板在培养箱中培养5 d 后取出,用十字交叉法测量各处理的菌落直径,按公式 (1) 计算菌丝生长抑制率。
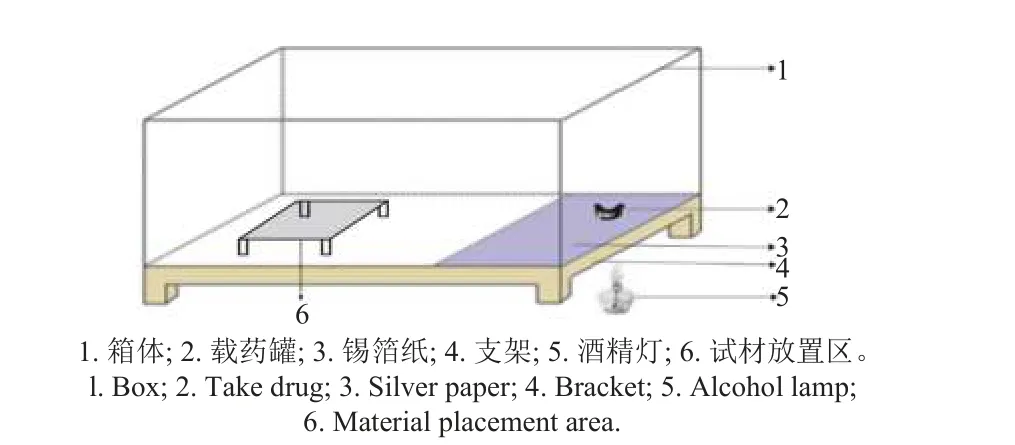
图1 烟雾毒力值测定装置Fig. 1 Apparatus for smoke toxicity test
1.2.3 成烟率测定 参考HG/T 2467.18—2003《农药烟粉粒剂产品标准编写规范》[17]中的有效成分成烟率测定方法并稍作改进。准确称取筛选出的杀菌剂原药0.01 g,放入图2 所示的装置中,分别吸取100 mL 乙腈注入各吸收瓶内;连接好装置后打开真空抽气泵,使系统形成负压,点燃酒精灯加热使药剂产生烟,待产烟完毕后停止抽气。将3 个吸收瓶中的吸收液合并,转移到500 mL 容量瓶中,再用乙腈将整个系统冲洗3 次,冲洗液并入500 mL 容量瓶中并定容;取1 mL 吸收液过净化柱后用乙腈定容于5 mL 容量瓶中。采用高效液相色谱仪检测吸收液中原药有效成分的含量,并按公式 (3) 计算各杀菌剂原药的成烟率 (RS) 。
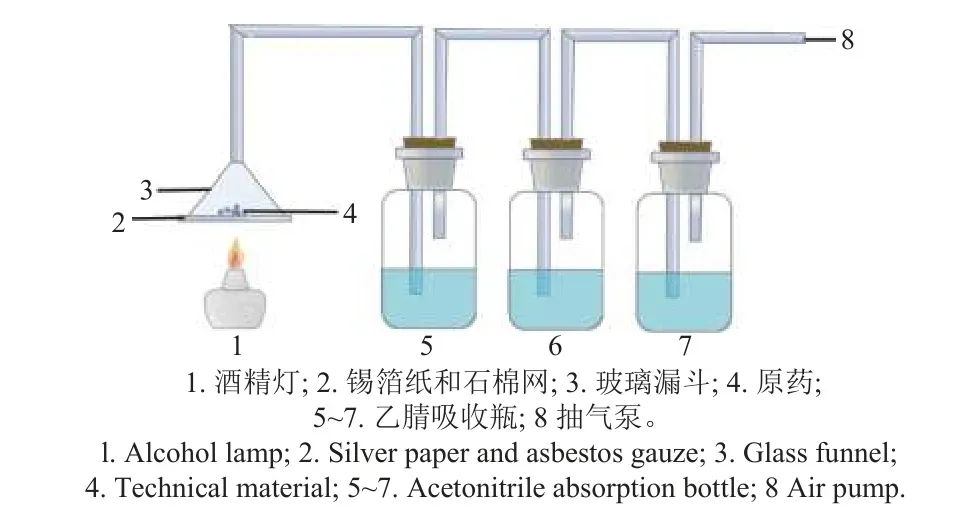
图2 成烟率测定装置Fig. 2 Apparatus for smoking rate test

式中:m1为标样的质量,g;m2为试样的质量,g;γ1为标样溶液中有效成分与内标物峰面积之比的平均值;γ2为试样溶液中有效成分与内标物峰面积之比的平均值; ω2为试样中有效成分的质量分数,%; ω1为原药的质量分数,%。
1.2.4 室内安全性测定 参考NY/T 1965.1—2010《农药对作物安全性评价准则》[18]并稍作改进。采用图1 所示装置,将韭菜盆栽置于试材放置区,根据1.2.3 节的测定结果,按照成烟率大于80%的标准[19-20]从中选择出咯菌腈和啶酰菌胺两种原药,根据10 mg 咯菌腈和啶酰菌胺烟雾对韭菜灰霉病菌菌丝生长的抑制率达到90%以上,分别设置1、2、4 倍剂量,即咯菌腈和啶酰菌胺原药分别按有效成分10、20、40 mg,对韭菜植株进行烟雾施药处理,6 h 后取出。以未经烟雾处理的韭菜盆栽为对照。于施药前和施药后7 d 分别测量对照组与处理组韭菜植株的株高和茎粗。每盆种植5 株韭菜,每处理重复3 次。
1.2.5 田间药效试验 参考GB/T 17980.28—2000《田间药效试验准则》[21],于2019 年12 月在山东省泰安市良庄镇的韭菜大棚内进行,该地块韭菜灰霉病常年自然发生,种植的韭菜品种均为独根红。参考已有的烟剂配方[22],将咯菌腈和啶酰菌胺加工成烟剂,试验用量分别为有效成分60、120 g/hm2和225、375 g/hm2,以有效成分450 g/hm2的商品化10% 腐霉利烟剂为对照药剂。每处理设3 次重复,采用完全随机区组排列,共18 个小区,每小区面积27 m2(3 m × 9 m) 。每小区设置一个施药点,按照与施药点距离由近到远将小区划分为6 个小组。于韭菜灰霉病发生初期施药,施药前调查病情指数,每小组五点取样,每点调查5 棵韭菜,用红绳在韭菜茎部进行标记。于施药后7 d 再次调查病情指数,根据单个叶片上病斑的个数进行分级[21]:0 级,无病斑;1 级,单叶片有病斑3 个;3 级,单叶片有病斑4~6 个;5 级,单叶片有病斑7~10 个;7 级,单叶片有病斑11~20 个,部分密集成片;9 级,单叶片有密集病斑,病斑面积占叶片1/4 以上。
于2020 年12 月在同一韭菜田再次进行试验。对生长期为15 d 并零星出现灰霉病病斑的韭菜田 (治疗作用测定) 和收割后7 d 的韭菜田 (保护作用测定) 分别进行烟剂和喷雾处理,烟剂处理剂量同2019 年田间试验,喷雾对照处理选用商品制剂50%咯菌腈WP 和50%啶酰菌胺WG,施药剂量分别为有效成分60、120 g/hm2和225、375 g/hm2。治疗作用试验韭菜田分别在施药前和施药后7 d 调查病情指数,保护作用试验韭菜田于施药后21 d 调查病情指数。根据公式 (4) 计算病情指数 (Di) ,分别按公式 (5) 和 (6) 计算治疗作用防效(Ec) 和保护作用防效 (Ep) 。

式中:a为病级数;Na为a病级叶片数;n为叶片总数;Dica为对照组药前病情指数;Ditb为处理组药后病情指数;Dicb为对照组药后病情指数;Dita为处理组药前病情指数。
1.2.6 残留消解动态试验 分别于施药后1、3、5、7、10、17、21 d 采集韭菜植株样品,每小组五点取样,每组采集不少于200 g 样品。将采集的韭菜植株样品切碎后匀浆,存放于 -20 ℃冰箱。参照张园园等[21]的方法进行测定,并略做作改进。准确称取10.0 g (精确至 0.01 g) 充分匀浆后的韭菜样品于50.0 mL 离心管中,加入20.0 mL 乙腈,涡旋振荡3 min,再加入1.0 g 氯化钠和4.0 g无水硫酸镁,涡旋振荡提取3 min,于4 000 r/min 离心2 min;取上清液1.5 mL 转入2 mL QuEChERS离心管中 (含50.0 mg PSA、5 mg 多壁碳纳米管和150 mg 无水硫酸镁) ,涡旋振荡3 min,于12 000 r/min 离心2 min;取上清液过0.22 μm 有机滤膜,采用GC-MS/MS 分析。仪器条件:载气为He 气;进样口温度280 ℃;不分流进样;进样量1 μL;EI 离子源,温度300 ℃;传输线温度150 ℃;流速1 mL/min;升温程序:90 ℃ (15 ℃/min) →220 ℃ (30 ℃/min) →280 ℃ (保持8 min) 。
1.3 数据处理
采用DPS V7.05 统计软件计算毒力回归方程和EC50值,运用Duncan 氏新复极差法进行差异显著性检验。统计分析前对田间试验数据进行反正弦转换。
2 结果与分析
2.1 韭菜灰霉病菌对供试药剂的敏感性
结果 (表1) 表明:咯菌腈、啶菌噁唑、氟啶胺对韭菜灰霉病菌菌丝生长的抑制活性较好,EC50值低于0.15 mg/L,且显著高于对孢子萌发的抑制活性,EC50值相差100 倍以上;啶酰菌胺、吡唑萘菌胺和氟吡菌酰胺对孢子萌发的抑制活性略高于对菌丝生长的抑制活性;而嘧霉胺、异菌脲、乙霉威对菌丝生长和孢子萌发的抑制活性均较低,EC50值分别大于10 mg/L 和20 mg/L;对照药剂腐霉利对菌丝生长和孢子萌发的抑制活性最低,其抑制孢子萌发的EC50值大于60 mg/L。
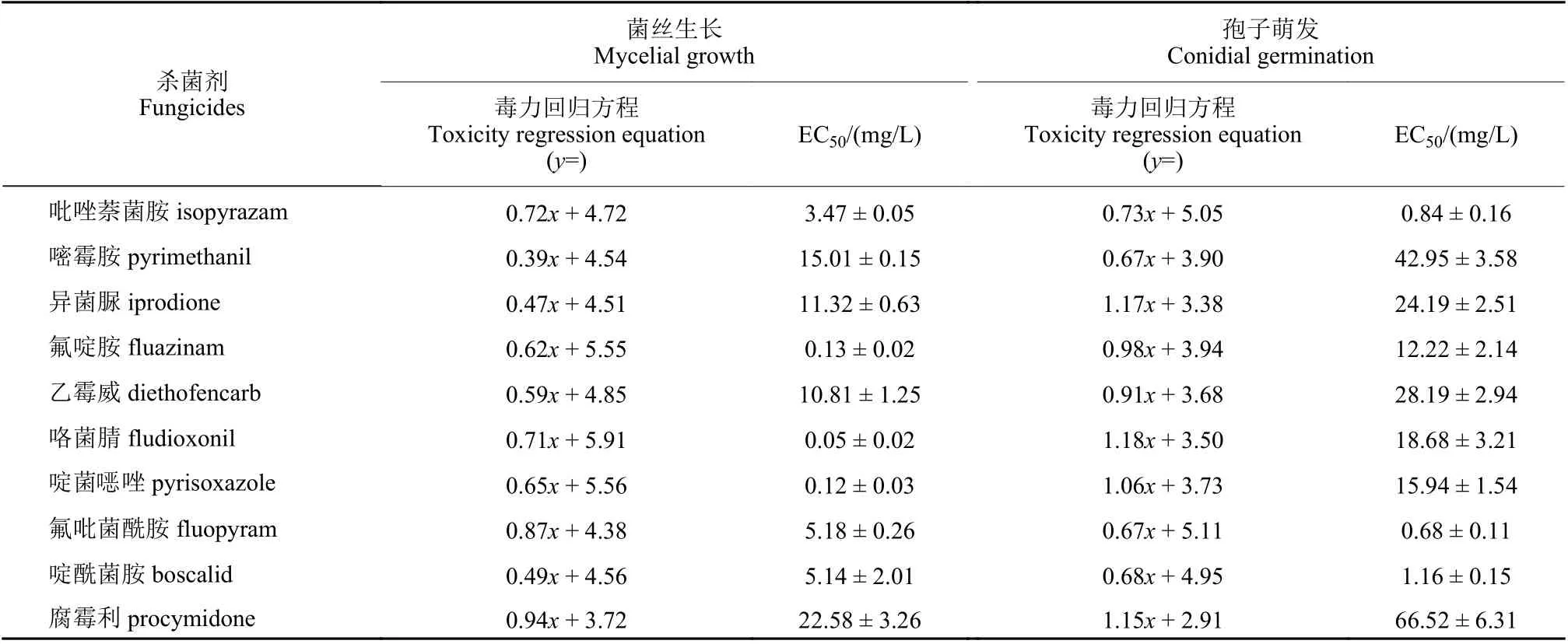
表1 10 种常用杀菌剂对韭菜灰霉病菌的EC50 值Table 1 EC50 values of 10 common fungicides against B. squamosa
2.2 杀菌剂成烟施药对韭菜灰霉病菌的室内毒力
在0.108 m3的密闭装置内,相同有效成分剂量 (0.01g) 的6 种杀菌剂受热成烟后,烟雾对韭菜灰霉病菌的菌丝生长和孢子萌发均有一定的抑制作用,其中咯菌腈烟雾可完全抑制菌丝生长,吡唑萘菌胺、氟吡菌酰胺和啶酰菌胺烟雾可完全抑制孢子萌发,而对照药剂腐霉利对菌丝生长和孢子萌发的抑制率仅为54.3 %和43.3 % (图3) 。

图3 杀菌剂烟雾对韭菜灰霉病菌菌丝生长和孢子萌发的抑制率Fig. 3 Inhibition rate of fungicide smokes against the mycelial growth and conidial germination of B. squamosa
2.3 成烟率
成烟率是烟剂的重要指标之一。研究结果(图4) 表明:咯菌腈、氟吡菌酰胺和啶酰菌胺的成烟率均在80 % 以上,能够达到烟剂成烟率的要求[19-20],而吡唑萘菌胺、啶菌噁唑和氟啶胺的成烟率仅分别为59.39 %、17.82 %和35.82 %,不适合加工成烟剂使用。
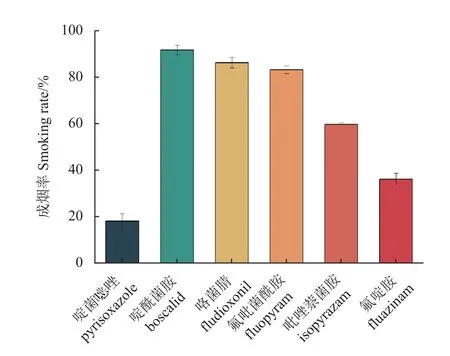
图4 供试6 种杀菌剂的成烟率Fig. 4 Smoking rates of 6 fungicides
2.4 室内安全性
两种烟剂对韭菜生长性状的影响见表2。经咯菌腈和啶酰菌胺烟雾处理7 d 后,与空白对照组相比,韭菜叶片无脱落、畸形、焦枯、穿孔、褪色、黄化等药害症状,株高和茎粗的增加量无明显差异,表明两种杀菌剂烟雾对韭菜植株的生长无不良影响。
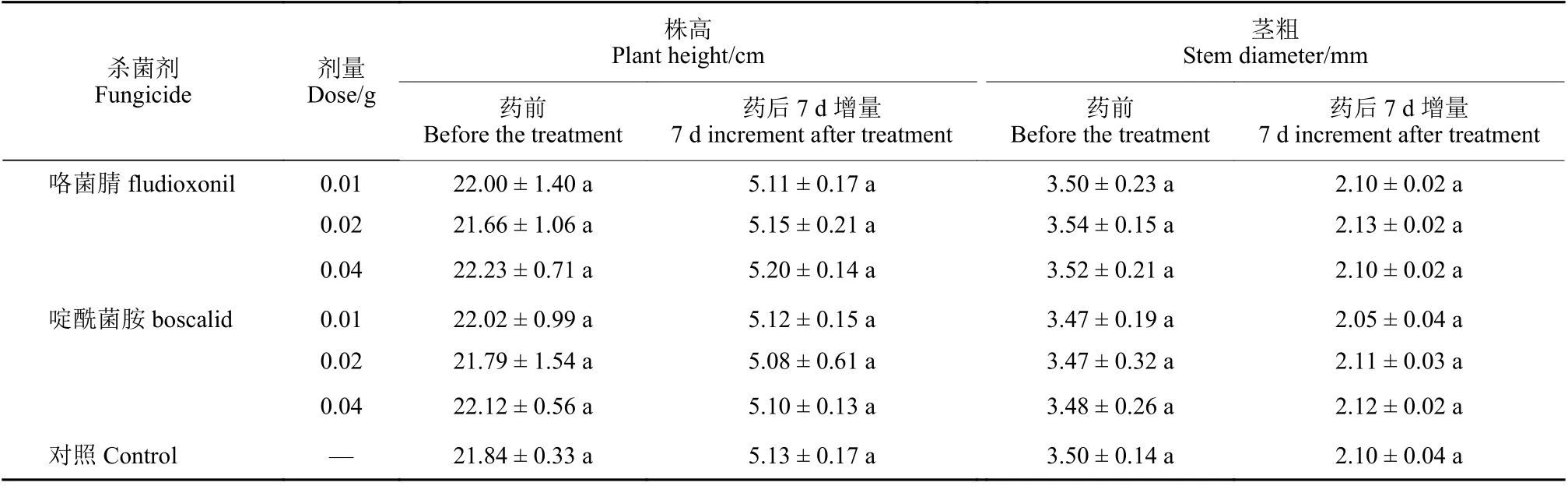
表2 不同剂量咯菌腈和啶酰菌胺烟雾施药对韭菜植株生长的影响Table 2 Effects of applying smokes of different doses of fludioxonil and boscalid on the growth of Chinese chives
2.5 烟剂对韭菜灰霉病的田间防效
2019 年的田间试验结果 (图5) 表明:以烟剂方式施药,啶酰菌胺和咯菌腈对韭菜灰霉病均有较好的防治效果,明显优于对照商品化腐霉利烟剂,且防效均随着施药剂量的升高而升高。咯菌腈烟剂在有效成分120 g/hm2剂量下的防效为73.14 %,啶酰菌胺烟剂在有效成分375 g/hm2剂量下的防效为81.17 %,均优于对照药剂腐霉利烟剂在最高登记剂量 (有效成分450 g/hm2) 下的防效(59.61 %)。
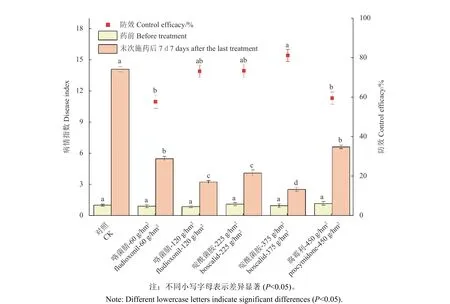
图5 咯菌腈、啶酰菌胺和腐霉利烟剂对韭菜灰霉病的田间防治效果Fig. 5 Field control efficacy of fludioxonil, boscalid and procymidone smoke generators against gray mold of Chinese chives
2020 年两种施药方式下,3 种烟剂对韭菜灰霉病的田间保护作用防效和治疗作用防效结果见表3。保护性施药方式试验中,3 种烟剂对韭菜灰霉病的防效均在80 %以上,部分处理在90 %以上;啶酰菌胺喷雾处理的防效高于烟剂处理。在治疗作用方式试验中,啶酰菌胺和咯菌腈烟剂对韭菜灰霉病的防效高于喷雾处理和对照商品化腐霉利烟剂处理。
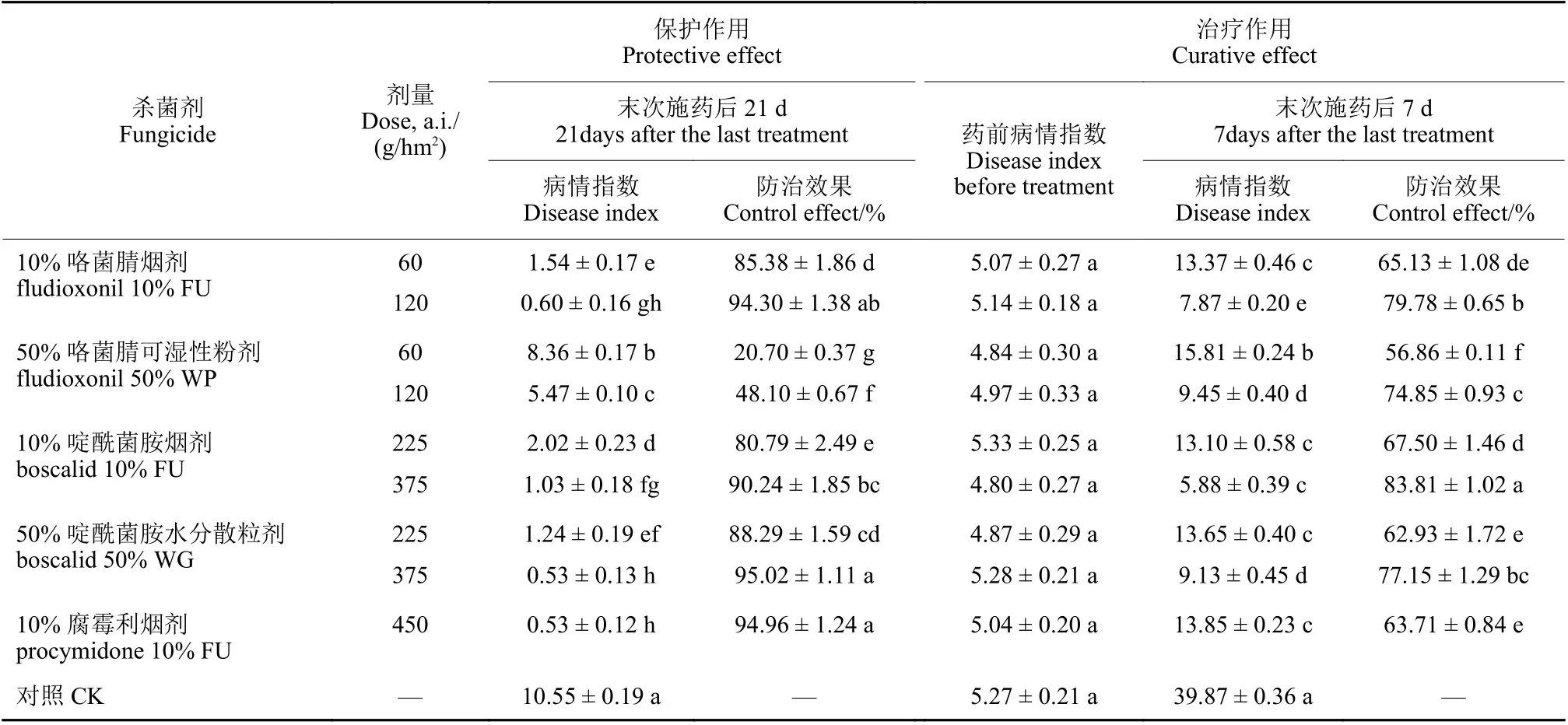
表3 两种施药方式下各杀菌剂对韭菜灰霉病的田间保护作用和治疗作用防治效果Table 3 Protective and curative effects of fungicides applied in two methods on gray mold of Chinese chives in the field
2.6 药剂残留消解动态及扩散距离
供试烟剂在韭菜上的残留消解动态及距施药点不同距离的分布情况见图6,3 种烟剂在韭菜植株上的残留消解规律均符合一级反应动力学方程,在距施药点1.5~9.0 m 范围内,不同距离的沉积分布无明显差异。参考GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》[23],咯菌腈在洋葱、黄瓜、西葫芦等蔬菜上的最大残留限量 (MRL) 为0.5 mg/kg,在茄子、食荚豌豆、萝卜等蔬菜上的MRL 值为0.3 mg/kg;啶酰菌胺在已登记蔬菜上的MRL 值均高于1 mg/kg;腐霉利在韭菜上的MRL 值是0.2 mg/kg。本研究中,咯菌腈、啶酰菌胺和腐霉利烟剂施药后21 d (临近韭菜的常规采收时间) 在韭菜植株上的残留量均较低,低于0.15 mg/kg;距最后一次施药14 d 后,咯菌腈有效成分60 和120 g/hm2处理组在韭菜中的最终残留量分别为0.09 和0.3 mg/kg,啶酰菌胺有效成分225 和375 g/hm2处理组在韭菜中的最终残留量分别为0.014 和0.12 mg/kg,而腐霉利有效成分450 g/hm2处理组在韭菜中的残留量为0.09 mg/kg,低于0.2 mg/kg。研究表明,在试验施药条件下,3 种烟剂在韭菜中的残留风险相对较低。
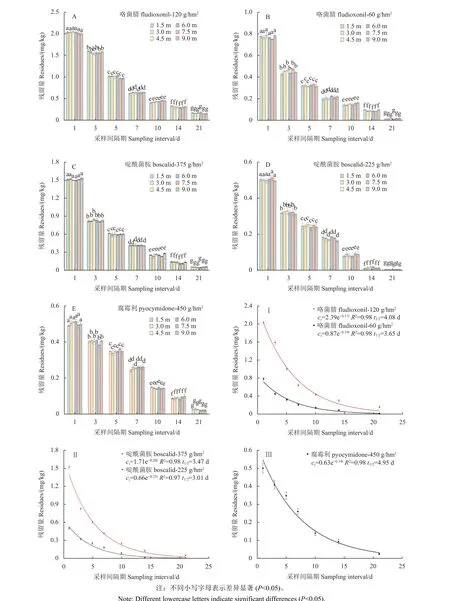
图6 咯菌腈、啶酰菌胺和腐霉利烟剂在距施药点不同距离韭菜上的沉积分布 (A~E) 与残留消解动态(Ⅰ~Ⅲ)Fig. 6 Distribution (A-E) and degradation dynamics curve (Ⅰ-Ⅲ) of fludioxonil, boscalid and procymidone smoke generators on Chinese chives at different distances from the application site
3 讨论与结论
本研究评价了9 种杀菌剂开发为韭菜灰霉病防治烟剂的可能性。其中,氟啶胺和啶菌噁唑对韭菜灰霉病菌的室内抑制活性较高,但其烟雾对病原菌菌丝生长和分生孢子萌发的抑制效果差,根据其低于40 %的成烟率结果,推测可能是由于这两种杀菌剂的成烟温度与热分解温度相近,原药在成烟过程中发生了热分解,且分解产物对灰霉病菌无抑制作用所致;尽管吡唑萘菌胺及其烟雾对韭菜灰霉病菌的抑制活性均较高,但其成烟率仅为59.39 %,加工成烟剂会造成浪费;而咯菌腈烟雾对韭菜灰霉病菌菌丝生长、啶酰菌胺和氟吡菌酰胺烟雾对其孢子萌发具有较高的抑制作用,且3 种杀菌剂成烟率均达到80 %以上,满足烟剂制备要求[19-20],因此适合加工成烟剂使用,但由于氟吡菌酰胺专利尚未到期,因此咯菌腈和啶酰菌胺是当前较适合制备成韭菜灰霉病防治用烟剂的候选品种。
药效和安全性是烟剂开发和应用的基础。本研究表明,咯菌腈和啶酰菌胺烟剂对韭菜植株生长无明显影响,相对较低剂量下对韭菜灰霉病的田间防效明显高于最高登记剂量下的腐霉利商品烟剂,同时田间用量低也极大地降低了药害发生的风险。虽然喷雾施药方式对韭菜灰霉病也具有较高的防治效果,但在低矮拱棚中操作极其困难,而且喷雾施药会导致棚室内相对湿度的增加,为病原菌增殖提供条件,所以冬季韭菜棚内使用烟剂施药效果优于喷雾施药。此外,韭菜叶片一旦出现灰霉病斑即失去了商品价值,所以韭菜灰霉病的防治重点应是预防为主。上茬韭菜收割后,病原菌的数量相对较少且多数寄生在土表或病残体中,此时使用烟剂处理可对整个棚室起到全面消毒的作用,能够显著抑制病原菌的增殖和侵染。咯菌腈和啶酰菌胺现阶段已广泛用于草莓、黄瓜、番茄和葡萄等作物上防治灰霉病,且对炭疽病、靶斑病等也具有一定防效[24-26],因此其加工成烟剂后在我国保护地作物病害防治方面将具有广阔的应用前景。
农药残留是农产品质量安全中比较敏感且备受关注的话题。目前我国韭菜中农药残留抽检合格率偏低,如2018 年抽检不合格的主要原因是腐霉利残留超标[27]。本研究试制的咯菌腈和啶酰菌胺烟剂在韭菜上的半衰期为3~4 d,而每茬韭菜的生长期一般为23~30 d[28],参考相关残留限量标准[23],这两种药剂在韭菜灰霉病防治上的使用时间相对较为灵活。咯菌腈和啶酰菌胺在韭菜上的半衰期比已报道的其在辣椒、草莓[29]等其他作物喷雾处理场景下获得的半衰期短。在田间保护作用试验中,于上茬韭菜收割后7 d 使用咯菌腈和啶酰菌胺烟剂处理,施药21 d 后收割的下茬韭菜中药剂的残留量极低,安全性较高。其原因在于收割7 d 后施药,下茬韭菜的生长高度仅为地面以上约5~7 cm,新长出的韭菜植株上几乎无残留,这与农药难以在韭菜体内传导以及其在植株内的快速消解有关,同时也与生物量稀释有很大关系。
设施栽培环境的特征是高温、高湿、风速低、温度变化小,相对湿度很少低于60%,这为病虫害的繁衍提供了有利条件。与喷雾施药相比,使用烟剂不仅省力,而且不会增加棚室内的湿度,可降低病害发生概率,符合我国保护地小规模种植模式的需要,但目前存在国内已登记的烟剂品种单一和老化的问题。截至2021 年8 月,农业农村部批准登记的烟剂产品共138 个,以杀菌烟剂为主,占烟剂登记产品的63.8 %。杀菌烟剂中单剂占94.4 %,混剂占5.6 %,涉及的有效成分共计11 个,以腐霉利和百菌清为主,占杀菌烟剂产品的88.9 %,主要用于防治黄瓜和番茄灰霉病。长期使用单一药剂易导致有害生物敏感性下降,抗药性问题不容忽视,因此应进一步扩大适合开发为烟剂的药剂种类筛选范围,扩充现有烟剂品种,便于生产中交替和轮换使用,延缓抗药性的产生。此外,田间病虫害发生情况复杂,多种病虫害往往同时发生,因此还应重视混合型烟剂的研究开发,扩大作用谱,实现多病、多虫同治或病虫兼治,减少施药次数,降低用药成本和提高安全性。

