噁唑酰草胺及其代谢物在水稻上的残留
何红梅, 徐玲英, 张昌朋, 王祥云, 李艳杰, 赵学平
(省部共建农产品质量安全危害因子与风险防控国家重点实验室 (筹),农业农村部农药残留检测重点实验室,浙江省农业科学院 农产品质量安全与营养研究所,杭州 310021)
噁唑酰草胺(metamifop)是由韩国研发的芳氧苯氧基丙酸酯类除草剂,属内吸性传导型茎叶处理除草剂[1],可防除水稻田大多数一年生禾本科杂草[2-3],通过抑制乙酰辅酶A 羧化酶而发挥杀草作用[4]。噁唑酰草胺的主要代谢物为N-(2-氟苯基)-2-(4-羟基苯氧基)-N-甲基丙酰胺 (HPFMPA) 、N-(2-氟苯基)-2-羟基-N-甲基丙酰胺 (HFMPA) 和6-氯-苯并噁唑酮 (6-CBO),结构式见图式1[5]。我国已制定噁唑酰草胺在稻谷和糙米上的临时最大残留限量 (MRL)值为0.05 mg/kg[6]。日本制定了噁唑酰草胺在糙米上的MRL 值为0.02 mg/kg[7],韩国为0.05 mg/kg[8],而国际食品法典委员会(CAC)、欧盟和美国均未制定该药的MRL 值。
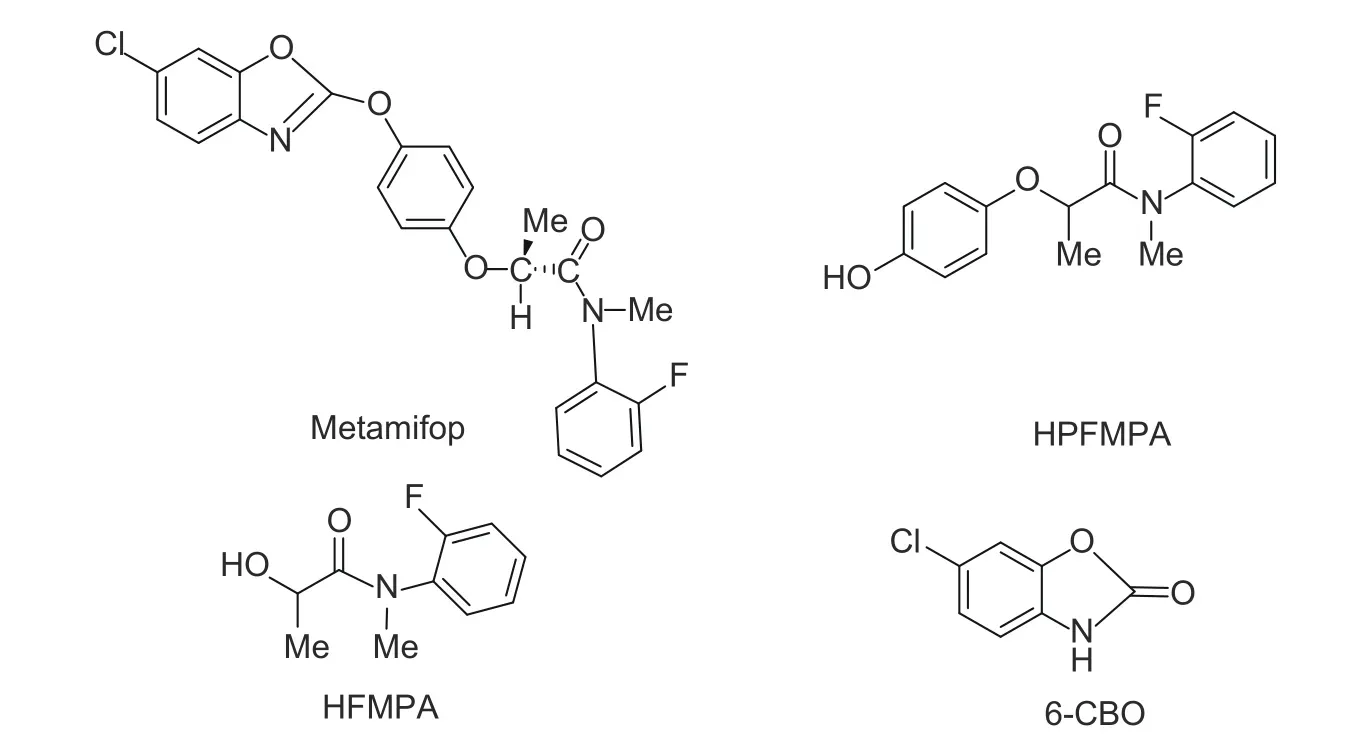
图式1 噁唑酰草胺及其3 个代谢物的结构式Scheme 1 The structural formula of metamifop and its metabolites HPFMPA, HFMPA and 6-CBO
目前,关于噁唑酰草胺的报道主要集中在其制剂含量[9-10]测定和残留分析方法[11-16]确定方面,涉及噁唑酰草胺在水稻上的消解和最终残留的研究较少。孔德洋等[17]研究了噁唑酰草胺母体在水稻植株、土壤和稻田水中消解动态以及其在稻秆、稻壳、糙米及稻田土壤中的最终残留。Barik等[18]开展了噁唑酰草胺和代谢物HPFMPA 在印度水稻田系统中的持久性研究。Janaki 等[19]报道了在印度水稻田施用噁唑酰草胺制剂后,稻谷、秸秆和土壤样品中噁唑酰草胺和代谢物HFMPA的残留量。尚未见同时研究噁唑酰草胺及其3 个代谢物在水稻上最终残留的报道。基于此,本研究开展了噁唑酰草胺及其3 个代谢物在中国不同地理区域大田水稻上的残留研究,同时建立了超高效液相色谱-串联质谱 (UPLC-MS/MS) 检测噁唑酰草胺及其3 个代谢物残留量的方法,旨在为噁唑酰草胺及其代谢物检测方法标准的制订和其制剂使用安全性评价提供参考。
1 材料与方法
1.1 仪器、试剂与耗材
Waters ACQUITY UPLC 和Waters Xevo TQ XS 超高效液相色谱-串联质谱联用仪 (UPLC-MS/MS,美国Waters 公司);SE602F 电子天平 (奥豪斯仪器有限公司);DHZ-DA 恒温振荡器 (太仓市实验仪器设备厂);SHB-A Ⅲ 型循环水式真空泵(杭州大卫科教仪器有限公司);YRE-201D 旋转蒸发仪 (巩义市予华仪器有限责任公司);W201B 恒温水浴锅 (上海申胜生物技术有限公司);DLSB-5L/10 低温冷却循环泵 (巩义市予华仪器有限责任公司);SK1200H 超声波清洗器 (上海科导科学仪器有限公司);固相萃取仪 (美国SUPELCL 公司);THU-35C 砻谷机 (佐竹机械 (苏州) 有限公司)。
20% 噁唑 · 灭草松(metamifop + bentazone)微乳剂 (ME,济南绿霸农药有限公司。其中噁唑酰草胺质量分数为 3.3%,灭草松质量分数为16.7%);噁唑酰草胺标准品 (纯度90%,Toronto Research Chemicals);代谢物HPFMPA、HFMPA、6-CBO 标准品 (纯度分别为99.5%、99.5% 和98.3%,北京博雅开元科技开发有限公司)。
分析纯乙腈 (上海凌峰化学试剂有限公司);色谱纯乙腈和甲醇 (德国默克公司);分析纯氯化钠 (天津市大茂化学试剂厂);色谱纯甲酸 (美国ACS 恩科化学试剂公司);99.0% 甲酸铵 (霍尼韦尔贸易 (上海) 有限公司);纯净水 (杭州娃哈哈百立食品有限公司)。
HLB (C18) 小柱 (200 mg/6 mL)、BEH C18色谱柱 (2.1 mm × 100 mm,1.7 μm) 及 HSS T3色谱柱(2.1 mm × 100 mm,1.8 μm) (美国Waters 公司);ProElut C18小柱 (500 mg/6 mL,北京迪马科技有限公司);Cleanert S C18小柱、Cleanert S C18-N 小柱 (500 mg/6 mL)及Cleanert 弗罗里硅土填料 (60~100 目,粒径 150~250 μm) (天津博纳艾杰尔公司)。
1.2 田间试验设计
参照《农药登记残留田间试验标准操作规程》[20]和《农作物中农药残留试验准则》[21],于2018 年和2019 年分别在四川省彭州市、云南省玉溪市元江县、海南省陵水黎族自治县、安徽省合肥市、辽宁省大连市、湖北省利川市、江苏省南京市、江西省高安市、广东省湛江市和广西南宁市上林县开展了10 地的最终残留试验。于水稻苗期、杂草2~5 叶期,采用20% 噁唑 · 灭草松微乳剂茎叶喷雾施药1 次,施药剂量为有效成分 720 g/hm2(其中噁唑酰草胺为118.8 g/hm2),每处理1 个试验小区 (每小区≥100 m2)。在水稻收获期每小区随机选取12 个采样点,采集水稻整株样品不少于10 kg (以确保秸秆至少0.5 kg/份,稻谷至少1 kg/份),混合。每次采集2 个样品。同时设喷清水的空白对照小区,各小区之间设置隔离带。
将田间植株样品剪成1 cm 以下的小段,混匀后,用四分法分取100 g 样品 2 份,待前处理及测定。稻谷样品晾晒后脱壳,将糙米和稻壳分别混匀后,用四分法分取糙米样品100 g 2 份和足够量的稻壳样品2 份,待前处理及测定。
1.3 标准溶液配制
准确称取一定量的噁唑酰草胺、HPFMPA、HFMPA 和6-CBO 标准品,分别用甲醇配制成100 mg/L 的标准储备液,4.0 ℃保存。将标准储备液分别用甲醇或空白基质提取液稀释,配制成0.000 5、0.001、0.002 5、0.005、0.01 和0.02 mg/L系列质量浓度的溶剂标准溶液和基质匹配标准溶液,应用UPLC-MS/MS 测定,以浓度-峰面积绘制标准曲线,计算回归方程和相关系数。
1.4 样品提取与净化
1.4.1 提取 称取2.5 g 样品 (糙米样品为 5 g) (精确至0.01 g) 置于150 mL 三角烧瓶中,加入15 mL纯净水和30 mL 乙腈,振荡30 min 后抽滤,转出滤液至装有8 g 氯化钠的具塞量筒,剧烈振摇后静置。吸取5 mL 乙腈相于烧瓶中,40 ℃水浴旋转蒸发浓缩至干,待净化。
1.4.2 净化 依次用5 mL 甲醇、5 mL 纯净水活化平衡HLB 小柱。在浓缩干的提取样品烧瓶中加入5 mL 体积分数为10%的甲醇水溶液,超声后进样,加入5 mL 体积分数为20%的甲醇水溶液淋洗小柱,最后加入5 mL 乙腈洗脱并收集淋洗液,过0.22 μm 滤膜,待UPLC-MS/MS 检测。
1.5 超高效液相色谱-串联质谱条件
1.5.1 液相色谱条件 DIKMA Endeavorsil C18色谱柱 (2.1 mm × 100 mm,1.8 μm);柱温40 ℃;进样量1.0 μL;流速0.2 mL/min;流动相:A 相为甲醇,B 相为体积分数为0.1%的甲酸水溶液 (ESI-时为100%纯净水)。采用梯度洗脱程序:0 min,A 为50%;2 min,A 为90%;3 min,A 为90%;4 min,A 为50%,保持 1 min。
1.5.2 质谱条件 毛细管电压分别为3.0 kV (ESI+)和2.5 kV (ESI-),脱溶剂温度为450 ℃,脱溶剂气流量为800 L/h。保留时间和质谱参数条件见表1。
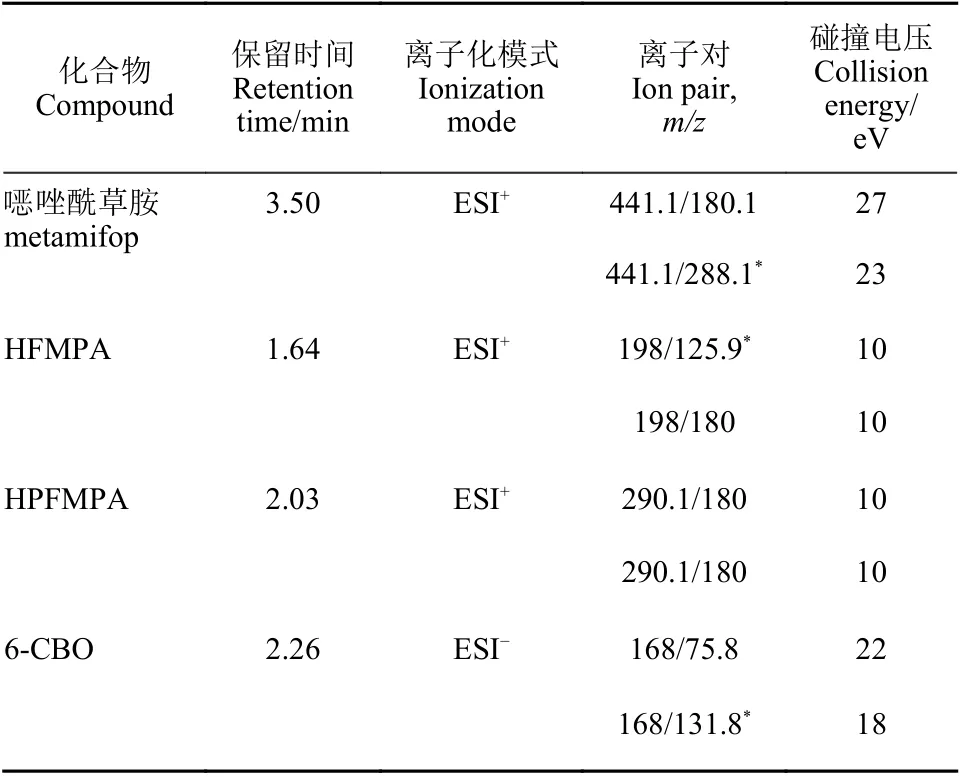
表1 噁唑酰草胺及其代谢产物质谱参数Table 1 Mass spectrometric ( MS) parameters for detection of metamifop and its metabolites
2 结果与分析
2.1 检测方法
2.1.1 色谱和质谱条件优化 分别考察了噁唑酰草胺及其 3 种代谢物在Waters BEH C18、Waters HSS T3和DIKMA Endeavorsil C183 款不同色谱柱上的色谱保留行为,发现4 种化合物在DIKMA Endeavorsil C18上的保留、峰型和灵敏度均较好,故选择该柱作为分析柱,并优化了4 种化合物的质谱条件,确定了扫描碎片离子。此外,考察了水-甲醇、甲酸-甲醇、甲酸-甲酸铵-甲醇、甲酸-乙腈、甲酸-甲酸铵-乙腈等不同流动相组合对化合物的响应情况,发现检测6-CBO 时采用水-甲醇体系的灵敏度较好,其他化合物在甲酸-甲醇体系下灵敏度和峰型较好。
2.1.2 前处理条件优化 目前已报道的噁唑酰草胺及其代谢物的前处理净化方法主要有二氯甲烷提取法[11]、以二氯甲烷为洗脱溶剂的硅胶柱净化法[12]、QuEChERS 净化法 (以PSA 为吸附剂)[13-16]、加速溶剂提取结合凝胶渗透色谱净化法[17]和QuEChERS 净化法 (以C18为吸附剂)[18]等。由于二氯甲烷毒性较大,实验室应尽量避免使用;尽管QuEChERS 净化法快速、简单,但是对于稻秆和稻壳等复杂基质的净化效果不佳;加速溶剂提取结合凝胶渗透色谱净化法需要2 种特殊专用的仪器设备,操作相对复杂。基于环境安全、净化效果和实用性等几方面因素,本研究采用固相萃取小柱净化法,并主要考察了弗罗里硅土柱和C18小柱对各化合物的净化效果。结果发现,6-CBO在弗罗里硅土填料上吸附性很强,难以被洗脱,而其他3 个化合物在该填料上吸附性差异较大。4 个化合物在C18固相萃取小柱上的保留能力接近,故选取C18固相萃取小柱进一步进行优化,结果表明,Waters的HLB 小柱稳定性和回收率均较好,故确定选择该小柱进行样品净化。
2.1.3 基质效应考察 按照1.4 节前处理方法分别制得糙米、稻壳和稻秆空白基质溶液,采用空白基质溶液分别稀释各标准储备液,配制得 0.000 5~0.02 mg/L 范围内的3 种基质匹配标准溶液,同时配制同浓度的溶剂标准溶液。采用所建立的方法分别测定并绘制得各化合物的基质匹配标准曲线和溶剂标准曲线。根据 (1) 式计算基质效应,当基质效应绝对值小于20%时,说明不存在明显的基质效应,可直接用溶剂标样进行计算[22-23]。

式中:Me为基质效应,%;km为基质匹配标准曲线的斜率;ks为溶剂标准曲线的斜率。
结果表明:1) 在所考察的质量浓度范围内,噁唑酰草胺、HFMPA、HPFMPA 和6-CBO 的溶剂标准曲线和基质匹配标准曲线均呈现良好的线性相关,r值均大于0.994 1。2) 糙米、稻壳和稻秆基质对采用ESI+检测的噁唑酰草胺、HFMPA和HPFMPA的基质效应为 -6.64%~3.51%。3) 糙米、稻壳和稻秆基质对采用ESI-检测的6-CBO 的基质效应为-11.79%~6.28%。各样品基质对4 种化合物的基质效应在-11.79%~6.28%之间,绝对值均小于20%,说明其基质效应不明显,可直接采用溶剂标样进行计算。
2.1.4 正确度和精密度 在空白的糙米、稻壳和稻秆中分别添加0.01、0.1 和2.0 mg/kg 的噁唑酰草胺、HFMPA、HPFMPA 和6-CBO 标准溶液,按照1.4 节和1.5 节的方法分别进行样品前处理和分析,测定添加回收率及相对标准偏差 (RSD) 。每档浓度5 个重复,结果见表2,代表性添加回收色谱图见图1~4。从中可见,各档添加水平下的回收率数据和RSD 均满足残留分析要求,可采用该方法对实际样品中的噁唑酰草胺、HFMPA、HPFMPA 和6-CBO 残留量进行分析检测。

图1 噁唑酰草胺色谱图Fig. 1 Chromatograms of metamifop

表2 方法的正确度和精密度 (n=5)Table 2 The trueness and precision of the method (n=5)
2.1.5 方法的定量限 根据最低添加水平确定得方法的定量限 (LOQ),噁唑酰草胺及其3 种代谢物在糙米、稻壳和稻秆中 的LOQ 值均为0.01 mg/kg。

2.2 噁唑酰草胺及其代谢物在水稻上的最终残留
在我国10 个不同水稻种植区域分别开展了噁唑酰草胺及其代谢物的最终残留试验,各点收获期的糙米、稻壳和稻秆中噁唑酰草胺母体及其代谢物的残留情况如下。
2.2.1 糙米 四川、云南、海南、安徽、辽宁、湖北、江苏、江西、广东和广西试验区样品中噁唑酰草胺、HFMPA、HPFMPA 和6-CBO 的残留量平均值均低于LOQ (0.01 mg/kg)。
2.2.2 稻壳 四川、云南、海南、安徽、辽宁、湖北、江苏、江西、广东和广西试验区样品中噁唑酰草胺、HFMPA、HPFMPA 和6-CBO 的残留量平均值均低于LOQ (0.01 mg/kg)。
2.2.3 稻秆 安徽、辽宁、湖北、江苏、江西、广东和广西试验区样品中噁唑酰草胺、HFMPA、HPFMPA 和6-CBO 的残留量平均值均低于LOQ(0.01 mg/kg)。四川、云南和海南试验区样品中HFMPA 的残留量平均值分别为0.098、0.026 和0.042 mg/kg,其余3 种化合物的残留量平均值均低于LOQ (0.01 mg/kg)。
3 结论与讨论
样品采用乙腈提取、盐析、C18固相萃取小柱净化,建立了超高效液相色谱-串联质谱法测定糙米、稻壳和稻秆中噁唑酰草胺及其3 种代谢物 (HFMPA、HPFMPA 和6-CBO) 残留量的方法,该方法基质效应不明显,结果稳定,数据可靠,可为建立该类化合物的残留检测方法标准提供参考。
最终残留试验结果显示,采用噁唑酰草胺质量分数为3.3% 的20% 噁唑 · 灭草松微乳剂按有效成分750 g/hm2(噁唑酰草胺 118.8 g/hm2)剂量施药1 次,10 个试验点的糙米样品中噁唑酰草胺及其3 种代谢物的残留量均 <0.01 mg/kg,低于我国制定的糙米中的MRL 值 (0.05 mg/kg);稻壳样品中噁唑酰草胺及其代谢物的残留量也均<0.01 mg/kg;但在3 个试验点稻秆样品中检出了代谢物HFMPA,其余3 个化合物在稻秆中的残留量均 <0.01 mg/kg。在该施药条件下,制剂中另一有效成分灭草松在所有样品中均未检出。因此,后续研究可关注代谢物HFMPA 在作物可饲部分的潜在风险;在水稻上使用20% 噁唑 · 灭草松微乳剂时,建议最高施药剂量为有效成分750 g/hm2(噁唑酰草胺为118.8 g/hm2),施药1 次。

图2 HPFMPA 色谱图Fig. 2 Chromatograms of HPFMPA
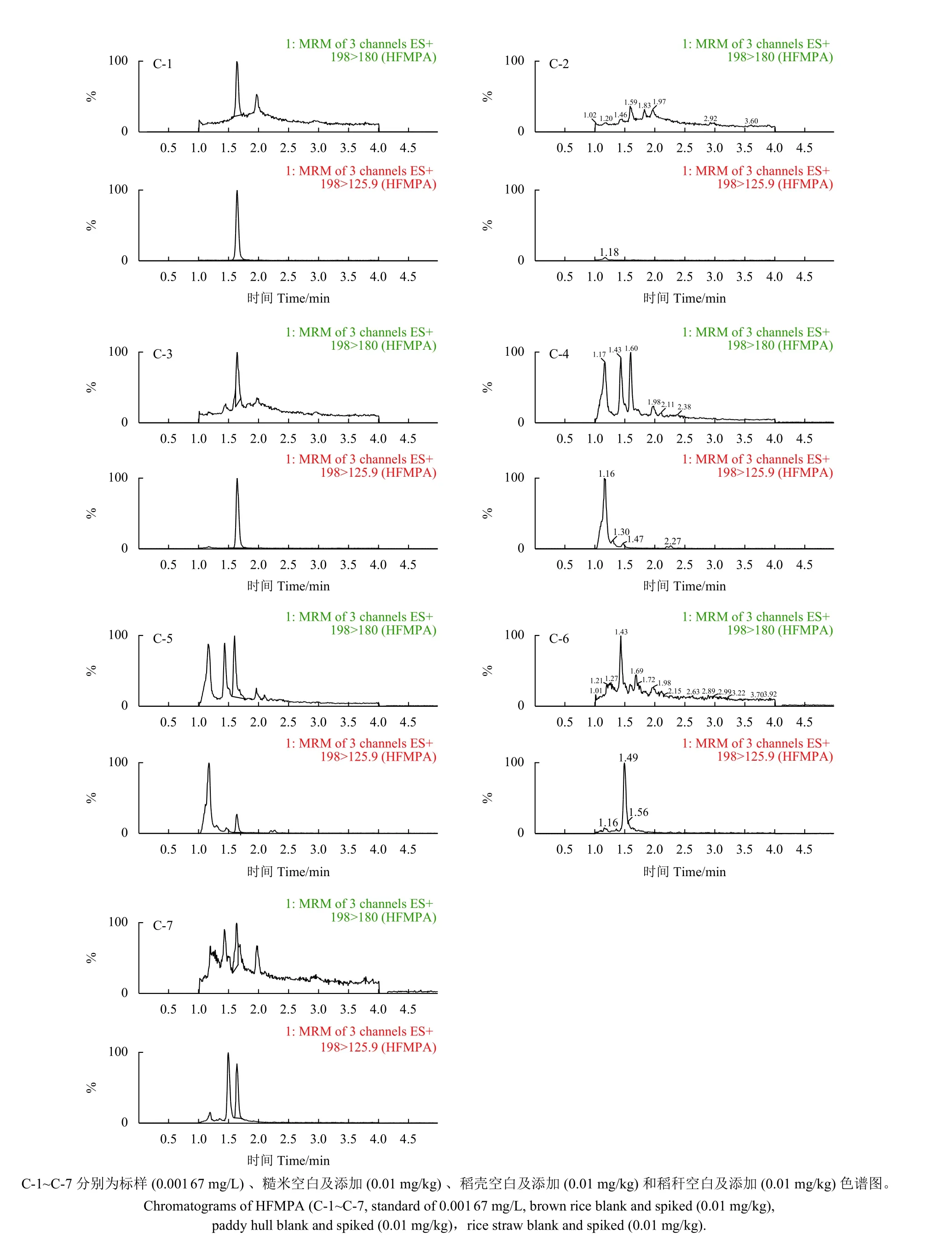
图3 HFMPA 色谱图Fig. 3 Chromatograms of HFMPA

图4 6-CBO 色谱图Fig. 4 Chromatograms of 6-CBO

