百菌清污染土壤生物修复研究进展
唐丽伟,卢滇楠,刘永民
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001;2.清华大学 化学工程系工业生物催化教育部重点实验室,北京 100084)
进展综述
百菌清污染土壤生物修复研究进展
唐丽伟1,卢滇楠2,刘永民1
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001;2.清华大学 化学工程系工业生物催化教育部重点实验室,北京 100084)
针对百菌清具有在土壤中药效稳定、不易分解、代谢周期长、长期大量施加导致土壤严重污染等特点和问题,简要介绍了百菌清的毒性作用机制。总结了降解土壤中百菌清的物理法、化学法和生物法的原理及优缺点。重点阐述了生物修复百菌清污染土壤的主要降解菌株及其效果、降解途径以及降解产物及其毒性,分析了土壤性质、微生物种类、温度、土壤含水率等因素对百菌清降解效果的影响。指出今后的研究重点应为降解中间产物的毒性分析及其进一步的降解与转化问题,而复合菌制剂或多酶复合体系可实现百菌清的彻底降解和无害化。
百菌清;污染土壤;生物修复;降解菌株;降解途径;降解产物
百菌清可防治植物的黑斑病、炭疽病等,是使用广泛的杀真菌剂。在墨西哥,百菌清每年喷洒50次左右,施药量高达1.41 kg/hm2[1-2],在中国,百菌清年产量接近9 000 t。百菌清在土壤中药效稳定,不易分解,长期大量施加百菌清会导致严重的土壤污染问题[3-7]。百菌清可以很好地附着在植物上,很难被雨水冲洗掉,在土壤中代谢周期长,若
微生物种群数量少时半衰期可达半年[8]。百菌清对水生无脊椎动物有剧毒,在啮齿动物体内存在明显的毒性蓄积[9]。接触百菌清会引起皮肤炎症,它会严重刺激人的眼睛和肠胃,增加人类繁衍后代的致畸率,美国环保署已将百菌清列为潜在的致癌物质[10]。
本文综述了百菌清的毒性作用机制、百菌清的降解方法、百菌清污染土壤的生物修复效果。重点阐述了微生物对百菌清的降解机理,总结了降解产物并分析了产物毒性。展望了生物修复百菌清污染土壤今后的研究方向。
1 百菌清的物理性质及其毒性作用机制
百菌清化学名称为四氯间苯二甲腈,室温时为白色粉末,微溶于水,易溶于有机溶剂,相对分子质量为265.91,沸点为350 ℃,熔点为251 ℃,密度为1.8 g/cm3。可稳定存在于常温和弱酸碱性介质中,强碱性时会发生分解[11]。
百菌清通过与细胞呼吸和谷胱甘肽相关酶接触,抑制致病细菌细胞的葡萄糖氧化、胍霉菌孢子萌发、菌丝生长和产孢[12-14]。Godard等[15-16]研究发现,百菌清可与含巯基的酶反应,抑制此类酶的生物活性,中断糖酵解,从而影响提供细胞生命活动能量的物质(ATP)的生成,特别是抑制磷酸甘油醛脱氢酶的活性。
2 百菌清的降解方法
百菌清在土壤中积聚过多,使其降解速率减慢,半衰期延长[17]。目前降解土壤中百菌清的方法包括物理法、化学法和生物法[18-19],其原理及优缺点见表1。
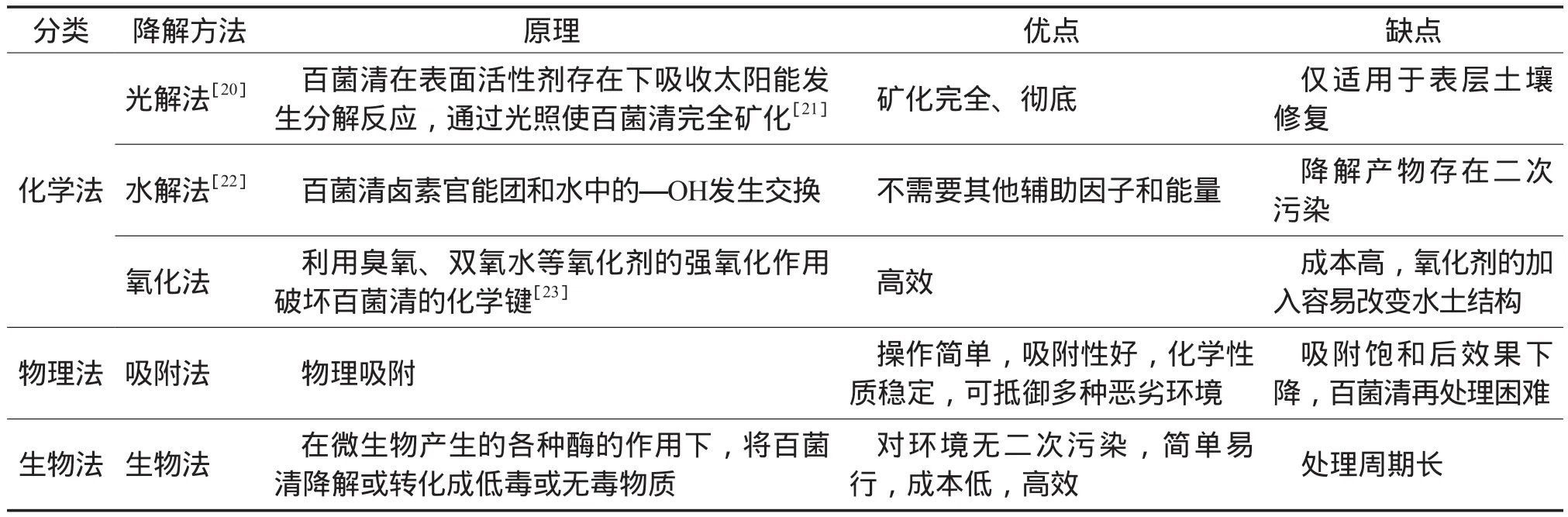
表1 百菌清的降解方法、原理及优缺点
物理法和化学法成本较高,不适宜用做面源污染的修复,不仅工作量大,还易造成二次污染。微生物分布广泛,有很强的适应能力和多种代谢途径,生物法成为降解残留农药的主要方法。下面重点介绍采用生物修复技术处理百菌清污染土壤的相关研究进展。
3 百菌清污染土壤的生物修复效果
3.1 降解菌株及其效果
近年研究发现,土壤中有多种微生物可降解百菌清,如黏质沙雷氏菌(Serratia marcescens)、苍白杆菌属(Ochrobactrum lupini)、黄杆菌属(Flavobacterium)、微球菌属(Micrococcus)等[24]。Wang等[25]发现假单胞菌属可通过水解脱氯降解百菌清。曲迪[26]使用克雷伯氏菌属等3株混合菌降解含量为200 mg/kg的百菌清污染土壤12 d后,百菌清降解率为80.68%。梁斌[27]筛得的CTN-11对百菌清含量为50 mg/kg的灭菌土壤和未被灭菌土壤降解3 d后,均检测不到百菌清。Wang等[25]采用铜绿假单胞菌降解含量为20 mg/kg的百菌清污染土壤,降解4 d后检测不到百菌清。本课题组也发现铜绿假单胞菌可高效降解百菌清,但该菌株是国家明令禁止使用的生物肥料,因此在选用菌株降解百菌清时需考察其生物毒性,以免影响原土著微生物的生存和生长。
3.2 功能酶与降解途径
微生物降解百菌清主要通过酶的催化作用,将百菌清吸到胞内,通过分泌胞内或胞外降解酶来降解百菌清,其中伴随水解、氧化还原等过程[28]。微生物对百菌清的主要降解途径有:
1)百菌清苯环上的氰基通过水合作用形成酰胺或被进一步氧化成羧酸基团[29-36]。

2)在巯基(—SH)和谷胱甘肽(GSH)存在的条件下,百菌清苯环上的氯原子被谷胱甘肽催化,即被巯基取代,形成络合物,这个过程中百菌清苯环上最多可有3个氯原子被脱除[34,37]。

3)苯环上氯原子被甲硫基取代[29-30,32,35-36]。

4)苯环上氯原子被甲氧基取代[29-30,32,35,36]。
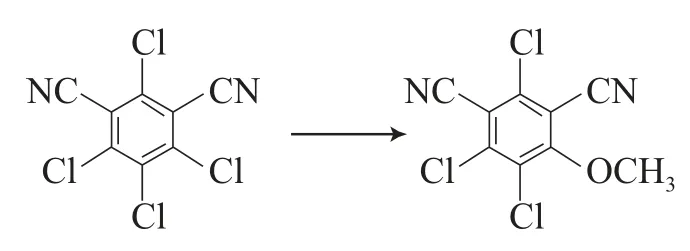
5)在百菌清水解脱氯酶(Chd)存在时水解脱氯形成被羟基取代的百菌清[29-35]。

6)苯环上的氯原子被氢原子取代,再进一步矿化为水、CO2和其他无机物,具体途径如下。矿化是最理想的降解途径,该过程的缺点是大多数菌株需在其他碳源存在时才能发挥降解作用。

研究表明[35,38],好氧时百菌清降解率增大,百菌清可通过水解和巯基取代、还原的方式脱氯降解[39-40]。Carlo-Rojas等[40]研究发现,厌氧时百菌清通过苯环羧化和还原脱氯来降解。常见的降解酶有氧化还原酶和水解酶。水解酶不需其他辅酶和辅助因子,生物降解性能较佳。氧化还原酶对百菌清也有很好的降解效果[28]。Kim等[37]从Ochrobaerrum sp.SH35中克隆谷胱甘肽硫转移酶(GST)基因在大肠杆菌中成功表达后,形成百菌清与谷胱甘肽结合的络合物。Wang等[25]从百菌清高效降解菌Pseudomonas sp.CTN-3中成功克隆到Chd基因,水中的羟基取代苯环上的氯原子,且无需能量和辅助因子。
3.3 降解产物分析
Ríos-Montes等[35]发现,单一微生物无法将百菌清彻底矿化成CO2。目前文献报道的百菌清代谢产物主要有:4-羟基-2,5,6-三氯异二苯腈、间苯二腈、三氯苯二甲腈、3-氰基-四氯苯甲酰胺、1,3-二酰胺-四氯苯等[41-42]。
本课题组研究发现,阴沟肠杆菌在无其他碳源时,处理48 h后对含量为20 mg/L的百菌清降解率为97.38%,对百菌清含量为10 mg/kg、含水率为40%的土壤中的百菌清降解率为99.21%,使用液质检测发现产物为巯基百菌清、羟基百菌清。Motonaga等[43]筛得的TBI菌株降解百菌清后产物是羟基百菌清和 Cl-。Liang等[44]检测到 Ochrobactrum sp.CTN-11降解百菌清的产物为羟基百菌清。史秀珍[28]利用苍白杆菌(Ochrobact rum lupini)TP2D1降解百菌清的产物为4-羟基-2,5,6-三氯异二苯腈和 1,3-二酰胺-四氯苯。通过查阅化学品毒性资料发现,降解产物中三氯苯二腈的大鼠经口LD50大于300 mg/kg,4-羟基-2,5,6-三氯异二苯
腈LD50大于332 mg/kg,间苯二腈LD50大于860 mg/kg,这些产物毒性都大于百菌清(百菌清LD50大于10 000 mg/kg)。其中停留时间更长、移动性更好的4-羟基-2,5,6-三氯异二苯腈可溶于水,其毒性是百菌清的30倍左右,会抑制土壤中微生物的呼吸作用。4-巯基百菌清会产生肾毒性,是对啮齿类动物引起肾损伤的主要诱因。羟基百菌清对鱼类和无脊椎动物毒性很低,但不能进一步降解为水、CO2或其他无机物。质量分数为1%的间苯二腈被国际癌症研究机构( IARC)鉴别为可能的人类致癌物,间苯二腈和三氯苯二腈等其他产物均会对呼吸道、眼睛和皮肤产生刺激或腐蚀,但暂无这些产物的生态毒性、土壤中的迁移性、持久性和降解性数据资料。如上所述,部分降解产物有毒甚至毒性高于百菌清本体,因此需分析百菌清降解后产物毒性,以免造成更大的毒害。
3.4 其他影响因素
土壤本身的理化性质、温度以及水分、微生物的种类等都会对修复百菌清污染产生影响。Shi等[30]发现含水率60%、温度为30 ℃时,微生物对百菌清降解率最高。另外,百菌清在真菌和腐殖质的作用下降解速率会提高[45]。溶液pH大于8时,pH越大百菌清降解率越高[27]。Bending等[46]发现,随着土壤中有机质含量的增加,百菌清降解率增大。
4 结语与展望
与物理法和化学法相比,生物法降解百菌清是一种高效、易行、廉价的降解方法,对修复百菌清污染土壤具有突出优势。依据目前土壤中百菌清降解研究现状和本课题组前期研究成果,今后研究重点应该集中在降解中间产物毒性分析及其进一步降解与转化。而单一菌株可能无法实现百菌清的彻底降解和无害化,复合菌制剂或多酶复合体系可能是实现这一研究目标的有效途径之一。此外,研究百菌清降解关键酶实现环保高效降解也是今后的研究方向。采用生物修复实现百菌清彻底降解和无害化有望为农药残留治理和食品安全提供坚实保证。
[1]Chaves A,Shea D,Cope W G. Environmental fate of chlorothalonil in a Costa Rican banana plantation[J].Chemosphere,2007,69(7):1166-1174.
[2]DeLorenzo M E,Wallace S C,Danese L E,et al.Temperature and salinity effects on the toxicity of common pesticides to the grass shrimp,palaemonetes pugio[J].J Environ Sci Health,Part B,2009,44(5):455-460.
[3]张满云,滕应,朱烨,等.百菌清重复施用后在土壤中的残留及其对微生物群落的影响[J].土壤,2014,46(5):839-844.
[4]褚意新,张仟春,郑萍,等.百菌清含量测定的气相色谱分析[J].价值工程,2015,34(7):324-326.
[5]Fernández-García J C,Arrebola J P,González-Romero S,et al.Diabetic ketoacidosis following chlorothalonil poisoning[J].Occup Environ Medic,2014,71(5):382-382.
[6]杨晓梅,塔娜,徐永明,等.中国有机氯农药的监测现状[J].化工环保,2013(2):123-128.
[7]Bae H K,Cha C G.Biodegradation of chlorothalonil,fenobucarb and methidathion in Nakdong River,South Korea[J].Asian J Water,Environ Pollut,2015,12(3):71-74.
[8]昝树婷,杨如意,李静,等.百菌清对土壤微生物特性和水稻生物量的影响[J].生物学杂志,2015,32(3):42-45.
[9]Kwon H,Kim T K,Hong S M,et al.Effect of household processing on pesticide residues in fi eld-sprayed tomatoes[J].Food Sci Biotechnol,2015,24(1):1-6.
[10]王光利.假单胞菌菌株CTN-3对百菌清污染土壤的生物修复[J].Chin J Appl Ecol,2012,23(3):807 -811.
[11]谷晓明,魏朝俊,贾临芳,等.百菌清降解菌 BJQ2的分离,鉴定及影响因素研究[J].农业环境科学学报,2012,31(2):306-311.
[12]Okorski A,Pszczółkowska A,Oszako T,et al.Current possibilities and prospects of using fungicides in forestry[J].Forest Res Paper,2015,76(2):191-206.
[13]万阳芳,李慧颖,刘俊果,等.农产品中农药残留化学降解方法研究进展[J].河北工业科技,2014,31(2):148-151.
[14]袁大伟,吕卫光,李双喜,等.农药在蔬菜中的残留动态及降解规律研究[J].中国农学通报,2014,30(9):317-320.
[15]Godard T,Fessard V,Huet S,et al.Comparative in vitro and in vivo assessment of genotoxic effects of etoposide and chlorothalonil by the comet assay[J].Mutat Res/Genet Toxicol Environ Mutag,1999,444
(1):103-116.
[16]Meena V D,Dotaniya M L,Coumar V,et al.A Case for silicon fertilization to improve crop yields in tropical soils[J].Proceed Nation Acade Sci,India Section B:Biolog Sci,2014,84(3):505-518.
[17]Blunt T D,Brunk G,Koski T, et al.Typhula blight development in Poa annua and Poa pratensis as infl uenced by persistence of the fungicides chlorothalonil and fludioxonil under snow cover[J].Canad J Plant Pathol,2015,37(2):165-178.
[18]高闯,张全,王继锋.萘降解菌的筛选及其对多环芳烃的降解[J].化工环保,2015,35(1):17-20.
[19]Tan Yongqiang,Huang Qinghua,Shi Taozhong,et al.Promoting photosensitized reductive dechlorination of chlorothalonil using epigallocatechin gallate in water[J].J Agricul Food Chem,2014,62(50):12090 -12095.
[20] Porras J,Ferná ndez J J,Torres-Palma R A,et al.Humic substances enhance chlorothalonil phototransformation via photoreduction and energy transfer[J].Environ Sci Technol,2014,48(4):2218-2225.
[21]李学德,花日茂,岳永德,等.百菌清(chlorothalonil)在水中的光化学降解[J].应用生态学报,2006,17(6):1091-1094.
[22]Tan Yongqiang,Xiong Haixia,Shi Taozhong,et al.Photosensitizing effects of nanometer TiO2on chlorothalonil photodegradation in aqueous solution and on the surface of pepper[J].J Agricul Food Chem,2013,61(21):5003-5008.
[23]周瑶,李阳,王玉军,等.臭氧对土壤中百菌清降解的影响[J].东北林业大学学报,2012,40(1):62-65.
[24]Staley Z R,Rohr J R,Senkbeil J K,et al.Agrochemicals indirectly increase survival of E.coli O157:H7 and indicator bacteria by reducing ecosystem services[J].Ecolog Appl,2014,24(8):1945-1953.
[25]Wang Guangli,Li Rong,Li Shunpeng,et al.A novel hydrolytic dehalogenase for the chlorinated aromatic compound chlorothalonil[J].J Bacteriol,2010,192(11):2737-2745.
[26]曲迪.百菌清降解菌的降解特性及其对污染土壤的修复效果研究[D].吉林:吉林农业大学,2012.
[27]梁斌.百菌清降解菌株分离鉴定、降解特性和降解基因克隆研究[D].南京:南京农业大学,2010.
[28]史秀珍.百菌清降解菌的筛选及其降解特性研究[D].北京:中国农业科学院,2007.
[29]张博,张悦丽,李彦,等.百菌清在不同季节设施蔬菜上的残留降解规律研究[J].中国农学通报,2014,30(16):312-316.
[30]Shi Xiuzhen,Guo Rongjun,Miao Zuoqing,et al.Chlorothalonil degradation by Ochrobactrum lupini strain TP-D1 and identification of its metabolites[J].World J Microbiol Biotechnol,2011,27(8):1755-1764.
[31]Wang Guangli,Liang Bin,Li Feng,et al.Recent advances in the biodegradation of chlorothalonil[J].Current Microbiol,2011,63(5):450-457.
[32]Jin Xiangxiang,Cui Ning,Zhou Wei,et al.Soil genotoxicity induced by successive applications of chlorothalonil under greenhouse conditions[J].Environ Toxicol Chem,2014,33(5):1043-1047.
[33]Zhang Manyun,Teng Ying,Zhu Ye,et al.Isolation and characterization of chlorothalonil-degrading bacterial strain H4 and its potential for remediation of contaminated soil[J].Pedosphere,2014,24(6):799-807.
[34]Kwon J W,Armbrust K L.Degradation of chlorothalonil in irradiated water/sediment systems[J].J Agricul Food Chem,2006,54(10):3651-3657.
[35]Ríos-Montes K A,Peñuela-Mesa G A.Chlorothalonil degradation by a microbial consortium isolated from constructed wetlands in laboratory trials[J].Actualidades Biológicas,2015,37(102):255-265.
[36]Van Scoy A R,Tjeerdema R S.Environmental fate and toxicology of chlorothalonil[M].Heidelberg,FRG:Springer International,2014:89-105.
[37]Kim Y M,Park K,Joo G J,et al.Glutathione-dependent biotransformation of the fungicide chlorothalonil[J].J Agricul Food Chem,2004,52(13):4192-4196.
[38]Van Eeden M,Potgieter H C,Van der Walt A M.Microbial degradation of chlorothalonil in agricultural soil:A laboratory investigation[J].Environ Toxicol,2000,15(5):533-539.
[39]Van Pee K H,Unversucht S.Biological dehalogenation and halogenation reactions[J].Chemosphere,2003,52(2):299-312.
[40]Carlo-Rojas Z,Bello-Mendoza R,Figueroa M S,et al.Chlorothalonil degradation under anaerobic conditions in an agricultural tropical soil[J].Water,Air,Soil Pollut,2004,151(1/2/3/4):397-409.
[41]郎漫,李平,蔡祖聪.百菌清在土壤中的降解及其生态环境效应[J].中国农学通报,2012,28(15):211-215.
[42]张晓菲.一株百菌清降解菌株的分离鉴定及其对土
壤中百菌清污染的修复研究[D].南京:南京农业大学,2013.
[43]Motonaga K,Takagi K,Matumoto S.Suppression of chlorothalonil degradation in soil after repeated application[J].Environ Toxicol Chem,1998,17(8):1469-1472.
[44]Liang Bin,Li Rong,Jiang Dong,et al.Hydrolytic dechlorination of chlorothalonil by Ochrobactrum sp.CTN-11 isolated from a chlorothalonil-contaminated soil[J].Curr Microbiol,2010,61(3):226-233.
[45]Du J,Singh H,Ngo H T T,et al.Lysobacter tyrosinelyticus sp.nov.isolated from Gyeryongsan national park soil[J].J Microbiol,2015,53(6):365-370.
[46]Bending G D,Rodriguez-Cruz M S,Lincoln S D.Fungicide impacts on microbial communities in soils with contrasting management histories[J].Chemosphere,2007,69(1):82-88.
(编辑 祖国红)
Research progresses in bioremediation of chlorothalonil contaminated soil
Tang Liwei1,Lu Diannan2,Liu Yongmin1
( 1.College of Chemistry,Chemical Engineering and Environment Engineering,Liaoning Shihua University,Fushun Liaoning 113001,China; 2.Key Laboratory of Industrial Biocatalysis,Ministry of Education,Department of Chemical Engineering,Tsinghua University,Beijing 100084,China)
Aiming at the features and problems of chlorothalonil in soil,such as stable efficacy,difficult to be decomposed,long metabolic cycle,and serious soil pollution caused by long-term dosing,the toxicity mechanism of chlorothalonil is briefl y introduced.The principles as well as the advantages and disadvantages of physical,chemical and biological methods for chlorothalonil degradation in soil are summarized.The major degradation strains and their effects,the degradation pathways,the degradation products and the toxicity of the products in bioremediation of chlorothalonil contaminated soil are expounded.The factors affecting chlorothalonil degradation are analyzed,such as soil property,microbial species,temperature and soil moisture content.The focal points for further research are put forward,such as:the toxicity analysis of intermediate degradation products,the further degradation and conversion of the intermediate products and the development of complex bacteria preparations or multi-enzyme complex systems,by which chlorothalonil can be degraded completely and become harmless.
chlorothalonil;contaminated soil;bioremediation;degradation strain;degradation pathway;degradation product
X53
A
1006-1878(2016)02-0131-06
10.3969/j.issn.1006-1878.2016.02.003
2015-10-08;
2015-11-13。
唐丽伟(1990—),女,辽宁省沈阳市人,硕士生,电话 17888841929,电邮 623473061@qq.com。联系人:刘永民,电话 13942331811,电邮 liu79ym@tom.com。
国家自然科学基金项目(21276139)。

