人巨细胞病毒US31蛋白特异性抗体的制备及鉴定
陈碧,谢尚丹,项超丽,施昕妤,郭刚强,欧阳敬中,沈贤
(1.温州医科大学 第二临床医学院,浙江 温州 325035;2.温州市人民医院 肿瘤外科,浙江 温州 325000;3.温州医科大学 基础医学院,浙江 温州 325035)
人巨细胞病毒(humancytomegalovirus,HCMV)作为一种条件致病病毒,不仅是艾滋病、器官移植等免疫功能缺陷患者的严重致病原,也是引起围生期感染、新生儿疾病和先天畸形的常见病原体[1-4]。HCMV基因组由长独特序列(unique long region,UL)和短独特序列(unique short region,US)以及两端的反向重复序列组成[3]。US31基因位于US30和US32之间,增殖相关的立即早期蛋白2(immediate early protein 2,IEP2)可抑制US31表达,提示可能是HCMV潜伏感染的建立与维持所必需的基因[1]。 前期研究表明,US31基因的蛋白表达可刺激巨噬细胞向M1巨噬细胞表型分化并直接与NF-κB2相互作用,导致磷酸化p100的多聚泛素化和NF-κB2的激活,提示HCMV蛋白US31在系统性红斑狼疮的发病中起着诱导NF-κB介导的单核巨噬细胞的炎症反应的作用[2]。本研究进行了HCMV US31基因的蛋白表达、纯化及其多克隆抗体的制备、纯化,经鉴定证实,获得高表达HCMV US31编码蛋白和其特异性IgG抗体,为进一步研究HCMV US31生物学功能奠定基础。
1 材料和方法
1.1 材料
1.1.1 试剂和酶类:预染蛋白Marker、DNA聚合酶、限制性核酸内切酶Nde I和Xho I均购自Fermentas公司,PCR产物纯化试剂盒、1 kb DNA Marker、DNA Marker DL2000均购自天根生化科技(北京)有限公司,氨苄青霉素购自济南齐鲁药厂,异丙基硫代-β-D-硫代吡喃半乳糖苷(IPTG)购自德国默克公司,小鼠抗His单克隆抗体购自上海Abmart公司,辣根过氧化物酶(HRP)标记的羊抗兔IgG(H+L)单克隆抗体和HRP标记的羊抗小鼠IgG(H+L)单克隆抗体购自杭州联科生物技术有限公司,镍螯合亲和层析胶体(Ni-NTAAgarose)购自美国Qiagen公司,脱脂奶粉购自美国BD公司,蛋白酶抑制剂、完全弗氏佐剂、不完全弗氏佐剂购自美国Sigma公司。
1.1.2 质粒和菌株:pET21a(+)表达载体和E.coli BL21(DE3)均购自美国Invitrogen公司。表达US31蛋白的重组腺病毒(Ad-US31)由本实验室构建并长期保存。
1.1.3 实验动物:健康新西兰大白兔,雌性,体质量为(2.5±0.2)kg,4~5周龄,由温州医科大学实验动物中心提供,动物许可证号:SYXK(浙)2019-0009。
1.2 方法
1.2.1 HCMV US31原核重组质粒的构建及鉴定:参照HCMV US31基因序列(GenBank accession number:GU937742),通过生物网站(http://www.jcat.de/)进行原核表达密码子优化,交由北京擎科生物有限公司全序列合成后,克隆入pET21a(+)载体中,获得pET21a(+)/HCMV US31重组质粒。将重组质粒转化到E.coli BL21(DE3)感受态细菌中,氨苄平板筛选阳性克隆并用T7通用引物进行PCR验证,提取阳性克隆质粒后分别进行酶切和测序鉴定。质粒的提取、酶切、转化等操作按分子克隆常规方法进行。
1.2.2 HCMV US31重组蛋白的表达、鉴定及纯化:按1:100的比例接种至LB培养液中,再按1:50的比例接种至LB/Amp中。培养至OD600=0.6时,加入IPTG,37 ℃诱导后12 000×g离心,收集细菌。用8 mol/L尿素溶解细菌后,进行12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,摸索最适IPTG浓度及诱导时间。小鼠抗His单克隆抗体为一抗(1:5 000),HRP标记的羊抗小鼠IgG(H+L)单克隆抗体作为二抗,进行Western blot法分析和鉴定。经SDS-PAGE和Western blot法鉴定后进行HCMV US31重组蛋白的纯化。收集经IPTG诱导表达的菌 液,8 mol/L尿素重悬。用高压细胞破碎仪破碎菌液后,离心20 min,弃沉淀。过滤上清,分别用终浓度为10、50、100、200、500 mmol/L咪唑洗脱镍 柱,收集100和200 mL洗脱液进行透析,后进行超浓缩以获得高浓度的US31蛋白,以用于后期制备抗体的免疫原和进行效价评价的抗原。
1.2.3 HCMV US31多克隆抗体的制备:用纯化后的HCMV US31蛋白免疫新西兰大白兔(pUS31组)。初次免疫取200 μg纯化的蛋白稀释于1.5 mL的无菌PBS溶液内,加入等体积的完全弗氏佐剂充分乳化,于兔子腹部多点皮下注射;此后在第2、第4、第6周,取200 μg纯化的重组蛋白稀释于1.5 mL的无菌PBS内,加入等体积的不完全弗氏佐剂充分乳化,加强免疫3次。同时设计对照组(PBS组),每组3只。于第0、第2、第4、第6周从兔耳缘静脉取血,第8周兔心脏取血,收集的血液于37 ℃下静置1 h,3 000×g,4 ℃离心5 min,分离血清并分装,置于-80 ℃下保存备用。
1.2.4 HCMV US31多克隆抗体鉴定及效价分析:将纯化的HCMV US31蛋白以10 μg/mL的浓度包被ELISA 板,置于4 ℃下过夜,经洗涤、封闭后,pUS31组加HCMV US31蛋白免疫兔血清(1:100)作为一抗,PBS组加PBS免疫兔血清(1:100)作为一抗,二抗均为HRP标记的羊抗兔IgG(H+L)单克隆抗体(1:1 000)。反应结果置BioElx800酶标仪于450 nm处读取吸光度值,所有血清标本均重复3孔检测,取平均值,并以PBS作为阴性对照,不加一抗作为空白对照。同 时,对第6周收集的血清抗体进行效价检测,血清倍比稀释度分别为1:40、1:160、1:640、1:2 560、1:10 240、1:40 960、1:163 840。
1.2.5 HCMV US31多克隆抗体的纯化:根据IgG抗体纯化试剂盒说明书(Pierce Cat.No.22852),取HCMV US31蛋白免疫6周兔血清2~4 mL,加入等体积的结合缓冲液稀释,离心去除油脂及杂质。用10 mL结合缓冲液平衡亲和柱后,加入血清,使IgG被充分结合,用结合缓冲液洗涤后,分次将洗脱液(1~2 mL/次)加入柱内洗脱IgG至加有1 mol/L Tris的EP管内,洗脱柱内可能残留的IgG。检测血清样品洗脱液OD值,混合OD值>0.1的洗脱液加入不完全培养基至14~15 mL,移入浓缩管,离心至体积剩余约250 μL,弃去管内废液后重复更换缓冲液2~3次,移至EP管,取150 μL不完全培养基洗涤浓缩管,重复1~2次,洗涤液同样加入到EP管中。用Millex-GV滤器将经浓缩的IgG溶液过滤。混合 10 μL纯化的IgG和190 μL不完全培养基,测定混合液的OD280值并计算IgG浓度及体积。
1.2.6 Western blot及免疫荧光法验证US31抗体的特异性:将表达US31的重组腺病毒Ad-US31(Ad-US31组)及不含目的基因病毒(Control组)转染HEK293T细胞,于转染24 h后收集总蛋白,以本研究制备的US31纯化多克隆抗体作为一抗(1:5 000),羊抗兔IgG单克隆抗体作为二抗(1:1 000)进行US31蛋白的Western blot检测和免疫荧光定位。
2 结果
2.1 pET21a(+)/HCMV-US31重组质粒构建 抽提构建后的pET21a(+)/HCMV US31重组质粒存在超螺旋、环状和线性3种构型,见图1A。电泳后出现多个条带,经Nde I和Xho I酶切消化后,电泳结果显示在492 bp处出现目的片段,经测序鉴定,序列完全正确。见图1B。

图1 HCMV US31原核表达重组质粒的构建和鉴定
2.2 HCMV US31蛋白原核表达和鉴定 pET21a(+)/HCMV US31重组质粒诱导6 h后,经SDS-PAGE电泳和考马斯亮蓝染色,在相对分子质量约20 kDa的位置可见一条明显的蛋白条带;其中IPTG浓度为1.0、 1.2 mmol/L时目的蛋白含量较多,而未诱导的对照组菌液则不出现目的条带,见图2A。IPTG诱导后的重组质粒在相对分子质量约20 kDa处表达特异性的蛋白条带,而空载体和未诱导的对照组质粒均不存在目的条带,与预期结果一致,见图2B。将pUS31蛋白进行大量诱导表达并高压破菌,镍柱纯化pUS31全长蛋白,并以不同浓度的咪唑洗脱,SDS-PAGE电泳显示,US31主要存在于100、200 mmol/L咪唑洗脱液中,纯化后浓度可达500 ng/μL,见图2C。
2.3 HCMV US31特异性抗体的效价分析 pUS31组于免疫后第2周开始产生特异性IgG抗体,至第6周达到高峰,见图3A。间接ELISA法检测的第6周血清IgG抗体效价高达1:40 960,见图3B。
2.4 HCMV US31多克隆抗体的鉴定 Ad-US31组转染的HEK293T细胞表达US31蛋白,Control组转染的细胞则无目的蛋白表达,见图4A。Ad-US31组及Con-trol组转染的293T细胞作用时,Control组病毒转染的细胞未见红色荧光,Ad-US31组转染的HEK293T细胞可见红色荧光,且大部分位于细胞核周,见图4B。
3 讨论

图2 pUS31蛋白原核表达和纯化鉴定图
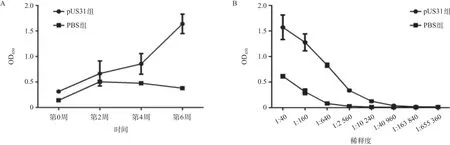
图3 HCMV US31特异性抗体效价分析

图4 US31特异性抗体检测HEK293T细胞中目的蛋白的表达
当机体免疫力低下时,潜伏感染的HCMV被激活,常导致移植失败、HCMV肺炎、肝炎甚至死亡等严重后果[4-5]。HCMV US31由162个氨基酸构成,相对分子质量为20 kDa。目前US31的生物学功能尚不完全清楚,有研究证实pUS31表达受IEP2的调控,IEP2是HCMV增殖性感染重要标志,说明US31在HCMV潜伏感染过程中可能发挥一定的作用[6-8]。HCMV US31核苷酸仅有少量变异,其核苷酸同源性高达98.1%~100%,几乎全部是同义突变[2,7-9]。此外,US31基因氨基酸序列高度保守,同源性大小为99.3%~100%,说明该结构对于HCMV的生物学功能具有重要的意义,宿主的抗病毒选择压力保留了这段基因的稳定性,与AD169株gL蛋白的序列变化高度相似[10]。
前期发现,系统性红斑狼疮患者PBMC中表达的US31可通过促进NF-κB2的激活改变单核巨噬细 胞的免疫功能,促进M1的炎症反应,其可能机制 是,US31可以充当E3样连接酶并促进磷酸化p100的泛素化和蛋白酶体加工从而激活NF-κB2途径[10-11]。
本实验通过构建原核表达载体pET21a(+)/HCMV US31,并在大肠杆菌中进行了原核表达和纯化,获得融合蛋白,相对分子质量为20 kDa,与预期一致。融合蛋白主要以可溶性的形式表达,为后续的蛋白质纯化提供了便利,而且目的蛋白无需经过变性再复性的过程,更大程度保留了蛋白质的活性。另外,在构建重组质粒时,增加了6个His-Tag (组氨酸标签)的基因序列。His-tag无免疫原性,对蛋白质的分泌、折叠、功能基本无影响,但能高度亲和镍离子,使得亲和纯化的效率大为提高。
特异性抗体在免疫学研究和诊断实验技术中应用广泛[11]。本实验使用纯化的融合蛋白免疫家兔,获得效价高达1:40 960的特异性抗体,证实US31蛋白具有较强的免疫原性。本研究进一步分析US31抗体的特异性,Western blot、免疫荧光均证实本研究制备的抗体能特异性地识别真核表达的US31蛋白。本研究制备的US31蛋白及抗体可为进一步研究US31蛋白功能以及US31检测试剂盒开发提供基础。
——一道江苏高考题的奥秘解读和拓展

