法舒地尔对软骨细胞基质降解的影响及其机制
季恩成,周也立,陈成帷,陈春,李井,高伟阳,潘哲尔
(1.温州医科大学附属第一医院 骨科,浙江 温州 325015;2.温州医科大学附属第二医院育英儿童医院 手外科,浙江 温州 325027)
骨关节炎是以软骨的退变、软骨下骨硬化和滑膜炎症为特征的全球性疾病,并且最终诱发关节功能障碍[1]。如何有效延缓骨关节炎的进展,已成为该领域的一项亟待解决的难题。因此,很有必要探索一种有效的治疗骨关节炎的方法。法舒地尔是一种Rho相关卷曲螺旋蛋白激酶(Rho associated coiledcoil forming protein kinase,ROCK)的新型抑制剂,最初被用于蛛网膜下腔出血患者,以缓解血管痉挛并改善其预后[2]。大量研究报道了其更为广泛的效应,例如抑制MAPK通路激活的作用[3]。虽然既往研究表明法舒地尔能有效对抗骨关节炎发生的疼痛,但关于法舒地尔在该领域的应用或分子机制的研究却很少。因此,本研究旨在观察法舒地尔对IL-1β诱导的大鼠软骨细胞外基质(extracellular matrix,ECM)降解的影响,并探讨其可能的作用机制,为骨关节炎的治疗提供新的思路。
1 材料和方法
1.1 材料 由温州医科大学实验动物中心提供的清洁级1周龄雄性SD大鼠,动物使用许可证号:SYXK(浙)2015-0009。法舒地尔购于大连美仑公司;4’,6-二脒基-2-苯基吲哚(DAPI)购于北京索来宝公司;重组IL-1β购于美国PeproTech公司;细胞计数试剂盒-8(CCK-8)购于日本Dojindo公司;COX-2、p-ERK/ERK、p-JNK/JNK、p-p38/p38和GAPDH抗体购于美国PeproTech公司;iNOS抗体购于美国Cell Signaling Technology公司;山羊抗兔IgG-HRP、山羊抗小鼠IgG-HRP、Alexa Fluor 488标记的山羊抗兔IgG(H+L)二抗和RIPA裂解缓冲液购于上海碧云天生物技术有限公司;One Step TB Green Prime-Script RT-PCR Kit II购于美国Perfect Real Time公司;RNAiso Plus购于日本TaKaRa公司;F12/DMEM 培养基购于美国Gibco公司;前列腺素E2(PGE2)测定试剂盒和一氧化氮(NO)测定试剂盒购于南京建成生物工程研究所。
1.2 方法
1.2.1 大鼠软骨细胞的培养:将切下的软骨切成约0.4 mm大小,于含1%双抗PBS液冲洗3次,以1 000 r/min离心5 min,弃上清,加入0.2% II型胶原酶在37 ℃温箱消化6 h,加入培养基终止消化,以200目滤网过滤,收集滤液,1 200 r/min离心 5 min,弃上清,将软骨细胞在含有10%胎牛血清和1%青霉素/链霉素抗生素的DMEM/F12培养基中,在保持5% CO2,37 ℃的培养箱中培养,24 h后更换培养基。当细胞达到80%~90%的皿底面积时,使用0.25%胰蛋白酶-EDTA收集细胞。然后,将细胞以适当的密度接种到10 cm培养皿中。第3代的软骨细胞将用于所有实验。将软骨细胞置于37 ℃,5% CO2培养箱中培养,并且每隔1 d更换培养基。
1.2.2 分组:CCK-8分组方法为:软骨细胞分别 加入0、1、2.5、5、10、20、50 μmol/L浓度的法舒地尔溶液,作用24 h后加入CCK-8并检测细胞活性。其余的细胞实验分组方法为:软骨细胞加入终浓度分别为0和10 ng/mL的IL-1β处理24 h后,再分别用终浓度为0与10 μmol/L的法舒地尔处理2 h。分为空白组、法舒地尔组(10 μmol/L)、IL-1β组(10 ng/mL)和IL-1β(10 ng/mL)+法舒地尔 (10 μmol/L)组。
1.2.3 CCK-8实验:根据说明书使用CCK-8试剂盒测定法舒地尔对软骨细胞活性影响。将大鼠软骨细胞接种到96孔板上,用递增浓度的法舒地尔(1、 2.5、5、10、20、50 μmol/L)培养细胞24或48 h,然后向每个孔中加入10 μL CCK-8,并将96孔板在37 ℃下孵育4 h。然后使用酶标仪测量450 nm处的吸光度。将不加法舒地尔的对照组吸光度设为100%,其余各孔的吸光度则换算为对应的百分比。
1.2.4 qRT-PCR检测:使用RNAiso Plus分离总RNA。在以下反应条件下进行qRT-PCR:42 ℃下5 min, 95 ℃下10 s,然后进行40个循环;95 ℃ 5 s,60 ℃ 34 s。在总体积10 μL中进行反应,其中含有1 μL总RNA,0.4 μL正引物,0.4 μL逆引物,5 μL一步SYBR缓冲液,0.4 μL酶混合物和2.8 μL的去离子水。将靶mRNA水平用GAPDH水平进行对照。使用2-ΔΔCT方法分析数据[4]。每个待检测指标重复至少3次。靶基因的引物序列分别为:二型胶原(Collagen- II): 正向引物5’-CTCAAGTCGCTGAACAACCA-3’,反向引物5’-GTCTCCGCTCTTCCACTCTG-3’;MMP-13:正向引物5’-CTGCGGTTCACTTTGAGGA-3’,反向引物5’-TCTTCTATG AGGCGGGGATA-3’;GAPDH:正向引物5’-TGCCACTCAGAA GACTGTGG-3’,反向引物5’-TTCAGCTCTGGGATGACCT-3’。
1.2.5 Western blot检测:使用RIPA裂解缓冲液提取总蛋白质,再用BCA蛋白质测定试剂盒测定蛋白质浓度。将蛋白质样品(40 μg)上样到SDS-PAGE凝胶上进行电泳,转膜,5% BSA封闭2 h,将PVDF膜与相应的的一抗稀释液置于4 ℃过夜。然后与相应二抗室温孵育2 h。加入ECL显影液,于化学发光仪上曝光分析。
1.2.6 细胞免疫荧光检测:将软骨细胞以5×104个细胞/mL的密度接种在6孔板中,孵育24 h。将细胞在4%多聚甲醛中固定15 min,并在含有0.5% TritonX-100的PBS中通透15 min。在室温下用5%山羊血清孵育细胞1 h,并与MMP-13(1:200)抗体在 4 ℃温育过夜。第2天用PBS洗涤后,将细胞与荧光素缀合的山羊抗兔IgG抗体(1:250)一起孵育1 h,然后用DAPI标记5 min,使用荧光显微镜捕获图像。
1.2.7 NO和PGE2检测:细胞经过处理后收集并离心,得到细胞上清液。用硝酸还原酶法测定NO表达量[5];上清液中PGE2的表达量则用ELISA测定。
1.3 统计学处理方法 采用SSPS18.0统计软件进行统计学分析。计量资料用s表示。多组间比较使用单因素方差分析,组间两两比较用LSD-t法。 P<0.05为差异有统计学意义。
2 结果
2.1 法舒地尔对大鼠软骨细胞活力的影响 与 0 μmol/L法舒地尔比,20、50 μmol/L均能抑制软骨细胞增殖,差异均有统计学意义(P<0.05),见图1。因此随后的实验将选择浓度为10 μmol/L的法舒地尔作为相应的刺激浓度。
2.2 法舒地尔对大鼠软骨细胞p-MYPT、ROCK1和ROCK2表达的影响 与IL-1β组相比,IL-1β+法舒地尔组中ROCK1、ROCK2和p-MYPT蛋白的表达均降低,差异均有统计学意义(P<0.05),见图2。
2.3 法舒地尔对大鼠软骨细胞iNOS、COX-2、NO和PGE2表达的影响 与空白组比,IL-1β组中iNOS、COX-2、NO和PGE2的表达显著上调,差异有统计学意义(P<0.05);与IL-1β组比,IL-1β+法舒地尔组中iNOS、COX-2、NO和PGE2有显著下调,差异有统计学意义(P<0.05),见图3。
2.4 法舒地尔对大鼠软骨细胞MMP-13和Collagen- II 表达的影响 与空白组比,IL-1β组中MMP-13的表达显著增加,而Collagen- II的表达降低,差异有统计学意义(均P<0.05);与IL-1β组比,IL-1β+法舒地尔组中MMP-13表达降低,而Collagen- II的表达增加,差异有统计学意义(均P<0.05),见图4。
2.5 法舒地尔对大鼠软骨细胞MAPK通路活化的影响 与空白组比,IL-1β组中p-ERK、p-JNK和p-p38的表达量提高,ERK、JNK与P38的磷酸化水平提高,差异有统计学意义(均P<0.05);与IL-1β组比,IL-1β+法舒地尔组中p-ERK、p-JNK和p-p38的表达量降低,ERK、JNK和p38水平降低,差异均有统计学意义(均P<0.05),见图5。
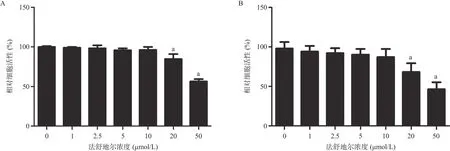
图1 不同浓度法舒地尔对软骨细胞活力的影响

图2 法舒地尔对IL-1β诱导的软骨细胞ROCK1、ROCK2、p-MYPT蛋白表达的影响

图4 法舒地尔对IL-1β诱导的软骨细胞MMP-13表达和Collagen- II的影响

图5 法舒地尔对IL-1β诱导的软骨细胞MAPK通路活化的影响
3 讨论
目前,骨关节炎的早期治疗主要采取姑息性干预措施,包括运动减重,关节腔注射玻璃酸钠等;而当骨关节炎进展至中、晚期时,病情已难以逆转,膝关节成形术、截骨术等手术干预或成为最后的治疗手段。因此寻找一种有效的早期干预靶点,是骨关节炎的研究热点。降低关节软骨ECM降解水平可抑制骨关节炎的进展。目前,已有研究提出了法舒地尔通过抑制关节软骨ECM降解水平来治疗骨关节炎[6],因此本研究为了验证法舒地尔的药理作用,进一步探究了法舒地尔对IL-1β刺激的软骨细胞的各项指标的影响。
在骨关节炎的发生发展中,ECM降解起着至关重要的作用。而Collagen- II作为ECM的重要成分,主要由MMP-13降解消化[7]。IL-1β的刺激与ECM的降解有关,并诱导iNOS和COX-2的表达,产生NO和PGE2,使得骨关节发生非细菌性的炎性改变。并且,NO在骨关节炎中诱导MMP表达并抑制Collagen- II分泌。PGE2在骨关节炎中具有重要的致病作用,例如抑制ECM合成,抑制软骨细胞增殖等[8]。我们还检测了iNOS和COX-2的蛋白质水平,实验结果表明表明法舒地尔降低了iNOS和COX-2的表达,降低了NO和PGE2的表达,也使MMP-13与Collagen- II表达接近对照组,这与我们的推测表现一致。
ROCK1和ROCK2是ROCK的2种亚型,而ROCK激活后,会磷酸化MYPT,使得p-MYPT的量增加。法舒地尔作为ROCK的抑制剂,可抑制IL-1β刺激的软骨细胞中ROCKs和p-MYPT增加。ROCK在骨关节炎的进展中得到了激活,是促进软骨ECM降解的重要机制之一。并且,鉴于ROCK被认为是MAPK途径的上游[9],我们猜想骨关节炎中ROCK的异常激活状态使得下游的MAPK通路也被激活,而应用ROCK的抑制剂法舒地尔能够抑制ROCK,并使得下游的MAPK通路的激活状态得到抑制,从而减少了ECM的降解。MAPK通路在骨关节炎发生发展中起重要作用,由ERK,JNK和p38组成的MAPK通路的激活参与了MMP表达和软骨结构的破坏[10],它们的磷酸化水平可表明骨关节炎进展的严重程度。应用IL-1β刺激诱导软骨细胞,可模拟骨关节炎条件下的ERK、JNK和p38的激活与磷酸化。在骨关节炎中, MAPK通路也位于iNOS和COX-2的上游,使其表达得到增加;也有研究指出MAPK通路的抑制可导致MMP-13表达的下调。因此,如果要抑制ECM降解,抑制MAPK通路的激活是可行的途径之一[11]。我们的实验证明应用法舒地尔可抑制MAPK通路,这一点也与以往的文献结果呈现一致。
综上所述,本研究初步证明法舒地尔对软骨ECM降解具有抑制作用,并且能下调促进骨关节炎性进展的炎症介质表达,其机制可能是通过抑制ROCK,继而抑制MAPK通路激活来起效的。本研究提示法舒地尔是一种潜在的治疗骨关节炎的药物。

