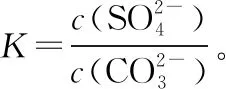考前预警平衡常数 重点防范思维陷阱
黑龙江
天不变,道亦不变,温度不变,反应中的化学平衡常数、电离平衡常数、水的离子积、水解平衡常数、溶度积等诸常数亦不变,如何在变与不变之中,考查核心素养,让高素质“专家型”的学生进入“双一流”大学深造,在冲刺的关键时期,要以错为镜,吃一错长一智,查错改错,做好防范,达到减负增分的效果。
一、关注s、l、g,防范状态陷阱
在平衡常数表达式中不写入固体与纯液体,这点体现在水的离子积和溶度积表达式中,纯水和难溶电解质不写入其中,其表达式是平衡时离子浓度的幂之积,电离平衡常数和水解平衡常数同理不写入水。状态陷阱主要针对化学平衡,计算化学平衡常数时一定要看清反应体系中物质的聚集状态。
【例1】一定条件下,向2 L恒容密闭容器中通入2 mol CO和1 mol SO2,在催化剂作用下发生反应生成CO2(g)和S(l),若反应进行到40 min时反应达到平衡状态,此时测得容器中气体的密度比反应前减小了12.8 g·L-1,则化学平衡常数K=________。
【答案】160 L/mol
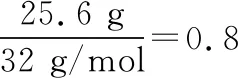

起始(mol) 2 1 0 0
变化(mol) 1.6 0.8 1.6 0.8
平衡(mol) 0.4 0.2 1.6 0.8
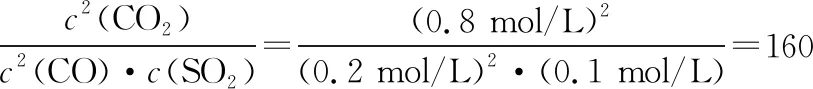
二、关注体积因素,防范浓度陷阱
平衡常数是温度函数,体现平衡这一特定状态下,生成物与反应物的浓度关系,若用物质的量进行三行式计算,结果一定要通过体积转化为物质的量浓度,注重思维的严谨性;平衡常数与起始浓度无关,但平衡浓度会受起始浓度的影响,溶液的混合与滴定都会引起体积变化,进而影响平衡浓度,以此培养思维的动态性。

( )
图Ⅰ
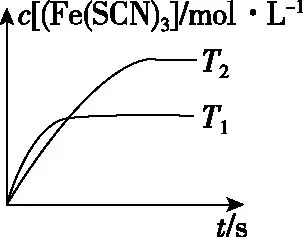
图Ⅱ
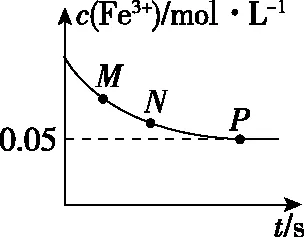
A.该反应为放热反应
B.生成Fe3+的速率:P>N>M
C.常温下,该反应的平衡常数约为1 000
D.其他条件不变,若将P点溶液各组分浓度均变为原来的2倍,平衡逆向移动
【答案】D
【解析】A选项中判断反应热效应可以通过分析图Ⅱ获得结论,根据先拐先平反应温度高的原则,T1曲线先拐先达到平衡,则T1>T2,T1对应c[Fe(SCN)3]小,说明升高温度平衡逆向移动,逆反应是吸热反应,正反应是放热反应,A正确;B选项可以通过分析图Ⅰ获得结论,图中纵坐标是反应物c(Fe3+),反应物浓度越大正反应速率越大,随着反应物浓度的降低,正反应速率减小,逆反应速率增加,最后正逆反应速率相等达到化学平衡,B选项反向设问,比较逆反应速率的大小关系,结论是正确的;C选项运用三行式进行平衡浓度的运算,过程如下:

起始(mol/L) 0.2 0.5 0
变化(mol/L) 0.15 0.45 0.15
平衡(mol/L) 0.05 0.05 0.15
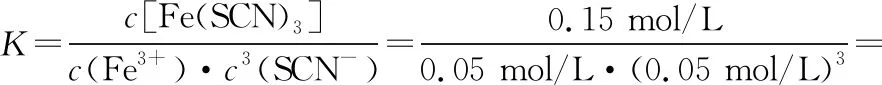

起始(mol/L) 0.1 0.25 0
变化(mol/L) 0.05 0.15 0.05
平衡(mol/L) 0.05 0.1 0.05
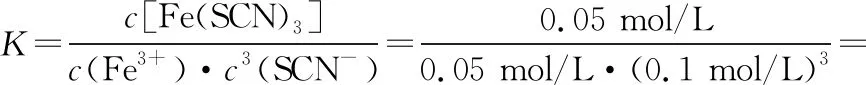
三、关注条件因素,防范定式陷阱
水无常势题无常形,如果经常在恒温恒容下解题,就可能忽视题干中恒温恒压这样的条件改变,习惯了常温下水的离子积,就不关注温度对Kw的影响,这种定式思维会导致解题走向歧途,审清题干条件是正确解答的第一枚纽扣。

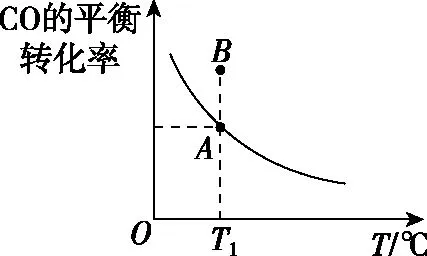
若达到化学平衡状态A时,CO的体积分数为25%,平衡常数KA=________。
【答案】4 L2/mol2
【解析】计算A状态的平衡常数KA,需要A点对应的c(CO)、c(H2)、c(CH3OH),起始反应物的物质的量和CO的体积分数25%是可以利用的解题支点,运用三行式进行计算:

起始(mol) 1 2 0
变化(mol)x2xx
平衡(mol) 1-x2-2xx
四、关注物质化学计量,数防范计算陷阱
化学计量数主要有两方面应用,首先用在平衡浓度的指数关系上,直接影响计算的结果和量纲,其次用在物质的转化关系上,反应物与生成物的消耗和生成的物质的量之比,等于化学计量数之比。

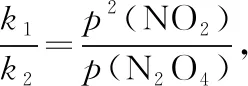
五、关注表中隐含数据,防范条件不足陷阱
从解题要素分析,题干直接呈现的条件不能满足解题时,需要借助思维工具,逆向寻找与问题相匹配的常数,积极思考解决问题而不是选择放弃。
【例5】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
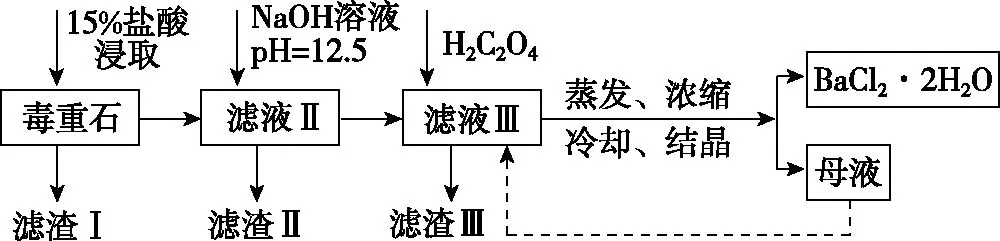
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9;
(2)离子浓度小于1×10-5mol/L时认为沉淀完全。
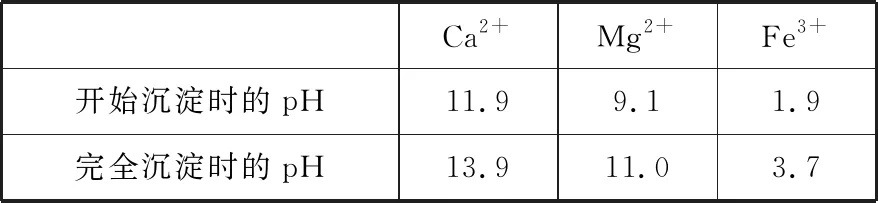
Ca2+Mg2+Fe3+开始沉淀时的pH11.99.11.9完全沉淀时的pH13.911.03.7
加入NaOH溶液后所得滤液Ⅲ中,含有的Mg2+浓度为________。
【答案】1.0×10-8mol/L
【解析】滤液Ⅱ中加入NaOH溶液后Mg2+被完全沉淀了,Mg2+浓度小于1×10-5mol/L,具体数值如何计算呢?解答沉淀后离子浓度需要用到溶度积,题干中没有提供此关键数据,根据Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)反向分析,已知Mg2+完全沉淀时的pH,c2(OH-)就解决了,又已知离子浓度小于1×10-5mol/L时认为沉淀完全,c(Mg2+)也解决了,至此得到了隐含溶度积的数值,pH=11.0即c(OH-)=10-3mol/L,则Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=10-5·(10-3)2=1.0×10-11,当pH=12.5时,c(OH-)=10-1.5mol/L,c(Mg2+)·(10-1.5)2=1.0×10-11,解得c(Mg2+)=1.0×10-8mol/L。
六、关注平衡的关联性,防范思维狭隘陷阱
弱酸(或弱碱)的电离平衡常数与其弱离子的水解平衡常数,通过水的离子积联系在一起,Ka·Kh=Kw或Kb·Kh=Kw;二元弱酸是分步电离的,其电离平衡常数与水解平衡常数是错位对应关系,一级电离平衡常数与二级水解平衡常数之积等于水的离子积Ka1·Kh2=Kw,二级电离平衡常数与一级水解平衡常数之积等于水的离子积Ka2·Kh1=Kw,上述结论是通过对电离平衡常数表达式和水解平衡常数表达式关联性的分析而获得的,所以分析平衡常数表达式是寻找关联性的重要途径。
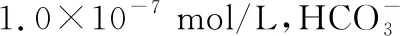
【答案】200 L2/mol2

七、关注知识的深度,防范简单化陷阱
水溶液中常常存在着多个平衡体系,离子关系很复杂,相同离子需要同时满足体系中所有平衡关系,这种平衡体系之间的相互影响和相互制约的关系,使得我们在解决问题时,对所学知识要深研细究,不仅知其然更要知其所以然,不做思维的懦夫浅尝辄止。

【答案】0.26 mol/L