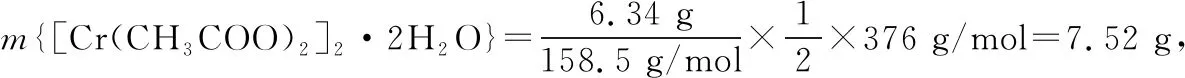“物质制备及性质”型实验题的考查特点和解题策略
福建
“化学实验与探究能力”是高考《考试大纲》要求的三大学习能力之一,“科学探究与创新意识”是化学学科核心素养的核心。因此,每年高考的实验综合题都备受关注。“物质制备及性质”型实验是近年高考实验综合题的热点题型之一。分析近年高考“物质制备及性质”型实验题的考查特点,对学生进行解题策略指导,不仅可以提高学生应对实验综合题的解题能力,而且可以提升学生的“科学探究与创新意识”素养。从物质制备及产物类别看,近几年全国卷及省市自主命卷中“物质制备及性质”型实验题其主要分为单质制备和化合物制备。化合物制备分成无机物制备和有机物制备。
一、“物质制备及性质”型实验题的构成要素

二、“物质制备及性质”型实验题的考查特点
“物质制备及性质”实验一般包括制备前的准备、制备中的操作过程和实验条件的控制、制备后的处理三个阶段。实验前的准备着重考查试剂选择、反应原理、仪器选择和组装;实验中着重考查反应条件的控制、操作要点、反应进程判断和实验现象的描述,实验后主要考查产物分离提纯(除杂、干燥)、收集或相关物质性质的应用、产物检验、产率计算和误差分析,往往伴随装置或者制法原理的改进与评价。“物质制备及性质”的考查以化合物制备尤为常见。其中,无机物的制备与性质试题侧重关注:①装置气密性检查;②仪器连接顺序;③实验原理和反应原理(含方程式);④实验操作注意事项;⑤各部分装置的作用和实验现象解释;⑥实验方案(或实验装置)优劣评价及改进。有机物的制备与性质试题侧重关注:①实验装置组装和仪器识别;②实验操作注意事项;③实验步骤中的反应原理及某些试剂的作用;④有机产物分离与提纯;⑤有机物产率计算。
三、“物质制备及性质”型实验题的解题程序
1.巧审题,明确实验目的和原理
根据题给信息获取实验目的,融合所学的基本理论、化学反应原理获取实验原理。分析制备过程中是否有副反应发生及目标产物是否需特殊保护等。遵循科学性、可行性、安全性、简约性原则。以促进主反应和抑制副反应为指导思想,整体理解实验方案和实验原理。
2.善思考,理清操作步骤的先后顺序
结合实验原理,分析实验方案中每个步骤的目的、原理和先后顺序。特别要理清制备后除杂提纯操作的原理与先后关系。
3.看图表,分析每个装置的作用
结合实验原理,理解实验装置作用和表格提供的信息。分析进入每一个装置的物质有哪些。这些物质吸收了装置中的什么物质(或反应生成什么物质)。如果缺少该装置,可能引起什么后果?以此获得每个装置的作用及表格中信息在实验中的应用。
4.悟规律,得出正确结论
实验现象(或数据)背后往往隐藏着化学反应原理和规律。从实验现象(或数据)入手,深入剖析实验成败的关键因素(或计算、推理论证,分析误差产生的原因)。
四、“物质制备及性质”型实验题真题分析
1.试题呈现
(2018·全国卷Ⅰ·26)醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图1所示,回答下列问题:
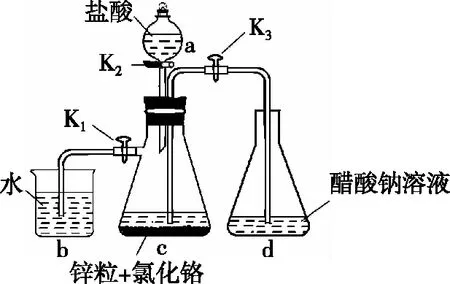
图1
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为______________。
②同时c中有气体产生,该气体的作用是______________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是______________;
d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点:__________。
2.试题简介和评价

3.试题详细解析
(1)由题给信息醋酸亚铬[(CH3COO)2Cr·H2O]用作O2吸收剂可知Cr2+易被O2氧化。本实验中的“物质体系”包括溶剂、反应物、产物、外界空气、内部空气、水中空气,所以“操作体系”需要尽可能避免与O2接触:蒸馏水须经煮沸后迅速冷却(溶剂中不含O2)、反应装置不能是敞开体系(反应装置内不含O2)、排除装置内空气(产品不与空气中O2接触)、分离提纯不能蒸发浓缩(产物不与空气中O2接触)。气体的溶解度随温度升高而减小,煮沸后迅速冷却可使水中不含O2,防止Cr2+被O2氧化。分析仪器a的结构特征,可知其为滴液(或分液)漏斗。

(3)①制备醋酸亚铬时利用产生的氢气制造还原性气氛,同时利用高压氢气使CrCl2溶液进入装置d并与醋酸钠作用生成醋酸亚铬。打开K3并关闭K1、K2,此时c中Zn与稀HCl反应产生的H2使c中压强增大,大于外界大气压,故c中溶液被压入d中。②醋酸亚铬易被O2氧化,故分离提纯时不能蒸发浓缩。同时考虑到醋酸亚铬难溶于冷水,故需采用(冰浴)冷却、过滤、洗涤、干燥的操作使其充分析出并分离。
4.试题参考答案
(1)去除水中的溶解氧 滴液(或分液)漏斗

(3)c中Zn与稀HCl反应产生H2,导致c中压强增大,大于外界大气压;(冰浴)冷却 过滤
(4)装置d处于敞开状态,容易造成部分醋酸亚铬被空气的O2氧化生成醋酸铬,从而使制得的产品不纯
五、“物质制备及性质”型实验题变式训练
1.试题呈现

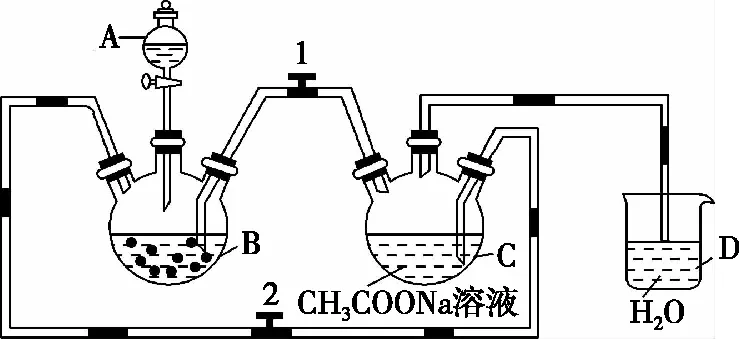
图2
请回答下列问题:
(1)仪器A的名称是________,由该仪器加入的试剂为________。
所有患者待血药浓度达到稳态后(药品说明书注明为连续给药5次后),于下次给药前30 min抽取静脉血3 mL,分离血清,采用荧光偏振免疫法(FPIA)以TDx-FLx型荧光偏振免疫分析仪监测患者体内万古霉素的血药谷浓度,所用仪器以及定标、质控、检测试剂盒均由美国Abbott公司提供。该方法血药浓度检测范围为0.5~100 mg/L,随行质控样品不少于5%[10]。根据患者监测结果,按<10、10~15、>15~20、>20 mg/L等4个组分析万古霉素血药谷浓度的分布情况。
(2)实验中所用蒸馏水均需煮沸处理的原因是______________。
(3)仪器D的主要作用是______________。
(4)产生H2后,使B中生成的CrCl2溶液与C中的醋酸钠溶液顺利混合采取的操作是________(填“打开”或“关闭”,下同)阀门1、________阀门2。
(5)本实验中锌粒保持过量的原因是(写2条):①________________;②________________。
(6)若实验时参与反应CrCl3溶液中含溶质6.34 g(假设其余反应物均足量),最终获得5.64 g纯净物[Cr(CH3COO)2]2·2H2O(摩尔质量376 g·mol-1)。利用以上数据计算该产品的产率为________。
(7)该实验装置也可用于制取氢氧化亚铁沉淀。若要求白色絮状的氢氧化亚铁沉淀能保持较长时间,则以下仪器中应装入的试剂为:A________、B________、C________。(填化学式)
2.试题参考答案
(1)滴液(或分液)漏斗 稀盐酸与CrCl3溶液
(2)使溶剂水中不含O2,防止Cr2+被O2氧化
(3)盛水,起到液封,隔绝空气,防止[Cr(CH3COO)2]2·2H2O被氧化的作用
(4)打开 关闭
(5)①Zn与CrCl3溶液反应生成CrCl2;②Zn与稀HCl反应产生足量H2,排尽装置内空气的同时,也可增大B中压强,把B中生成的CrCl2溶液压入C中与醋酸钠反应
(6)75%
(7)H2SO4(或HCl) Fe NaOH(或KOH)
3.试题分析思维导图

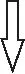
制[Cr(CH3COO)2]2·2H2O

[Cr(CH3COO)2]2·2H2O↓+4NaCl
(1)制H2排空气
(2)制CrCl2
(3)制目标产物根据质量
计算产率
4.试题详细解析

(1)根据仪器构造特征,A为滴液(或分液)漏斗。B中发生两个反应:①Zn与CrCl3溶液反应生成CrCl2;②Zn与稀HCl反应产生足量H2,排尽装置内空气的同时,也可增大B中压强,把B中生成的CrCl2溶液压入C中。故由该仪器加入的试剂为稀HCl和CrCl3溶液。
(2)Cr2+极易被O2氧化,故除用H2排除装置中的空气(O2)外,配制所用溶液的蒸馏水均需煮沸除去溶解氧。
(3)为防止装置外的空气(O2)进入装置中将醋酸亚铬水合物氧化,因此仪器D中烧杯盛水能起到液封,隔绝空气的作用。
(4)使处于不同区域的两种溶液混合,可利用气体引起压强增大,将一种液体压入另一种液体中。故阀门1、2分别打开、关闭时,产生的氢气增大B中压强,把B中生成的CrCl2溶液压入C中,并与C中醋酸钠混合。
(5)本题中锌有以下作用:①与CrCl3充分反应得到CrCl2;②与稀HCl反应产生足量H2,排尽装置内空气的同时,也可增大B中压强,把B中生成的CrCl2溶液压入C中,并与C中醋酸钠反应生成[Cr(CH3COO)2]2·2H2O。