把握考向 精准复习——例说酸碱中和滴定考题预测
陕西
酸碱中和滴定是中学化学中的一个传统必做实验,也是一个重要的定量实验,纵览近几年高考试题,中和滴定考查频率较高。试题涉及实验的仪器使用与基本操作、滴定反应的计算、数据处理与误差分析、迁移应用、图象分析等,既考查学生基础知识掌握情况,又考查学生的学科思维方法,分析理解能力,接受、整合、应用信息的能力。预计2019年高考在中和滴定实验的考查上将会继续有所重视,试题会有继承、发展与创新,主要考查方式变化不会太大。
一、考查主要仪器的使用
【例1】(高考题组编)下列叙述正确的是
( )

A.(2017·全国卷Ⅲ)取20.00 mL盐酸,在50 mL 酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B.(2016·天津卷)用如图所示仪器准确量取一定体积K2Cr2O7标准溶液
C.(2017·海南卷)容量瓶和滴定管使用前均需要检漏
D.(2014·全国卷Ⅰ)酸碱滴定实验中,酸式滴定管装标准溶液前,必须先用该溶液润洗,用待滴定溶液润洗锥形瓶以减小实验误差
【答案】C
【解析】滴定管最大刻度以下没有刻度,在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶中,盐酸的体积大于20.00 mL,A错误;K2Cr2O7溶液有强氧化性,准确量取一定体积K2Cr2O7标准溶液应用酸式滴定管,图为碱式滴定管,B错误;容量瓶和滴定管使用前均需要检漏,C正确;酸碱滴定实验中,锥形瓶不用待测液润洗,D错误。选C。
【备考提示】滴定实验用到的主要玻璃仪器有酸、碱式滴定管和锥形瓶。滴定管的使用应注意以下四个方面:一是滴定管的结构特点,滴定管的“0”刻度在上方,且最大刻度至活塞(或玻璃球)部分没有刻度,其刻度是上小下大。二是滴定管的精确程度和读数记录,滴定管精确到0.1 mL,估读到0.01 mL,记录溶液体积需保留到小数点后面两位。三是使用前要先检漏,再用蒸馏水洗,然后用所装溶液润洗2~3次。四是对盛装试剂的要求,酸式滴定管只能用来装酸性、氧化性试剂,不能装碱性试剂;碱式滴定管只能装碱性试剂,不能装酸性和氧化性试剂。锥形瓶使用前不需检漏,不用润洗。
二、考查滴定操作及指示剂的选择
【例2】(高考题组编)关于滴定实验,下列说法正确的是
( )
A.(2016·海南卷)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
B.(2018·全国卷Ⅲ)用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C.(2014·安徽卷)使用滴定管、锥形瓶、烧杯、0.100 0 mol/L 盐酸即可测定NaOH溶液浓度
D.(2016·全国卷Ⅰ)用盐酸滴定氨水选择酚酞作为指示剂
【答案】A
【解析】接近滴定终点时,滴定管尖嘴处悬挂的液滴需通过接触锥形瓶壁的方法使其进入锥形瓶中与待测液发生反应,A正确;标准HCl溶液滴定NaHCO3溶液,应选择甲基橙作指示剂,B错误;用0.100 0 mol/L盐酸测定NaOH溶液浓度,除需用到滴定管、锥形瓶、烧杯、NaOH溶液外,还需要指示剂,C错误;用盐酸滴定氨水宜选择甲基橙作为指示剂,D错误。选A。
【备考提示】滴定实验的操作中应注意:标准溶液的滴加速度先快后慢,接近终点时逐滴滴加,滴定管尖嘴处悬挂的溶液通过接触锥形瓶内壁使其流入发生反应,并用蒸馏水冲洗锥形瓶内壁,确保完全反应;眼睛注视锥形瓶中溶液颜色的变化。根据酸碱的强弱选择指示剂,强酸强碱相互滴定,选用酚酞或甲基橙作指示剂;强酸滴弱碱,用甲基橙作指示剂;强碱滴弱酸,用酚酞作指示剂。
三、考查滴定过程中离子浓度的变化
【例3】(2015·安徽卷)25℃时,在10 mL浓度均为0.1 mol/L NaOH和NH3·H2O混合溶液中,滴加0.1 mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
【答案】B

【备考提示】滴定过程中溶液中各离子浓度随标准溶液的加入逐渐发生变化,在滴定不同阶段比较离子浓度时,必须根据反应进行计算,推出溶液中溶质是什么,各占多少,有些离子浓度等量关系则需要利用电荷守恒和物料守恒结合溶液酸碱性进行分析判断。
四、考查滴定曲线图象分析
1.滴定过程中水的电离程度变化曲线
【例4】(2018·厦门模拟)常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
( )

A.V=40
B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.NH3·H2O的电离常数K=10-4

【答案】D
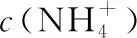
【备考提示】酸碱抑制水的电离,氢离子或氢氧根离子浓度越大,水的电离程度越小,若氢离子和氢氧根离子浓度相等,水的电离程度相等;盐类的水解促进水的电离,水解的离子浓度越大,水的电离程度越大。在酸碱中和滴定过程中,溶液中水的电离程度先逐渐增大,至恰好完全反应时水的电离程度最大,即曲线最高点表示恰好完全反应,随后再加入过量的标准溶液,水的电离程度又逐渐减小。
2.滴定过程中溶液导电性变化曲线
【例5】(2018·山东青岛质检)电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液{二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH]=1.6×10-4}。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
( )

A.曲线①代表滴定二甲胺溶液的曲线

C.d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
D.b、c、e三点的溶液中,水的电离程度最大的是b点
【答案】C

【备考提示】溶液导电性变化主要看滴定过程中溶液中离子浓度变化情况,强酸(强碱)滴定弱碱(弱酸)过程中,溶液中离子浓度增大,导电性增强。强酸(强碱)滴定强碱(强酸)过程中,滴定终点前,溶液中离子数目基本不变,溶液体积增大,离子浓度减小,导电性减弱;滴定终点后,继续加入标准溶液,溶液中离子浓度又逐渐增大,导电性增强。弱酸(弱碱)滴定强碱(强酸)过程中,溶液中离子浓度变化与强酸(强碱)滴定强碱(强酸)相似。因此根据曲线的变化趋势可以判断滴定反应。
3.滴定过程中溶液温度变化曲线
【例6】(2018·长春模拟)向10 mL 0.5 mol/L的氨水中滴入等物质的量浓度的盐酸,滴定过程中混合溶液的温度变化如图所示,下列有关说法正确的是
( )

A.由水电离出的c(H+):c点>b点
B.NH3·H2O的电离程度:a点>b点


【答案】C

【备考提示】酸碱中和滴定过程中滴定终点前溶液温度逐渐升高,至滴定终点时溶液温度达最高,滴定终点后,溶液温度又降低,解题时以温度最高点为突破点进行分析作出判断。
4.滴定过程中溶液pH变化曲线
【例7】(2016·全国卷Ⅰ·12)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
( )

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL

D.N点处的溶液pH<12
【答案】D

【备考提示】酸碱中和滴定过程中溶液的pH有个突变范围,解题时常需要用好三个点:利用起点可以判断酸碱的强弱或计算强酸(强碱)的浓度;利用pH=7的点判断溶液中的溶质和所加入标准溶液的体积;利用滴定终点判断完全反应时加入标准液的体积。强酸滴定弱碱时,滴定终点在pH=7的点的下边;强碱滴定弱酸时,滴定终点在pH=7的点的上边;强强滴定时滴定终点一般就选pH=7的点(不考虑指示剂变色范围)。还应注意电荷守恒在比较离子浓度关系中的应用。若涉及pOH曲线,要注意弄清pOH与c(OH-)及pH的关系进行分析判断。
5.滴定过程中组分含量变化曲线

( )

A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D

【备考提示】多元弱酸分步电离且步步减弱,溶液中酸的分子及各种酸根离子的含量变化随着碱的增加呈阶段性改变,要弄准各曲线对应的微粒是什么。解题时用好图象的各个交点会使问题变得简单明了。
五、考查滴定终点的判断、计算、误差分析及迁移应用等综合问题
【例8】(2018·全国卷Ⅱ·28·节选)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定终点的现象是______________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为____________________。


【例9】(2017·天津卷)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1NH4SCN标准溶液,放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.再重复上述操作两次。三次测定数据如下表:

实验序号123消耗NH4SCN标准溶液体积/mL10.2410.029.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有______________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是______________。
(3)滴定应在pH<0.5的条件下进行,其原因是______________________________。
(4)b和c两步操作是否可以颠倒__________,说明理由______________。
(5)所消耗的NH4SCN标准溶液平均体积为________mL,测得c(I-)=________mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为______________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”):
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________;
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
【答案】(1)250 mL容量瓶和胶头滴管 (2)AgNO3见光分解 (3)因滴定时要加入NH4Fe(SO4)2溶液作指示剂,生成的AgSCN沉淀为淡红色,若pH偏大,Fe3+水解生成红褐色氢氧化铁胶体,会影响滴定终点的判断,所以滴定应在pH<0.5的条件下进行 (4)不可以 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点 (5)10.00 0.060 0 (6)用NH4SCN标准溶液进行润洗 (7)偏高 偏高

【备考提示】近几年高考中除考查酸碱中和滴定外,还常考查到氧化还原滴定、沉淀滴定、络合滴定。对于滴定终点的判断关键在于分析滴定终点前溶液的成分及溶液所显示的颜色,达到滴定终点时,标准溶液与指示剂作用显示的颜色。用酸性高锰酸钾溶液作标准溶液滴定时,常常不需要指示剂,达到滴定终点时溶液一般由无色变为浅红色;沉淀滴定或络合滴定都需要用某些试剂与标准溶液反应生成具有特殊颜色的沉淀或配合物显示滴定终点。误差分析务必结合计算式,看所测标准溶液的体积或者有关变量在计算式的分子、分母还是作被减数等进行分析判断。滴定的计算都需要结合化学反应进行计算,涉及多步反应时,需利用原子守恒或电子守恒准确确定有关物质之间的物质的量关系式,再直接根据关系式列式计算。


