“化学动力学”的考量与教学
河北
人教版选修四化学动力学内容设置较为单薄、零碎,以个例实验探究形成的定性结论较多,教师对教材的二次开发较少,不利于建立严谨的化学观念,导致学生将热力学和动力学混为一谈,这是当前化学动力学的教学现状。自2015年以来,全国卷命题注重拓展动力学的考查范围,植入新的内容,使动力学内容考查变得丰满有型,回归本真,理论内涵增强,体现教材在使用过程中的结构调整和内容优化,推动教学实践的变革;这种时代选择和指向,与《课程标准(2017年版)》中的改革理念相匹配,促进学科素养的落实。下面以高考真题为例证,分类说明动力学的概念意义及理论价值,有效指导教师做好高考的针对性复习和命题趋势预测。
一、划分热力学与动力学的界限,从根源上消除二者之间的混淆
当前高中化学人教版选修四先讲授化学反应速率,运用碰撞理论解释影响反应速率的因素;然后,在速率的基础上,根据正反应速率与逆反应速率的大小比较判断反应方向,以及为什么达到平衡状态,根据正、逆反应速率的变化,说明温度、浓度、压强、催化剂等外界条件对化学平衡的影响,按照质量作用定律的形式推导可逆反应的平衡常数。这些是教学过程中习惯使用的推理过程,作为一种解释一般能够得出正确的判断,让很多学生误认为它完全是合理的,但很多事实与此并不完全吻合。例如,“有固体作反应物的可逆反应达到平衡状态后,将固体由块状粉碎为细粒后,正反应速率增大,逆反应速率没有变化,为什么平衡不移动呢?”这个问题之所以不容易回答,关键就是动力学与热力学没有必然的联系,反映出教师和学生长期通过变化过程推断平衡结果的错误思维,认为速率不变导致化学平衡,速率的改变引起了平衡的移动;追本溯源是人教版通过速率变化来建立平衡的教材设计造成的。动力学和热力学研究对象不同,两者虽然相关,但并不互为因果关系,前者关注的是反应的过程,后者只涉及体系的状态,平衡移动取决于Qc与K的相对大小,而正逆反应速率相等只是平衡建立后一种表征。因此,教师在教学过程中可以尝试优化课程结构、调整化学平衡与速率的教学顺序,恰当地划分热力学与动力学的界限,防止速率观对建构限度观形成干扰。
【例1】(2018·全国卷Ⅲ·28·节选)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:


①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有____________________、____________________。

【考情说明】第一,该小题以转化率-时间图象为背景考查化学反应原理,将反应方向和平衡置于反应速率之前,设置方式与目前的教材顺序相反,对于修正先速率后平衡的传统教学顺序带来的认识偏差,具有积极的意义。本题同时考查影响平衡和反应速率的外界条件,影响平衡和速率的因素两者虽有相似之处,但本质截然不同,前者基于物质的宏观性质,归因于QC或K的变化,后者基于微观机理,归因于单位体积活化分子数或活化分子百分数的改变。第二,《考试大纲》要求了解反应速率的定量表示方法,但教材仅局限平均反应速率的定量表达。本题大胆引入大学化学中的速率方程,并不是刻意营造新颖陌生的情景而“难为”学生,而是中学教材内容的一种自然生长,符合高三学生认识水平,满足学生对速率表示法的深层认知的内在需求。
【参考答案】①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3


二、通过实验探究不同组分浓度的改变对化学反应速率的影响,把握浓度对速率影响的真实情况
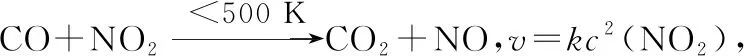
因此,教师需要处理好教材与教学的关系,从“教教材”到“用教材教”的转变,处理好教学资源开发的深度和广度,不能将教材中的个例或通识当成唯一的或绝对的,这就是“通常”背后的秘密。
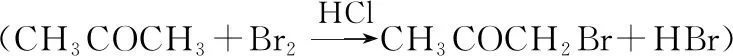

实验序号初始浓度c/mol·L-1CH3COCH3HClBr2溴颜色消失所需的时间t/s①0.800.200.0010290②1.600.200.0010145③0.800.400.0010145④0.800.200.0020580
分析实验数据所得出的结论不正确的是
( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
【参考答案】D
【解题思路】对比①②组数据,c(HCl)和c(Br2)均相同,②中c(CH3COCH3)是①的2倍,溴颜色消失所需的时间①是②的2倍,故反应速率v(Br2)与c(CH3COCH3)成正比,即c∝c(CH3COCH3);同理,由①③两组实验,可得v∝c(HCl);由①④两组实验,c(HCl)和c(CH3COCH3)均相同时,④中c(Br2)是①中的2倍,溴颜色消失所需的时间④也是①中的2倍,说明速率不变,即v∝c0(Br2),综合起来,该反应的化学反应速率可表示为v(Br2)=kc(CH3COCH3)c(HCl)c0(Br2),其中k为速率常数。根据上述数学模型对选项进行正误判断,逻辑关系清晰,答案一目了然,体现出学生的证据推理和模型认知的学科素养水平。

三、以反应历程为背景,强化化学反应机制的认知和分析
在给定的温度条件下,由反应物分子(或离子、原子、自由基等)只经一步生成新产物的反应,称为基元反应。通过实验测定和分析验证,绝大多数反应不是基元反应,而是经过生成中间产物的许多步骤来完成的,每一个步骤都是一个基元反应,这些基元反应代表了反应所经过的途径,动力学上称为反应历程,化学方程式表达的为总反应。而将化学方程式等同于反应的过程是目前中学课堂教学的一种普遍认识和误区,引入总反应与基元反应的视角对于理解化学反应的本质是非常必要的,在课程标准(2017年版)增加了“知道化学反应是有历程的”条目也反映了这一客观需求。


快速平衡


快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
【考情说明】从反应历程出发审视化学反应、反应速率及碰撞理论是全国卷Ⅰ在该年度有关化学反应原理考查的一个亮点。题目展示了一个化学反应的反应机制,启发学生认识到化学反应往往不是一蹴而就,而是分步进行并具有中间产物,计量方程式仅表示反应的宏观总效果,基于这种理解考查学生化学方程式的复合处理技能,以及提取信息、整合信息的能力和分析问题、解决问题的能力,同时能体现出学生的宏观辨识、微观探究以及变化观念、平衡思想的素养水平。
【参考答案】AC
【解题思路】A项,由“近似认为第二步反应不影响第一步的平衡”可知,第二步“慢”不会造成NO2和NO3的快速减少,可认为第一步反应快速平衡后的正、逆反应速率大且不变,因为第二步为慢反应,比第一步反应速率要小,正确;B项,由三个方程式可知,中间产物除了NO3还有NO,错误;C项,有效碰撞是活化分子间取向合适时的碰撞,不可能所有的碰撞都达到这两项要求,正确;D项,活化能越低,反应速率越快,而第三步反应是快反应,说明其活化能较低,错误。
四、了解反应活化能的物理意义,明确活化能是决定反应速率大小的主要因素之一
活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的最小能量,在微观上就是断裂反应物的化学键所需要的能量。活化能大小是影响化学反应速率的主要因素,反应的活化能越低,则在指定温度下活化分子百分数越多,反应就越快;相反,活化能越高,反应就越慢。加入催化剂后,活化能将会显著降低,与量子力学中的隧道效应结合起来时,活化能基本类似于隧道的高度。不过,活化能有基元反应活化能和总反应表观活化能之分。活化能仅对基元反应有明确的物理意义,即活化分子的平均能量与全部反应物分子平均能量之差。在复杂反应中它只是各基元反应活化能的综合表现,其数值是各基元反应的活化能经数学处理而得到的,称为该总反应的表观活化能。将总反应当作基元反应看待,将总反应的活化能看作活化分子与反应物分子的能量差值,是中学教学中的认识误区。所以《课程标准(2017年版)》修订为“认识基元反应活化能对化学反应速率的影响”,这种描述更为准确,便于学生消除理论认识上的困惑。
【例4】(2016·全国卷Ⅲ·27·节选)煤燃烧排放的烟气SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如表。
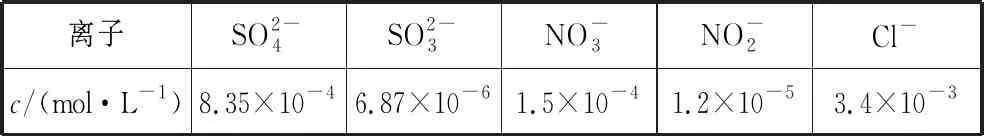
离子SO2-4SO2-3NO-3NO-2Cl-c/(mol·L-1)8.35×10-46.87×10-61.5×10-41.2×10-53.4×10-3
【考情说明】影响反应速率的外界因素在教材中的篇幅较长,启发学生建立条件控制反应速率的思想,而本题考查不同反应的速率大小判断,取决于反应的本身性质,意在引导学生比较速率大小时不仅关注影响化学反应速率的外在条件,更要关注化学反应的活化能这一内因,谨防内因与外因的混淆。
【参考答案】大于 NO溶解度较低或脱硝反应活化能较高

五、关注识催化剂的选择性,圆催化剂的完美形象
在义务教育阶段学习化学时,学生已对催化剂加快反应速率的高效性把握得较好,形成一种化学观念根植于心。但对催化剂的选择性,人教版必修二只是一笔带过,选修四也只在注释里“点”了一下,因此,催化剂选择性在定向化学反应中的重要作用在课堂教学时往往被忽视。当化学反应在热力学上可能有几个反应方向时,一种催化剂在一定条件下只对其中的一个反应起加速作用,这就是催化剂的选择性,选择不同的催化剂可控制或改变化学反应的方向。



两个反应在热力学上趋势均很大,其原因是______________;
有利于提高丙烯腈平衡产率的反应条件是______________;
提高丙烯腈反应选择性的关键因素是______________。
【考情说明】本题以丙烯腈的制备为背景,展示了平衡移动原理、催化剂作用原理在合成工业上的应用价值,有利于深化学生的科学态度、社会责任素养认知,考查学生变化观念和平衡思想素养水平。本题问题设置较全面,第一空从热力学焓变特点考查化学反应进行的方向,第二空从提高反应限度角度考查平衡移动原理的应用,第三空则转向催化剂在提高目的产物上的专一提速作用,体现“方向、限度和速率”三位一体的完美布局,契合化学工业生产的实际,有利于学生建立有机物工业制备思维模型。
【参考答案】两个反应均为放热量大的反应 降低温度、降低压强 催化剂
【解题思路】从方程式上看两个反应均为放热量大的反应,所以热力学趋势大;因①为气体体积增大的放热反应,所以降低温度、降低压强有利于提高丙烯腈的平衡产率;催化剂可以选择提高所需要的反应的速率,因此,提高丙烯腈反应选择性的关键因素是使用合适的催化剂。
【反思提升】同样的反应物可能存在多个平行反应时,如果选择某种催化剂,则可专一地提高所需要的反应的速率。选择性和高效性是催化剂的两个方面,研制和寻找优良的催化剂专一而又高效地改变目标反应的速率是化学工作者的不懈追求。


