数形结合解决水溶液中的离子平衡图象问题
云南
电解质水溶液中的离子平衡问题,是学生学习的难点,更是高考热点中的难点。多年以来全国高考化学试卷几乎年年涉及。题型考查的知识点多,灵活性、综合性较强,有较好的区分度,能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。
水溶液中的离子平衡图象这类题型常见的考点有:①强弱电解质的比较;②勒夏特列原理在“三大平衡”中的应用;③水的离子积常数、电离常数的应用与计算;④溶液酸碱性的判断;⑤pH的简单计算与应用(包括pH的变化规律、pH的大小比较);⑥微观粒子数的大小比较与计算(三大守恒的应用);⑦溶度积常数的计算与应用等。
解决此类题常用三步法,进行数形结合,可轻松解答。
第一步——识图象:看清横坐标轴和纵坐标轴的含义,弄清曲线上的点(起点、交点、拐点、终点)、线(曲线)表达的意义。
第二步——思原理:根据信息明确涉及哪些反应原理,并与相关数据结合起来。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,质量守恒、电子守恒等来求解。
第三步——巧结合:将图象与原理结合起来思考,找准切入点,分析并解决问题。
这类题型较常见的有以下几种类型:
一、题中直接给出曲线所对应的粒子
【例1】(2018·全国卷Ⅲ·12)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动

【答案】C
【点拨】本题应该从题目所给的图象入手,寻找特定数据判断题目中的沉淀滴定的具体过程,依溶度积定义及滴定终点数据分析图象是解答本题的关键。(1)识图象:横坐标是加入硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。c点在曲线上,是滴定终点;b、c点横坐标相同,a、c点纵坐标相同。(2)思原理:沉淀滴定、Ksp的计算、卤化银的溶解性、图象分析、对数函数等。(3)巧结合:根据图象变化与相关原理分析,本题虽然选择学生不太熟悉的滴定过程——沉淀滴定,但其内在原理实际和酸碱中和滴定是一样的,即理论终点都应该是恰好反应的点,这样就能判断溶液发生改变的时候,滴定终点如何变化了。
【解析】A.用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液,达到滴定终点时消耗AgNO3溶液25.0 mL,此点对应的纵坐标值-lg(Cl-)约等于5,即:c(Cl-)≈10-5mol·L-1,而此时:c(Cl-)=c(Ag+),Ksp(AgCl)=c(Cl-)·c(Ag+)≈10-10,A正确;
B.由于Ksp(AgCl)极小,所以向溶液滴加硝酸银就会有沉淀析出,形成氯化银的饱和溶液,所以曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl),B正确;
C.达到滴定终点时,一定有n(Cl-)=n(Ag+),故将50 mL 0.05 mol·L-1的Cl-溶液改为50 mL 0.04 mol·L-1的Cl-溶液后,达到滴定终点需要加入硝酸银的量也是原来的0.8倍,因此应该由c点的25 mL变为25×0.8=20 mL,而a点对应的是15 mL,C错误;
D.卤化银从氟化银到碘化银的溶解度逐渐减小,Ksp(AgCl)大于Ksp(AgBr),将50 mL 0.05 mol·L-1的Cl-溶液改为50 mL 0.05 mol·L-1的Br-溶液,达到滴定终点时,一定有n(Br-)=n(Ag+),所以滴定终点的横坐标不变,但是因为溴化银更难溶,所以终点时,c(Br-)应该比原终点时c(Cl-)更小,反应终点从曲线上的c点向b点方向移动,D正确。

( )

A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
【点拨】(1)识图象:横坐标是pH,纵坐标是各粒子的物质的量分数δ(X),pH=1.2时δ(H2A)=δ(HA-),pH=2.7时δ(H2A)=δ(A2-),pH=4.2时δ(HA-)=δ(A2-);随pH增大,δ(H2A)逐渐减小,δ(HA-)先增大后减小,δ(A2-)逐渐增大。(2)思原理:弱电解质的电离、对数函数、电离平衡常数的计算等。(3)巧结合:该题综合性强,该题解答时注意利用守恒的思想解决问题,结合电离平衡常数以及题给相关数据,根据纵坐标比较各粒子浓度大小。

二、需要判断各曲线所对应的粒子
【例3】(2017·全国卷Ⅰ·13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
( )
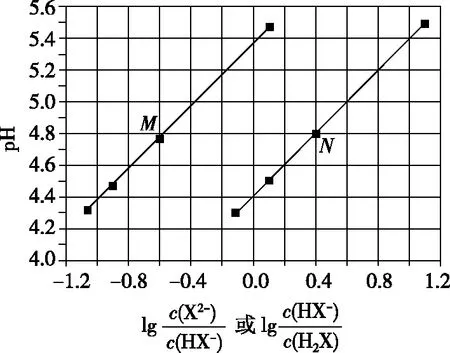
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】D


三、有两种图象
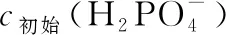
( )
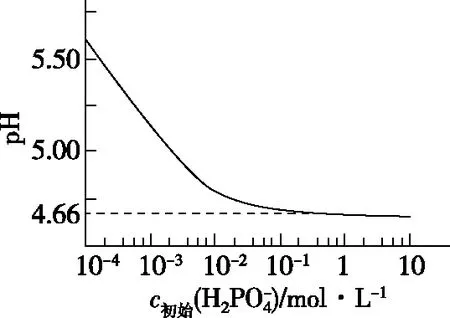
图1

图2
A.溶液中存在3个平衡
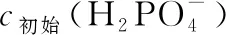
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
【答案】D