原子轨道杂化类型判断的思维模式探析
山东
在凸显核心素养观念的命题指导下,使得化学试题更加注重对模型认知的构建能力、性质与结构之间相互推理能力的考查。由于中学阶段的结构知识有限,使得对物质结构与性质模块的知识考查难度不大,经常涉及中心原子的杂化及空间构型判断问题上,因而教师在教学中除了注意知识深广度及难度外,更应给学生渗透解答此类问题的认知模型与思维模型。
1.依据微粒的空间构型

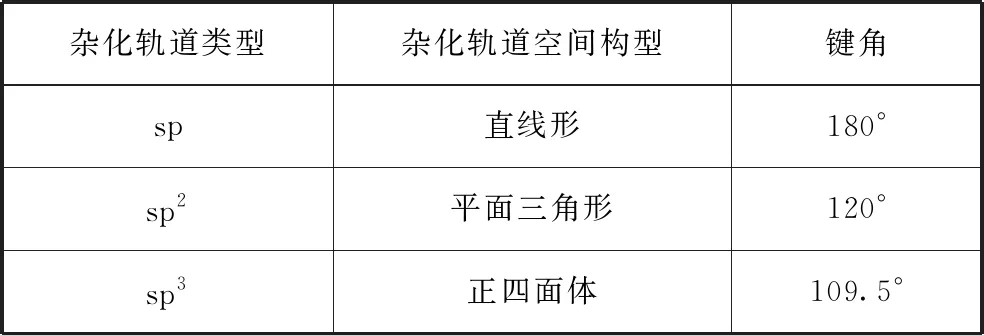
杂化轨道类型杂化轨道空间构型键角sp直线形180°sp2平面三角形120°sp3正四面体109.5°

由此还可以扩展到以共价键形成的晶体或特殊结构单元。如金刚石中的碳原子、晶体硅和石英中的硅原子,都是以正四面体形式与周围4个原子形成共价键的,故碳、硅原子采用sp3杂化;石墨的二维结构平面内,每个碳原子与其他三个碳原子结合形成平面六元环层,键角为120°,碳原子采用sp2杂化。
【例1】(1)(2018·全国卷Ⅱ·改编)固体三氧化硫中存在如图(a)所示的三聚分子,该分子中S原子的杂化轨道类型为________。

图(a)
(2)(2016·全国卷Ⅰ·改编)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为________,微粒之间存在的作用力是____________________。
【答案】(1)sp3(2)sp3共价键
【解析】(1)根据图(a)可以得出固体三氧化硫中存在SO4原子团,为四面体构型,因此硫原子的杂化轨道类型为sp3。(2)Ge单晶具有金刚石型结构,故锗原子与金刚石中的碳原子杂化方式相同,即为sp3,微粒之间存在的作用力是共价键。
2.运用价层电子对互斥理论
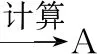

中心原子价电子对数价电子对几何分布中心原子杂化轨道类型2直线形sp3平面三角形sp24正四面体sp3
中心原子的价电子对数计算有两种方法:
第1种:价电子对数(n)=[中心原子(A)的价电子数+配位原子(B)提供的价电子数×m]÷2,当n出现奇数时则按照“四舍五入”处理。中心原子(A)为主族元素时,其价电子数=最外层电子数。配位原子(B)为卤族、氢原子时则仅提供1个价电子。为氧族元素原子时则按不提供电子;在计算复杂离子价电子对数时,还应加上负离子的电荷数或减去正离子的电荷数。
第2种:价电子对数(n)=σ键数+中心原子上的孤电子对数。σ键数就是配位原子数m,孤电子对数=[中心原子的价电子数-m个配位原子(B)最多能接受的电子数]÷2。若B为氢时则接受电子数为1,若为其他原子时则接受电子数为(8-该原子的价电子数)。
注意:中心原子的价电子对构型与其对应的分子或复杂离子的空间构型不是同一个概念,价电子对构型中的轨道由成键电子对与孤对电子共同占有,而分子或复杂离子的空间构型则是所有成键原子之间构成的形状,只有孤电子对数为0时,二者的构型才完全相同。
【例2】(1)(2018·全国卷Ⅰ·改编)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为______________。
(2)(2018·全国卷Ⅱ·改编)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________________。气态三氧化硫以单分子形式存在,其分子的立体构型为________。
(3)(2018·全国卷Ⅲ·改编)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为________。

【答案】(1)正四面体 sp3(2)H2S 平面三角形 (3)平面三角形 sp3(4)V形 sp3
3.根据中心原子成键类型
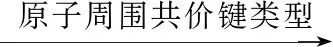
【例3】(1)(2017·全国卷Ⅱ·改编)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。从结构角度分析,R中两种阳离子的相同之处为________,不同之处为________。(填标号)
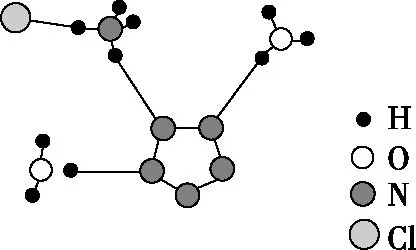
图(b)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
(2)(2017·全国卷Ⅲ·改编)CO2和CH3OH分子中C原子的杂化形式分别为________和________。
(3)(2016·全国卷Ⅱ·改编)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。①[Ni(NH3)6]SO4中阴离子的立体构型是________。②氨是________(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为________。
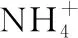

4.根据等电子原理

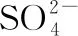
【例4】(1)(2015·全国卷Ⅰ·改编)CS2分子中,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子:________。
(2)科学家常用等电子体来预测不同物质的结构。据此原理,请你在表中①②③处填写相应的化学式及其中心原子的杂化轨道类型。

N2O②CO2-3④①N2H2+6③PH+4



