堆型艾美耳球虫ATP酶基因的生物信息学分析及原核表达
阎晓菲 ,孔 苗 ,韩红玉 ,董 辉 ,黄 兵
(1.新疆农业大学科学技术学院, 乌鲁木齐830052; 2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室, 上海 200241)
鸡球虫病是一种或数种艾美耳球虫寄生于鸡消化道上皮细胞而引起的一种原虫寄生虫病。在集约化养鸡场中发病率达50%~70%,甚至80%以上,死亡率20%~30%。全世界每年因鸡球虫病造成的经济损失达30亿英镑。我国每年花费约20亿人民币进行预防,其中并不包括由鸡球虫病的隐性感染造成的间接损失[1-2]。堆型艾美耳球虫(Eimeria acervulina)有较强致病性,寄生于十二指肠和空肠,在集约化养鸡场中流行率最高,对养鸡业的危害仅次于柔嫩艾美耳球虫(E. tenella)[3]。目前防治球虫病主要依赖于抗球虫药物和活卵囊疫苗,但随着球虫耐药性不断产生,药物预防己经不能很好的防治球虫病。活卵囊疫苗虽然已经在国内外上市,但由于免疫效果和安全性问题,并未得到广泛推广使用[4],因此必须采取新的措施防治鸡球虫病。应用现代生物技术构建的基因工程疫苗已被证实可以诱导宿主产生长期的体液免疫和细胞免疫[5],因此安全有效的基因工程疫苗的研制及应用将逐渐成为防治鸡球虫病的主要手段。
生物细胞内的离子转运ATP酶除参与主动转运和ATP合成基本过程外,在细胞能动性和生长发育、受体再循环、蛋白质选择等方面也有重要作用[6]。多种生物的ATP酶相关基因克隆、表达及功能研究均有报道,如微生物炭疽菌[7]和耐氟菌[8],动物三疣梭子蟹[9]和小地老虎[10],植物小麦[11]和向日葵[12]。柔嫩艾美耳球虫ATP酶结构域的相关EST序列已有报道[13],研究人员通过不同分离株的ATP酶基因遗传多态性来分析抗球虫药的耐药性[14]。本研究所获得的堆型艾美耳球虫基因经Blast分析,与阳离子转运的ATP酶同源,命名为堆型艾美耳球虫Na+-K+-ATP酶(E. acervulinaNa+-K+-ATPase,EaNKA)[15],对其进行克隆与表达,为今后进一步研究该基因的功能及筛选基因工程疫苗候选分子奠定基础。
1 材料和方法
1.1 材料
1.1.1 质粒、菌种及主要试剂 堆型艾美耳球虫孢子化卵囊cDNA文库[16]由中国农业科学院上海兽医研究所保存提供;pET32a(+)原核表达载体和大肠杆菌DH5α、BL21(DE3)感受态细胞为新疆农业大学科学技术学院生物科学系实验室保存;限制性核酸内切酶BamHⅠ、Hind Ⅲ和T4DNA连接酶购自赛默飞世尔科技(中国)有限公司;T-载体PCR产物克隆试剂盒、HRP标记羊抗鼠IgG购自北京鼎国昌盛生物技术有限责任公司;2×TaqPCR Master MIX、DNA产物纯化回收试剂盒、质粒小提试剂盒、DNA/蛋白质Marker、增强型HRP-DAB底物显色试剂盒购自北京天根生化科技有限公司。
1.1.2 引物设计与合成 根据堆型艾美耳球虫基因序列[17](GenBank登录号:EU590120.1),利用Primer Primier5.0软件设计1对扩增Na+-K+-ATP酶基因的特异性引物,并在上、下游引物5'端分别引入BamHⅠ和Hind Ⅲ酶切位点(下划线)和相应的保护性碱基。预计扩增目的片段约708 bp,上游引物:5'-CG CGGATCCATGTACGCCCAAGAAGAAGC-3',下游引物5'-CCCAAGCTTTCAATAACGAAGCAGA GAG-3',由生工生物工程上海(股份)有限公司合成。
1.2 方法
1.2.1EaNKA基因的克隆与测序 以堆型艾美耳球虫孢子化卵囊cDNA文库为模板,进行PCR扩增。PCR反应体系为40 μL:2×Taq PCR Master MIX 20 μL,cDNA文库 10 μL,ddH2O 8 μL,上下游引物各1 μL。PCR反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,共35个循环;最后72℃延伸10 min。1%琼脂糖凝胶电泳观察结果。回收产物按照T-载体PCR产物克隆试剂盒的说明进行连接。连接体系为10 μL:ddH2O 4.5 μL、目的DNA片段1.5 μL、pUCM-T 1 μL、10×Ligation Buffer 1 μL、50% PEG 4000 1 μL、T4DNA ligase 1 μL。混匀后4℃连接过夜,连接产物转化至大肠杆菌DH5α感受态细胞。挑取单克隆后扩大培养,经PCR鉴定正确后送生工生物工程上海(股份)有限公司测序。
1.2.2EaNKA基因的生物信息学分析 利用NCBI的在线软件ORF finder分析获得的新基因全长cDNA序列,找出ORF;利用ProtParam工具(http://cn.expasy.org /tools/protparam.html)分析编码蛋白质的基本理化性质;利用protscale(https://web.expasy.org/protscale/)分析氨基酸序列的亲疏水性;利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和SOPMA分析编码蛋白质二级结构;利用SingalP在线工具(http://www.cbs.dtu.dk/services/SignalP/)分析编码蛋白有无信号肽;利用TMH服务器(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析编码蛋白有无跨膜结构;利用SWISS-MODEL(https://swissmodel.expasy.org/)分析编码蛋白质三级结构;利用PSORTⅡ(http://posrt.nibb.ac.jp/)分析亚细胞定位;利用北京大学生物信息学中心WebLab的Antigenic(http://weblab.cbi.pku.edu.cn/)程序分析其抗原位点;利用motif_scan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)分析功能结构域;利用Blast进行序列比对。
1.2.3 原核表达重组质粒pET32a(+)-EaNKA的构建与鉴定 利用BamHⅠ和HindⅢ对克隆质粒TEaNKA和空载体pET32a(+)分别进行双酶切,连接目的基因与空载体胶回收酶切产物,构建重组质粒pET32a(+)-EaNKA,连接体系为10 μL:dd H2O 3 μL、目的基因回收产物3 μL、10×Buffer 2 μL、pET32a(+)回收产物1 μL、T4DNA ligase 1 μL。4℃连接过夜,转化至大肠杆菌DH5α感受态细胞,挑取阳性克隆至LB培养基中培养12 h后,进行PCR鉴定。对鉴定为阳性的菌液提取质粒并用BamHⅠ和Hind Ⅲ限制性内切酶进行双酶切鉴定,阳性克隆送生工生物工程上海(股份)有限公司测序,并转化至大肠杆菌BL21(DE3)感受态细胞。
1.2.4 重组质粒pET32a(+)-EaNKA的原核表达及重组蛋白的Western blot分析 将过夜培养的阳性菌液转接震荡培养至OD600值为0.6~1.0,加IPTG至终浓度为0.9 mmoL/L,并分别在2、4、6、8 h取出500 μL培养物。培养物于室温、1000×g离心30 s,弃上清,沉淀中加入50 μL 1×loading buffer,混匀后100℃水浴煮10 min,SDS-PAGE检测分析。常规SDS-PAGE后,将凝胶中的蛋白转印至PVDF膜上,5%脱脂牛奶4℃封闭过夜;以大肠杆菌裂解液预吸收的兔抗堆型艾美耳球虫孢子化卵囊抗血清(1∶500)为一抗,辣根过氧化物酶(HRP)标记羊抗鼠IgG(1∶5000)为二抗进行Western blot检测;最后用DAB试剂盒显色。
2 结果与讨论
2.1 EaNKA基因的克隆与鉴定以堆型艾美耳球虫孢子化卵囊 cDNA 文库为模板,利用合成的引物PCR扩增EaNKA基因ORF片段,经1%琼脂糖凝胶电泳分析,在708 bp 处有一特异性的条带,与目的片段大小一致(图1)。将其回收后与pUCM-T载体连接,转化大肠杆菌DH5α感受态细胞,经菌液PCR、双酶切、测序鉴定正确,表明成功扩增获得EaNKA基因含ORF的cDNA片段。
2.2 EaNKA基因的生物信息学分析根据EU590120基因序列的ORF设计引物扩增获得EaNKA基因。测序拼接后,该基因全长1157 bp,ORF位于81-788 bp之间,长708 bp,编码236个氨基酸(图2)。EU590120.1基因全长754 bp,ORF位于17~508 bp之间,长492 bp,编码163个氨基酸。两基因序列同源性99%,EaNKA基因序列全长及ORF片段均长于EU590120.1基因序列。虽然EaNKA基因的ORF片段比EU590120.1基因的ORF片段多216 bp,但多出的碱基没有造成之前氨基酸的改变。这可能是由于该基因在转录后的剪切过程中存在多种形式[18],因可变剪接形成了不同的转录本,推测可能是属于多基因家族[19]。
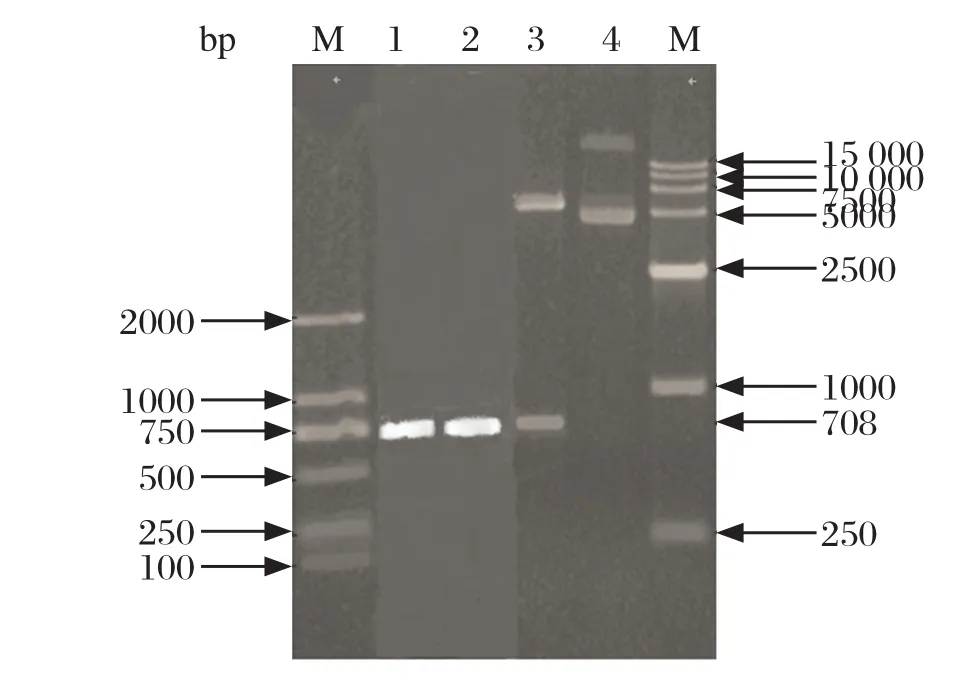
图1 EaNKA基因的PCR扩增及重组质粒的双酶切鉴定Fig.1 PCR result of EaNKA gene and analysis of the recombinant plasmids with restriction endonucleases digestion
生物信息学分析显示EaNKA基因编码蛋白理论分子量为25.43 kDa,理论等电点为7.58,酸性氨基酸总数(Asp+Glu)18个,碱性氨基酸总数(Arg+Lys)19个,氨基酸组成较多的有Ala(A)14.0%,Leu (L)9.3%,Ser(S)8.9%,Val(V)8.1%,分子式为C1125H1796N306O324S20,总平均亲水性(GRAVY)0.358,半衰期30 h,不稳定指数42.81,高于域值40,在溶液中性质不稳定,脂肪族指数96.82。在该基因编码的氨基酸中,亲水性氨基酸分布少于疏水性氨基酸,根据氨基酸分值越低亲水性越强和分值越高疏水性越强的规律[20],推测该蛋白为疏水性蛋白。信号肽预测分析,S平均值<0.5,由此推断该蛋白不存在信号肽,不属于分泌蛋白[21],表明该蛋白可以高效表达[22]。跨膜结构分析表明,该蛋白具有2个跨膜结构,91~113氨基酸和128~150氨基酸位于跨膜区。疏水性分析显示最大值为3.078,最小值为-1.867,在18-35,49-61,91-113,131-148位之间有很强的疏水性。
抗原位点分析(表1),主要的抗原表位区有7个,为N端13-41、91-115、122-150、48-75、163-176、189-203、77-82位点,推测该蛋白具有良好的免疫原性,可能是很好的药物靶标[23]。功能结构域分析显示(图2),该蛋白序列有1个N-糖基化位点,3个酪蛋白激酶II磷酸化位点,4个N-肉豆蔻酰化位点,2个蛋白激酶C磷酸化位点,1个酪氨酸激酶磷酸化位点,1个FMRF amide相关肽家族位点。其中N端糖基化位点与抗原性和免疫原性有关,蛋白激酶C磷酸化位点与介导胞外分泌有关,酪蛋白激酶Ⅱ磷酸化作用位点与细胞凋亡和细胞周期的调节有关,N端豆蔻酰基化位点可能与蛋白质定位于内质网或线粒体外膜有关,许多跨膜蛋白受体都具有蛋白激酶C磷酸化位点和酪蛋白激酶Ⅱ磷酸化位点[24]。酪氨酸激酶磷酸化位点可能有助于氧化应激介导的激活[25],FMRF amide相关肽家族位点可能是一类新型离子受体[26]。PSIPRED分析二级结构(图3)共有10个α螺旋,1个β折叠,PSIPRED分析二级结构[27](图3),112个氨基酸构成α-螺旋,占47.46%,48个氨基酸构成延伸链,占20.34%,19个氨基酸构成β-转角,占8.05%,57个氨基酸构成无规则卷曲,占24.15%。

图2 EaNKA基因的核苷酸序列及其氨基酸序列和结构功能域分析Fig.2 Nucleotide、predicted amino acid sequences and analysis of the functional motifs of EaNKA gene

表1 EaNKA编码蛋白的抗原肽位点分析Table1 Analysis of the antigenic peptides of EaNKA protein
利用swiss-model进行蛋白高级结构建模,与蛋白三级结构预测结果一致(图4)。二、三级结主。无规则卷曲是蛋白质肽链中构成配体/受体结合的活性部位,易受侧链相互影响而改变空间构象[28],从而影响蛋白质的功能。亚细胞定位分析显示在内质网、高尔基体、质膜、线粒体、液泡中分别占55.6%、11.1%、11.1%、11.1%、11.1%,因此推测该基因编码蛋白可能是内质网的跨膜蛋白受体。朱笠[29]研究发现早发型肌张力障碍相关蛋白质torsinA是一种新型的内质网ATP酶,在内质网腔内可能起到类似分子伴侣的作用,帮助一些分泌型蛋白质的成熟和分泌,或参与细胞应激反应。Blast分析显示该基因编码的氨基酸与堆型艾美耳球虫阳离子转运ATP酶相关蛋白序列(XP013248919、ACB97673)的相似性最高为100%;与巨型构为混合型蛋白,主要以无规则卷曲和延伸链为艾美耳球虫阳离子转运AT P酶相关蛋白序列(XP013337038)的相似性为86%;与柔嫩艾美耳球虫阳离子转运ATP酶相关蛋白序列(APY19976)的相似性为87%,因此命名该基因为堆型艾美耳球虫阳离子转运ATP酶(Eimeria acervulinaNa+-K+-ATPase,EaNKA)。
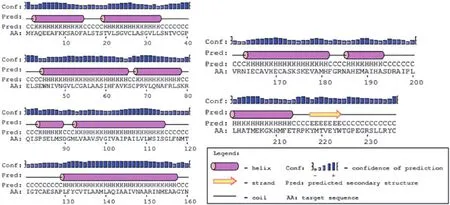
图3 EaNKA基因编码蛋白的二级结构预测Fig.3 Analysis of the secondary structure about the EaNKA protein
ATP酶是一种起源于同一个祖先和存在于所有生物体内的酶系统,与离子电化学梯度之间的能量交换是生命活动的基本特征[30],普遍存在于细胞组织及细胞器膜上[31],是机体中离子调控的重要蛋白酶,通过建立离子跨膜电化学梯度并催化ATP水解成ADP而释放能量,为各种离子的转运提供最终的驱动力[32]。Na+-K+-ATP酶活性降低可引起细胞的离子跨膜转运障碍,能量代谢和物质代谢紊乱,以及胞浆内Ca+的积聚,导致细胞形态结构和功能的异常,甚至细胞凋亡[33]。研究表明莫能霉素可以影响柔嫩艾美耳球虫,从而在胞外杀死球虫[34]跨膜钠离子作为载体的能力,降低了ATP酶的浓度[34]。通过改变柔嫩艾美耳球虫细胞膜上的Na+-K+-ATP酶活性,可以降低莫能霉素的敏感性[35]。通过流式细胞术结合电镜和荧光免疫技术,研究青蒿素对柔嫩艾美耳球虫配子体的效果,发现青蒿素通过抑制大配子体的肌质内质网Ca+-ATP酶(SERCA),从而影响卵囊壁和孢子体形成[36]。以上研究表明,Na+-K+-ATP酶和Ca+-ATP 酶活性改变,可成为判定生物体生理功能改变的重要指标。
2.3 重组质粒pET32a(+)-EaNKA的构建利用BamHⅠ和Hind Ⅲ对鉴定正确的重组克隆质粒pUCM-T-EaNKA和空载体pET32a(+)分别进行双酶切,胶回收纯化后连接,构建原核重组表达质粒pET32a(+)-EaNKA。对重组表达质粒进行PCR和双酶切鉴定,结果显示均为阳性,测序结果显示重组表达质粒pET32a(+)-EaNKA构建成功(图1)。
2.4 重组蛋白His-EaNKA的原核表达及Western blot分析重组质粒pET32a(+)-EaNKA和空质粒pET32a(+)转化大肠杆菌BL21(DE3)后,经0.9 mmol/L IPTG 诱导表达。SDS-PAGE结果表明重组质粒pET32a(+)-EaNKA表达的重组蛋白分子量约为45 kDa左右,与目的蛋白分子量一致(图5)。Western blot显示,大肠杆菌裂解液预吸收的兔抗堆型艾美耳球虫孢子化卵囊抗血清,能特异性识别重组蛋白,在45 kDa处出现1条明显的条带,空质粒对照组无明显条带(图6),表明该基因可以在原核表达系统中成功表达。
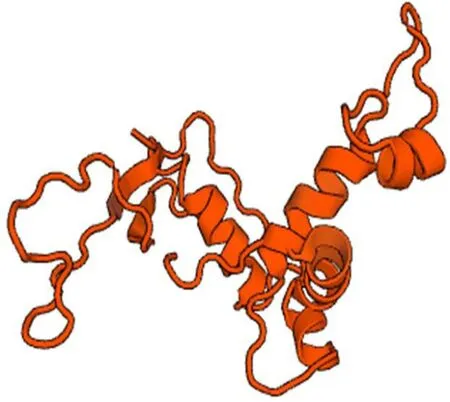
图4 EaNKA基因编码蛋白的三级结构Fig.4 Analysis of the tertiary structure about the EaNKA protein
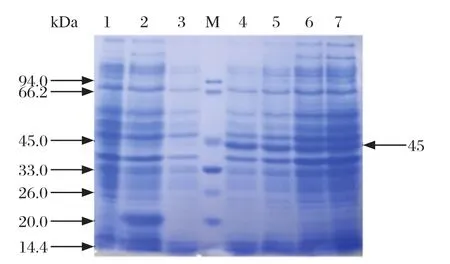
图5 重组质粒不同时相表达蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the expression products of recombinant plasmids
目前已筛选出一些可用于鸡球虫基因工程疫苗研制的候选基因,如柔嫩艾美耳球虫GX3262基因[37]、白细胞介素2(cSZ-2)基因[38]、MZ5-7基因[39],这些基因构建的DNA疫苗免疫鸡后能够有效减轻病变特征,增强宿主免疫力。Zhao等[40]对堆型艾美耳球虫3-1E基因进行克隆表达,Western blot分析表明重组蛋白可以与His-Tag(2A8)小鼠mAb特异性反应,获得了具有良好生物活性的蛋白,为开发核酸疫苗奠定基础。研究人员克隆堆型艾美耳球虫巨噬细胞移动抑制因子,构建DNA疫苗,检测目的基因的体内转染情况,得到有效表达,并能显著减轻感染鸡体重降低和十二指肠损伤[41]。对堆型艾美耳球虫乳酸脱氢酶(LDH)或LDH与鸡IL-2或IFN-γ组合的DNA疫苗进行了评估,证明携带LDH抗原基因的DNA疫苗可诱导同源感染的保护性免疫,其作用可通过鸡IL-2或IFN-γ的共表达得到增强[42]。Zhu等[43]以堆型艾美耳球虫子孢子cDNA克隆cSZ-JN2基因,构建的重组蛋白疫苗能显著提高免疫雏鸡的平均体重增长率,降低平均病变比例和卵囊产量,且抗球虫指数大于165。丛培君[44]构建了鸡堆型艾美耳球虫乳酸脱氢酶增强型核酸疫苗,并进行免疫保护研究,为探讨开发研制新型免疫增强型抗球虫核酸疫苗提供了理论基础。黄艺华[45]构建了鸡堆型艾美耳球虫Rhomboid增强型核酸疫苗,为研制抗球虫病疫苗提供了理论和物质基础。本研究克隆获得的EaNKA基因蛋白与阴离子转运ATP酶相关,具有多个抗原位点,并能够与堆型艾美耳球虫抗血清特异性结合,具有一定的反应原性,为筛选疫苗候选分子提供了科学依据。
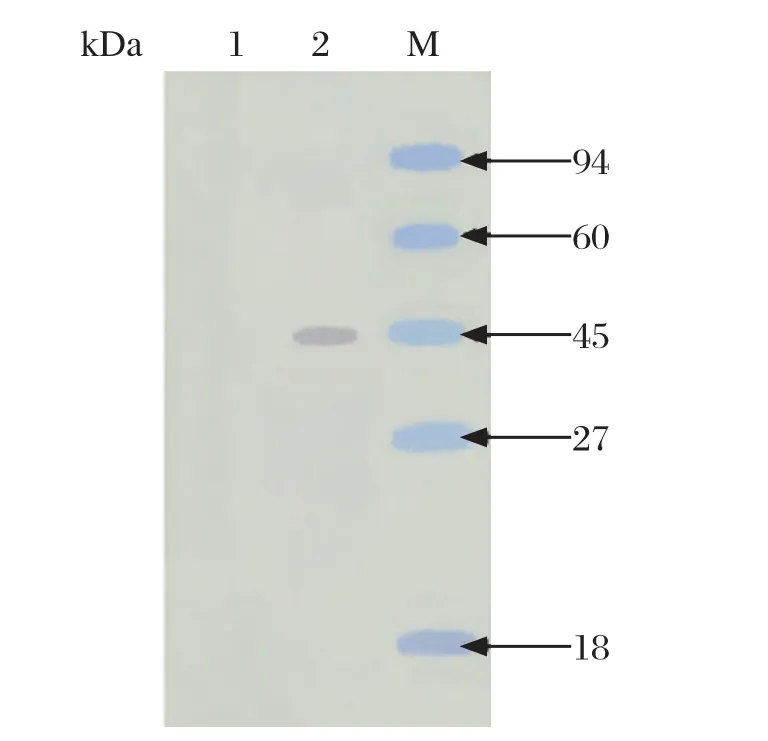
图6 重组蛋白的Western blot分析Fig.6 Western blot analysis of recombinant proteins
——一道江苏高考题的奥秘解读和拓展

