猪繁殖与呼吸综合征病毒感染肺泡巨噬细胞后差异表达膜蛋白的鉴定与分析
张玉娇,高 飞,2,曲泽慧,姜一峰,2,周艳君,虞凌雪,李丽薇,赵 款,童光志,2
(1.中国农业科学院上海兽医研究所,上海 200241,2. 扬州大学 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)俗称蓝耳病,是一种严重影响养猪业发展的接触性传染病。1987年美国首次报道PRRS后[1],德国、英国、荷兰、西班牙等欧洲国家相继报道了该病的发生。目前,PRRS几乎在所有养猪国家中广泛流行。PRRS的病原为猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)。荷兰学者首次分离到欧洲型PRRSV代表毒株Lelysted[2-3]。北美学者相继分离到北美型PRRSV代表毒株ATCCVR2332[4],中国在1996年首次分离到PRRSV[5]。2006年,中国大面积爆发高致病性PRRS(highlypathogenic PRRS,HP-PRRS),其发病率及死亡率与经典PRRS相比均显著升高,给我国养猪业造成了巨大损失[6]。
PRRSV属于套式病毒目、动脉炎病毒科、动脉炎病毒属[7]。基因组为单股正链RNA,全长约15 kb,5'端有帽子结构,3'端有poly(A)尾[8],至少含有10个开放阅读框[9]。PRRSV具有严格的细胞嗜性,肺泡巨噬细胞(pulmonary alveolar macrophage,PAM)为其天然靶细胞。本团队在前期研究中利用遗传背景清晰的HP-PRRSV毒株HuN4及其体外传代致弱毒株HuN4-F112分别感染PAM,发现只有部分PAM可以被PRRSV感染,且强毒感染PAM的效率显著高于弱毒,但导致这种差异的机制尚不明确,推测感染PAM的能力可能与病毒的致病力有关。PRRSV可通过受体调节的内吞作用进入细胞[10],而细胞表面存在差异表达的受体或相关的膜蛋白可能会影响PRRSV强弱毒的感染效率,从而导致强弱毒在致病性方面出现差异。
本研究利用EGFP标记的PRRSV强弱毒株分别感染PAM,通过FITC通道筛选感染及未感染PRRSV的PAM,分别提取感染及未感染的PAM膜蛋白,分析鉴定PRRSV强弱毒株感染后PAM差异表达的膜蛋白,从而深入了解PRRSV感染致病的分子机理。
1 材料和方法
1.1 病毒和细胞HP-PRRSV强毒株HuN4[11]和PRRSV弱毒株HuN4-F112由猪病毒性繁殖障碍综合症团队实验室(本实验室)保存[12];带有EGFP基因的重组PRRSV毒株rHuN4-EGFP和rHuN4-F112-EGFP由本实验室构建与保存[13];PAM取自15日龄PRRSV阴性猪肺泡灌洗液。
1.2 主要试剂抗PRRSV N蛋白多抗为本实验室制备[14];ProteoExtract Transmembrane Protein Extraction Kit购自上海拜力生物科技有限公司。
1.3 主要仪器Easy-nLC 1000液相色谱仪购自Thermo Finnigan公司;Q Exactive质谱仪购自Thermo Fisher Scientific公司;FACSARIA III分选流式细胞仪购自BD公司;Eppendorf Mastercycler realplex荧光定量PCR仪购自Eppendorf公司。
1.4 PAM的分离和培养采用肺泡灌洗法获得PAM。用4℃预冷的无菌PBS(含100 μg /mL青霉素和100 μg /mL链霉素)灌洗肺脏,轻轻按摩肺叶后将肺泡灌洗液吸出,重复上述操作,直至肺脏呈透明状。收集所有的肺泡灌洗液,4℃、500×g离心10 min 获得细胞,PBS 洗涤2 次后,用10% FBS的RPMI-1640重悬细胞,进行细胞计数。以1×106个/mL的细胞密度接种到细胞培养板内,在37℃、5%CO2培养箱中培养12 h,更换新培养液,获得能够贴壁的PAM。
1.5 流式细胞术分选PAM将贴壁培养的PAM用0.25%胰酶消化5 min,500×g离心10 min后,收获细胞,PBS清洗2次,再用含EDTA的MACS(流式细胞仪分选与磁珠分选)缓冲液重悬。用40 μm滤网去除粘连细胞,将PAM收集于流式管中。通过FITC通道检测荧光信号,分选感染与未感染PRRSV的PAM。
1.6 膜蛋白样品的制备按照ProteoExtract Transmembrane Protein Extraction Kit说明书操作,提取PAM细胞膜蛋白。加入少量SDT buffer(4% SDS、1 mmol/L DTT、150 mmol/L Tris-HCl,pH8.0),置沸水浴5 min,离心取上清,用BCA法测定蛋白质含量。
1.7 FASP酶解取50 μL样品,加入 DTT至终浓度为100 mmol/L, 置沸水浴5 min,取出冷却至室温;加入200 μL UA buffer(8 mol/L Urea、150 mmol/L Tris-HCl,pH8.0)混匀,转入10 kd超滤离心管,14 000×g离心15 min;加入200 μL UA buffer,离心15 min,弃滤液;加入100 μL IAA(终浓度为50 mmol/L IAA溶于UA中),600 r/min振荡1 min,避光室温30 min,14 000×g离心10 min;加入100 μL UA buffer,14 000×g离心10 min,重复2次;加入100 μL NH4HCO3(100 mmol/L),14 000×g离心10 min,重复2次;加入40 μL Trypsin buffer(4 μL Trypsin溶于40 μL NH4HCO3),600 r/min振荡1 min,置37℃中16~18 h;换新收集管,14 000×g离心10 min,取滤液,测定多肽含量(OD280)。
1.8 Shot-gun LC-MS质谱分析按照定量结果取2 μg酶解后产物进行Shot-gun LC-MS分析。采用纳升流速HPLC液相系统EASY-nLC1000进行分离。液相A液为0.1%甲酸乙腈水溶液(乙腈为2%),B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱Thermo EASY column SC200 150 μm×100 mm(RP-C18)以100%的A液平衡。样品由自动进样器上样到色谱柱进行分离,流速为300 μL /min。相关液相梯度如下:0~55 min,B液线性梯度从0%到45%;55~58 min,B液线性梯度从45%到100%;58~60 min,B液维持在100%。酶解产物经毛细管高效液相色谱分离后用Q Exactive质谱仪进行质谱分析。分析时长:60 min,检测方式:正离子,母离子扫描范围:300~1800 m/z。多肽和多肽碎片的质量电荷比按照下列方法采集:MS1在M/Z 200时分辨率为70 000,AGC target:3e6,一级Maximum IT:10 m,Number of scan ranges:1,Dynamic exclusion:40.0 s;每次全扫描(full scan)后采集20个碎片图谱,二级在M/Z 200时分辨率为17 500,MS/MS Activation Type:HCD,Isolation window:2 m/z,Microscans:1,二级Maximum IT:60 m,Normalized collision energy:30eV,Underfill ratio:0.1 %。
1.9 质谱数据分析原始文件(raw file)用Proteome Discoverer 1.4(Thermo)提交至Mascot 2.2服务器,搜索相应的数据库,最后得到鉴定的蛋白质结果。相关参数如下:Enzyme=Trypsin,Missed cleavage=2,Fixed modification:Carbamidomethyl(C),Variable modification:Oxidation(M)。查库所用本地化Uniprot数据库:uniprot Sus scrofa蛋白数据库(下载日期20150317,序列34349条)。肽段容差(Peptides tolerance):20 ppm,MS/MS tolerance:0.1Da,结果过滤参数:FDR≤0.01。
1.10 生物信息学分析鉴定蛋白使用在线定位预测软件(http://genome.unmc.edu/ngLOC/index.html)进行定位分析。筛选的差异蛋白使用Blast2GO软件进行基因本体(gene ontology)分析,分别进行蛋白的生物学过程(biological process)、分子功能(molecular function)、细胞组成(cellular component)分析。
2 结果
2.1 PAM的病毒感染小猪安乐死后,取出肺脏,成功分离到半贴壁的PAM。将培养24 h的PAM,分别感染1MOI的rHuN4-EGFP和rHuN4-F112-EGFP。病毒吸附1 h后,用PBS洗涤2次,加入2%FBS的RPMI-1640培养基,在37℃、5% CO2的培养箱中继续培养24 h。通过流式细胞仪FITC通道筛选到感染及未感染PRRSV的PAM,提取膜蛋白,成功获得足量的用于质谱分析的膜蛋白样品。
2.2 Shotgun定性质谱分析结果利用Shotgun定性质谱技术,分析感染rHuN4-EGFP和rHuN4-F112-EGFP的PAM差异膜蛋白,共鉴定到肽段7273个,对应蛋白1154个,细胞膜定位的蛋白数量为681个,占59.01%。其中在rHuN4-EGFP感染样品中特异检测到72个差异表达蛋白,在rHuN4-F112-EGFP感染样品中特异检测到12个蛋白(表1)。其中,Lectinlike oxidized LDL receptor-1、Junction plakoglobin 在rHuN4-EGFP感染组和rHuN4-F112-EGFP感染组中均能被检测到,因此,最终共获得82个在强弱毒感染PAM过程中存在差异表达的膜蛋白。

表1 Shotgun质谱鉴定部分差异蛋白表Table1 A partial differential protein of the Shotgun mass spectrometry

图1 感染rHuN4-EGFP的PAM差异膜蛋白的GO注释Fig. 1 Gene ontology (GO) categories of the identified membrane proteins from PAM infected with rHuN4- EGFP
同时,将特异检测到的差异蛋白从生物学过程、分子功能、细胞组成等方面进行GO注释,感染rHuN4-EGFP强毒株以及rHuN4-F112-EGFP弱毒株的差异表达膜蛋白主要参与代谢、生物学调节、细胞加工过程,大部分蛋白具有结合、催化活性,这些蛋白主要为细胞器和细胞膜的组成成分(图1和图2)
2.3 PAM差异膜蛋白对PRRSV复制的影响对Shotgun质谱结果进行分析后,将部分差异表达的膜蛋白基因克隆到真核表达质粒,分别转染MARC-145细胞后,再感染PRRSV强毒HuN4或弱毒HuN4-F112,采用抗PRRSV N蛋白的多克隆抗体进行Western blot分析。结果表明,前蛋白转化酶枯草杆菌蛋白酶9(proprotein convertase subtilisin/kexin type 9,PCSK9)重组蛋白对PRRSV强毒株和弱毒株均有抑制作用(图3A),而Clusterin和Apoliproterin C-II则能够促进PRRSV的复制(图3B)。
重组质粒转染MARC-145细胞36 h后接种0.1MOI的HuN4或HuN4-F112病毒。接种病毒48 h后,收取上清测定病毒含量(TCID50),并用RT-qPCR测定病毒的拷贝数[15]。结果表明,过表达PCSK9能抑制PRRSV强毒和弱毒的复制(图4)。
3 讨论
PRRSV一直严重危害着养猪业的发展,尤其是2006年爆发的HP-PRRSV对我国养猪业造成了巨大的经济损失,但目前对HP-PRRSV的致病机制却知之甚少。本团队前期实验数据表明PRRSV强弱毒株感染PAM的效率存在差异,很可能与PRRSV的致病机制有关。本研究通过Shotgun质谱技术筛选影响PRRSV感染效率的差异膜蛋白,通过对差异膜蛋白的研究来探究PRRSV的致病机制。
通过流式细胞术分选获得感染EGFP标记的PRRSV强毒株(rHuN4-EGFP)或弱毒株(rHuN4-F112-EGFP)的PAM,提取其膜蛋白进行质谱分析,获得了82个在强弱毒感染PAM过程中差异表达的膜蛋白。选取部分可信度较高的差异膜蛋白检测其对PRRSV复制的影响,过表达实验显示PCSK9蛋白能够抑制PRRSV复制,Apolipoprotein C-II和Clusterin能够促进PRRSV复制。Apolipoprotein C-II存在于高密度脂蛋白颗粒上,参与高密度脂蛋白向低密度脂蛋白转移胆固醇酯的过程,其表达量增多,能增加低密度脂蛋白从肝脏向其他组织和器官运输胆固醇的能力,对于靶细胞内的胆固醇运输具有重要作用。有文献表明,细胞及病毒的脂筏结构对于PRRSV的复制具有重要作用,脂筏为富含胆固醇和鞘磷脂的的膜脂微区(membrane lipid microdomain),用胆固醇抑制剂MβCD处理细胞能明显抑制PRRSV的复制,MβCD处理的病毒则失去感染细胞的能力[16-17],可见胆固醇代谢对于PRRSV的感染是非常重要的。载脂蛋白作为携带脂蛋白中胆固醇酯入胞的载体,很可能通过调节胆固醇代谢,从而影响PRRSV的复制。
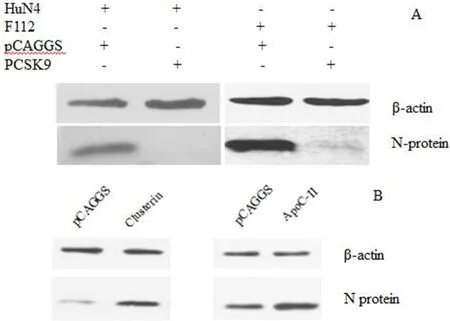
图3 Western blot检测差异膜蛋白对PRRSV复制的影响Fig.3 Effect of differential membrane proteins on PRRSV replication by Western blot

图4 TCID50及RT-qPCR检测差异膜蛋白对PRRSV复制的影响Fig.4 Effect of differential membrane protein on PRRSV replication by TCID50 and RT-qPCR
PCSK9又称神经凋亡调节转化酶(neural apoptosis-regulated convertase 1,NARC-1),属于前蛋白转化酶(proprotein convertases,PC)家族。已有文献表明PCSK9蛋白能够与低密度脂蛋白受体(low-density lipoprotein receptor, LDLR)结合,加速细胞内LDLR在溶酶体中的降解,阻碍LDLR的循环使用,影响细胞摄入胆固醇的能力,从而显著抑制PRRSV的复制[18]。因此,PCSK9蛋白很可能通过影响细胞胆固醇水平来影响PRRSV复制。Wang等[19]研究表明不同PAM的CD163丰度存在差异,并且CD163丰度越高,PRRSV复制能力越强,从另一方面证实PAM细胞膜蛋白差异能影响PRRSV复制。对影响PRRSV复制的差异膜蛋白进行研究,将有助于深入了解PRRSV复制特性,为探索PRRSV致病机制奠定基础。
已报道的关于PRRSV感染PAM蛋白质组学研究均是将接种PRRSV后所有的PAM作为试验组,将未接种PRRSV的PAM作为对照组进行比较分析[20-21]。由于PRRSV感染PAM的效率比较低,在病毒量足够的情况下,并不是所有PAM均可被PRRSV感染,大部分PAM并未感染PRRSV,因此,实验结果可能不够严谨。本研究利用rHuN4-EGFP、rHuN4-F112-EGFP病毒感染PAM细胞,通过流式细胞仪的FITC通道成功分选到确定感染PRRSV的PAM,将确定感染PRRSV的PAM细胞膜蛋白与确定未感染PRRSV的PAM比较,结果更为准确,能更好地对PRRSV复制及致病性机制进行研究。

