塞尼卡病毒与口蹄疫病毒双重RT-PCR鉴别检测方法的建立
刘 涛,黄 元,陈锦良,向 华,肖少波,王晓虎,陈 晶,向 蓉,何继军,郑海学
(1.广东省农业科学院动物卫生研究所 广东省兽医公共卫生公共实验室 广东省畜禽疫病防治研究重点实验室农业部兽用药物与诊断技术广东科学观测实验站,广州 510640;2.华中农业大学动物科学技术学院、动物医学院,武汉 430070;3.中国农业科学院兰州兽医研究所,兰州 730070)
近年来,一种新型病毒正在席卷美国、加拿大、巴西、澳大利亚、新西兰等地,猪感染后产生类似水泡样病变,这种新型的病毒被命名为塞尼卡病毒A(SenecavirusA,SVA)[1]。2002年研究人员首次在人类胚胎成视网膜细胞培养液中发现SVA,认为它可能是通过胎牛血清或猪胰蛋白酶引入培养物中的污染物[2]。SVA属小RNA病毒科[3]。SVA具有非常强大的溶瘤特性,能够选择性感染并裂解肿瘤[4]。我国2015年检测分离到首例SVA毒株CH-01-2015[5]。
口蹄疫(foot-and-mouth disease,FMD)是一种急性、热性、高度接触性传染病,致病原为口蹄疫病毒(Foot-and-mouth disease virus,FMDV)。FMD临床表现为发热,唇部、口腔粘膜、蹄部出现水泡性病变,传播范围广,危害性大,被国际动物卫生组织(OIE)列为18种A类动物传染病之首。
SVA和FMDV同为小RNA病毒,感染症状相似,均表现为口鼻和蹄部出现囊泡样症状,临床诊断不易区分。本研究针对这2种病毒的基因序列合成特异性引物,建立了一种能同时检测鉴别SVA和FMDV的双重RT-PCR方法。
1 材料与方法
1.1 病毒与样品FMDV由中国农业科学院兰州兽医研究所保存提供;SVA分离自广东省某猪场发病猪水泡皮,在PK-15细胞上增殖;PK-15细胞和BHK-21细胞由广东省农业科学院动物卫生研究所保存。10份样品采集自广东省某猪场。
1.2 主要试剂TaKaRa ExTaqDNA聚合酶、pMD19-T质粒和DH5α感受态细胞购自宝生物工程(大连)有限公司;病毒RNA/DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒和质粒小量快速抽提试剂盒购自美基生物科技有限公司;口蹄疫病毒通用型RT-PCR检测试剂盒购自北京世纪元亨动物防疫技术有限公司。
1.3 引物合成针对FMDV UTR序列的口蹄疫通用引物[6],以及针对SVA VP1基因的引物[7](表1)由华大基因有限公司合成。

表1 双重RT-PCR引物相关信息Table 1 Related information of double RT- PCR primers
1.4 引物验证取A型FMDV、O型FMDV和SVA按照病毒RNA/DNA提取试剂盒说明书方法提取RNA,并按照反转录试剂盒说明书将病毒RNA反转录为cDNA,然后以cDNA为模板进行单引物单模板PCR扩增。PCR扩增体系为25 μL:TaKaRa ExTaq聚合酶0.5 μL,上游引物和下游引物各0.5 μL,模板cDNA为0.5 μL,剩余用去离子水补足。PCR扩增条件:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,30个循环,72℃再延伸10 min,4℃保存。 PCR扩增产物在1.5%琼脂糖凝胶中进行点样,90 V电泳25 min后,观察扩增条带。
1.5 阳性克隆质粒的构建将FMDV和SVA扩增得到的目的PCR产物用凝胶回收试剂盒进行回收,并连接至pMD19-T载体,构建分别含有上述2种病毒的5'UTR基因和VP1-2A基因片段的的阳性克隆质粒。1.6 反应体系优化 将2种病毒的cDNA作为模板进行PCR扩增,反应体系为25 μL:TaKaRa ExTaqDNA聚合酶0.5 μL、引物2 μL(每个引物0.5 μL)、模板1 μL、2种质粒各0.5 μL,用去离子水补至25 μL。PCR扩增条件:94℃预变性5 min;94℃变性1 min,55℃ 退火1 min,72℃延伸1 min,30个循环;72℃再延伸10 min,4℃保存。PCR扩增产物在1.5%琼脂糖凝胶中进行点样,90 V电泳25 min后,观察扩增条带。
将双重RT-PCR体系中浓度为10 μmol/L的引物依次以0.25 μL增加,从0.25 μL加至1.25 μL,退火温度范围设置为53℃~58℃,筛选出双重RT-PCR的最佳反应条件。
1.7 特异性试验采用优化后的双重RT-PCR扩增体系和扩增条件,对猪圆环病毒(Porcine circovirus,PCV)、猪细小病毒(Porcine parvovirus,PPV)、猪繁殖与呼吸综合征病毒(Porcine reproductive respiratory syndrome virus,PRRSV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、H5N1型禽流感病毒(Avian influenza virus,AIV)、猪瘟病毒(Swine fever virus,SFV)、猪水疱病毒(Vesicular stomatitis virus,VSV)、猪伪狂犬病毒(Pseudorabies virus,PRV)、FMDV和SVA提取总核酸,作为模板进行双重RT-PCR和PCR,同时设置阴性对照,检测双重RT-PCR的特异性。
1.8 敏感性试验用紫外分光光度计检测2种病毒的阳性克隆质粒的浓度,并计算拷贝数。对阳性克隆质粒进行10倍梯度稀释,使质粒浓度为108~101copies/μL。分别取相同浓度的2种病毒质粒混合作为模板,按照已经优化后的双重RT-PCR反应条件进行扩增,分析双重RT-PCR反应的敏感性。
1.9 样品检测结果的验证将所有已检组织病料样品进行冰上研磨和抗生素处理后,分别接种PK15和BHK21细胞,盲传10代。将所有病料及最终代次的细胞培养产物进行总核酸提取,用商品化试剂盒进行FMDV检测,并按照文献[7] 进行针对SVA的RTPCR检测。根据文献扩增SVA的VP1基因,回收阳性PCR产物并送往华大基因公司进行测序。
2 结果
2.1 引物特异性验证利用不同的引物对,对A型FMDV、O型FMDV和SVA进行单模板PCR检测,以验证引物的特异性。结果显示引物特异性良好,以不同的cDNA作为模板,均能以对应的引物扩增到相应的目的片段(图1)。
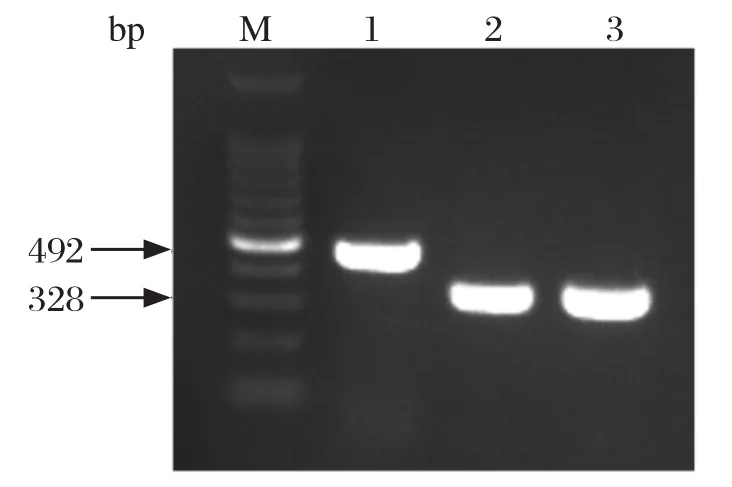
图1 SVA、A型FMDV和O型FMDV单重RT-PCR结果Fig.1 PCR results of SVA and FMDV type A/O
2.2 扩增条件的优化对FMDV和SVA的引物浓度和退火温度进行了优化。以各cDNA作为模板,双重RT-PCR反应体系中最佳引物终浓度分别为0.2 μmol/L(FMDV)、0.5 μmol/L(SVA)(图2);最佳退火温度为57℃(图3)。最佳反应条件:94℃预变性5min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,共进行30个循环;最后72℃再延伸10 min,4℃保存。

图2 FMDV和SVA不同引物终浓度双重RT-PCR结果Fig.2 Double RT-PCR results for SVA and FMDV in different concentration of primers

图3 不同退火温度下SVA和FMDV的双重RT-PCR结果Fig.3 Double RT-PCR results for FMDV and SVA at different annealing temperature
2.3 特异性结果分析利用优化好的双重RT-PCR反应条件,对FMDV和SVA cDNA模板随机混合并进行双重PCR扩增,结果含有FMDV和SVA的核酸样品均能扩增出目的条带,且无其他非特异性条带(图4)。PRRSV、PPV、PRV、VSV、H5N1、HCV、PCV、PEDV核酸样品进行双重PCR扩增,结果均为阴性(图5)。
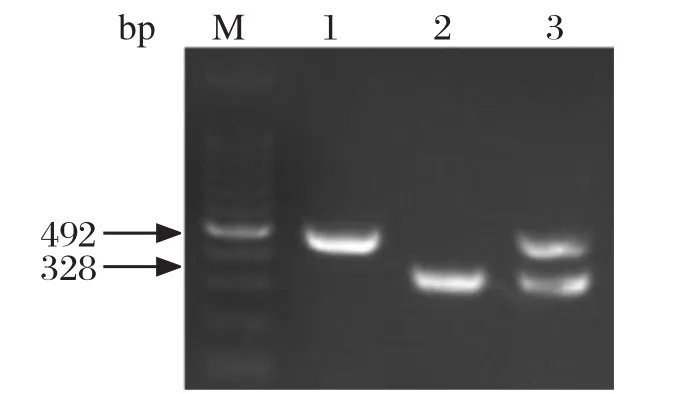
图4 SVA和FMDV双重PCR扩增结果Fig.4 Double RT-PCR results of FMDV and SVA
2.4 敏感性结果分析在FMDV和SVA引物终浓度分别为0.2 μmol/L、0.5 μmol/L时,该双重RTPCR能检出的最低拷贝数分别为103copies/μL(FMDV)、104copies/μL(SVA)(图6)。

图6 SVA和FMDV双重RT-PCR敏感性检测Fig.6 The sensitivity of double RT-PCR for SVA and FMDV
2.5 样品检测结果应用双重RT-PCR方法对临床送检的10份样品和细胞培养的病毒进行检测,结果表明,FMDV和SVA细胞培养物检测为阳性,有2份样品检测为SVA阳性,其余样品均为阴性。
2.6 样品检测结果验证双重RT-PCR方法检测为SVA阳性的病料,处理后接种PK15细胞,盲传3~5代后均发生病变。将检测为SVA阴性的病料接种BHK-21细胞,盲传10代均未发生病变。所有病料和最终代次的细胞培养产物,分别进行FMDV和SVA的RT-PCR鉴定,结果均与本研究建立的双重RT-PCR结果一致。SVA阳性病料VP1基因测序结果上传至GenBank,登录号分别为MG557660和MG557661。
3 讨论
从2008年开始,研究人员陆续在美国中西部地区和巴西部分地区猪场检测到SVA[2]。SVA感染的临床表现和口蹄疫极其相似:口腔粘膜、舌头、蹄冠和鼻子充满液体或破裂的囊泡;妊娠或分娩母猪厌食,无生殖障碍;仔猪体型肥胖,肌无力,食欲不振,嗜睡,唾液分泌过多,皮肤充血,腹泻,并且伴有神经系统表现,部分仔猪会突然死亡[8]。我国2015年首次在广东省某猪场检测到SVA,同年扩散至我国中部地区[9],1~4日龄的仔猪感染后死亡率可达30%~70%[5,10-12]。分析2015~2016年我国报道的塞尼卡病例后发现,SVA能够导致母猪的生产性能下降。SVA现已蔓延至广东、福建、河南、湖北、江西等多个省份,引发的经济损失已经不可估量[13]。
多重PCR(multiplex PCR)由Chambercian等于1988年提出[14-15],该技术以其效率高,成本低,速度快等优点,被广泛应用于基因组结构与功能基因及数量性状基因座的定位研究中[16]。双重RT-PCR通过在同一个反应体系中加入两对不同的引物,能够扩增出两条特异性条带。本研究建立的双重RTPCR方法特异性和敏感性良好,能够很好的区分出SVA和FMDV的不同核酸片段大小,对临床检测具有很高的应用价值。
双重RT-PCR结果可受到很多因素的影响,其中最重要的一点就是引物的设计。设计的两种引物在目的基因上面无交叉扩增反应,不会形成引物二聚体,且目的片段大小相差200 bp以上。本研究利用FMDV 5'UTR序列基因进行引物设计,由于5'-UTR区域比较保守,对尚未传入亚洲的SAT1/2/3型扩增效率较低,可适用于A、O、C和Asia I型FMDV的扩增检测[6]。SVA则利用报道过的VP1序列合成引物。利用NCBI在线引物设计工具,使两对引物的Tm值控制在同一温度附近,保证核酸扩增的效率。
已知FMDV共存在7种血清型,其中O型和A型分别于2010年和2013年在广东省暴发,并在全国多个省份流行,是当前FMDV在我国流行的主要血清型。FMDV与SVA无论是临床表现还是分子结构都具有高度相似性,对于这两种病毒进行有效的临床鉴别诊断,在防控中具有重要的意义。本研究建立的双重RT-PCR检测方法能够快速有效的检测出SVA和FMDV,为两种病毒的鉴别诊断提供了重要工具。
——一道江苏高考题的奥秘解读和拓展

