不同制备工艺柴胡注射液成分分析及质量标准探讨
陈文露, 彭新宇, 余静贤, 高 彪, 徐志宏, 潘育方
(1. 广东药科大学, 广东 广州 440100; 2. 广东省农业科学院动物卫生研究所, 广东 广州 440100;3. 广东省中兽药工程技术研究中心, 广东 广州 440100; 4. 华南农业大学, 广东 广州 440100)
柴胡为伞形科植物柴胡或狭叶柴胡的干燥根, 按性状不同, 分别习称为“北柴胡” 和“南柴胡”[1], 具有疏散退热、 疏肝解郁、 升举阳气等功效, 多用于感冒发热、 寒热往来、 胸胁胀痛、 月经不调、 子宫脱垂、 脱肛[1]等。 柴胡注射液收录在《中药成方制剂》 第十七册中, 是我国第一个研制的中药注射液[2], 具有清热解表的功效, 临床上常用于治疗感冒和流行性感冒或疟疾引起的发热, 疗效确切,而近年来学者还发现它有抗病毒、 抗肿瘤、 抗炎、 增强学习记忆力、 提高免疫力的作用[3-5]。
随着柴胡注射液临床应用趋于广泛, 其不良反应报道也逐渐增多, 相关的副作用有荨麻疹、 皮疹、 瘙痒、 恶心呕吐、 腹胀腹泻、 头晕头痛、 视力模糊、 胸闷烦躁、 血压异常、 肺水肿等, 严重的甚至会引起呼吸困难、 肾功能衰竭、 血压骤降、 意识丧失等, 据分析有可能是提取工艺中产生了引起副作用的物质[6-9]。 柴胡注射液由柴胡精油进一步制备而得, 提取工艺有水蒸法、 酸浸法、 盐析法、 酸浸盐析法等[10-12], 但目前还没有对不同制备工艺注射液进行成分分析的报道。 本实验拟通过紫外分光光度法和GC-MS法对市售、 不同工艺制备的柴胡注射液进行吸光度比较和成分鉴定, 以期为进一步提高柴胡注射液的质量、 减少毒副作用提供依据。
1 材料
Agilent GC-MDS 7890B-5977A、 HP-5MS 弹性石英毛细管柱(30 m×0.25 mm, 5 μm) (美国安捷伦公司); PHS-3C 数显PH 计(上海精密科学仪器有限公司); UV-3100PC紫外-可见分光光度计(上海美谱达仪器有限公司); EXD-322B 电子天平(福建衡科仪器有限公司)。 柴胡注射液(批号16020302A, 河南省康华药业有限公司)。 盐酸(批号20111103, 广州化学试剂厂); 氯化钠(批号20170206,广州化学试剂厂); 1, 2-丙二醇(批号20170815, 上海凌峰化学试剂有限公司); 吐温-80 (批号20170311, 天津市科密欧化学试剂有限公司); 柠檬酸三钠(批号20170929,国药集团化学试剂有限公司)。 柴胡(康美药业股份有限公司, 批号20161012), 经广东药科大学中药学院程轩轩副教授鉴定为北柴胡。
2 方法
2.1 供试品制备
2.1.1 柴胡精油提取
2.1.1.1 水提法 柴胡50 g 切段, 段长1 ~2 cm, 加入550 mL注射用水, 70 ℃下浸泡8 h (过夜) 后蒸馏提取,初馏液收取150 mL, 再进行重蒸馏, 重馏液收50 mL。
2.1.1.2 盐析法 柴胡50 g 切段, 段长1 ~2 cm, 加入550 mL注射用水, 70 ℃下浸泡8 h (过夜) 后按占溶液25%比例, 加入氯化钠137.5 g, 蒸馏提取, 初馏液收取150 mL, 再进行重蒸馏, 重馏液收50 mL。
2.1.1.3 酸浸法 柴胡50 g 切段, 段长1 ~2 cm, 加入550 mL稀盐酸溶液(pH=1.0), 70 ℃下浸泡8 h (过夜)后蒸馏提取, 初馏液收取150 mL, 再进行重蒸馏, 重馏液收50 mL。
2.1.1.4 酸浸盐析法 柴胡50 g 切段, 段长1~2 cm, 加入550 mL 稀盐酸溶液(pH=1.0), 70 ℃下浸泡8 h (过夜) 后按溶液25%比例加入氯化钠137.5 g 蒸馏提取, 初馏液收取150 mL, 再进行重蒸馏, 重馏液收50 mL。
2.1.2 柴胡注射液配制 精密量取“2.1.1” 项下4 种重馏液各40 mL, 加入0.15 g 吐温-80、 1 g 1, 2-丙二醇, 搅拌使油完全溶解, 再加入氯化钠0.45 g, 溶解后, 调pH 值至6.6, 加注射用水至50 mL, 0.22 μm 微孔滤膜过滤, 灌封, 115 ℃灭菌30 min, 即得。
2.2 紫外分光光度计测定吸光度
2.2.1 最大吸收波长测定 市售柴胡注射液用纯化水稀释10 倍[13], 测定的紫外光谱和最大吸收波长, 见图1。 由图可知, 市售柴胡注射液在275 nm 波长处有最大吸收峰, 故在此处进行吸光度检测。
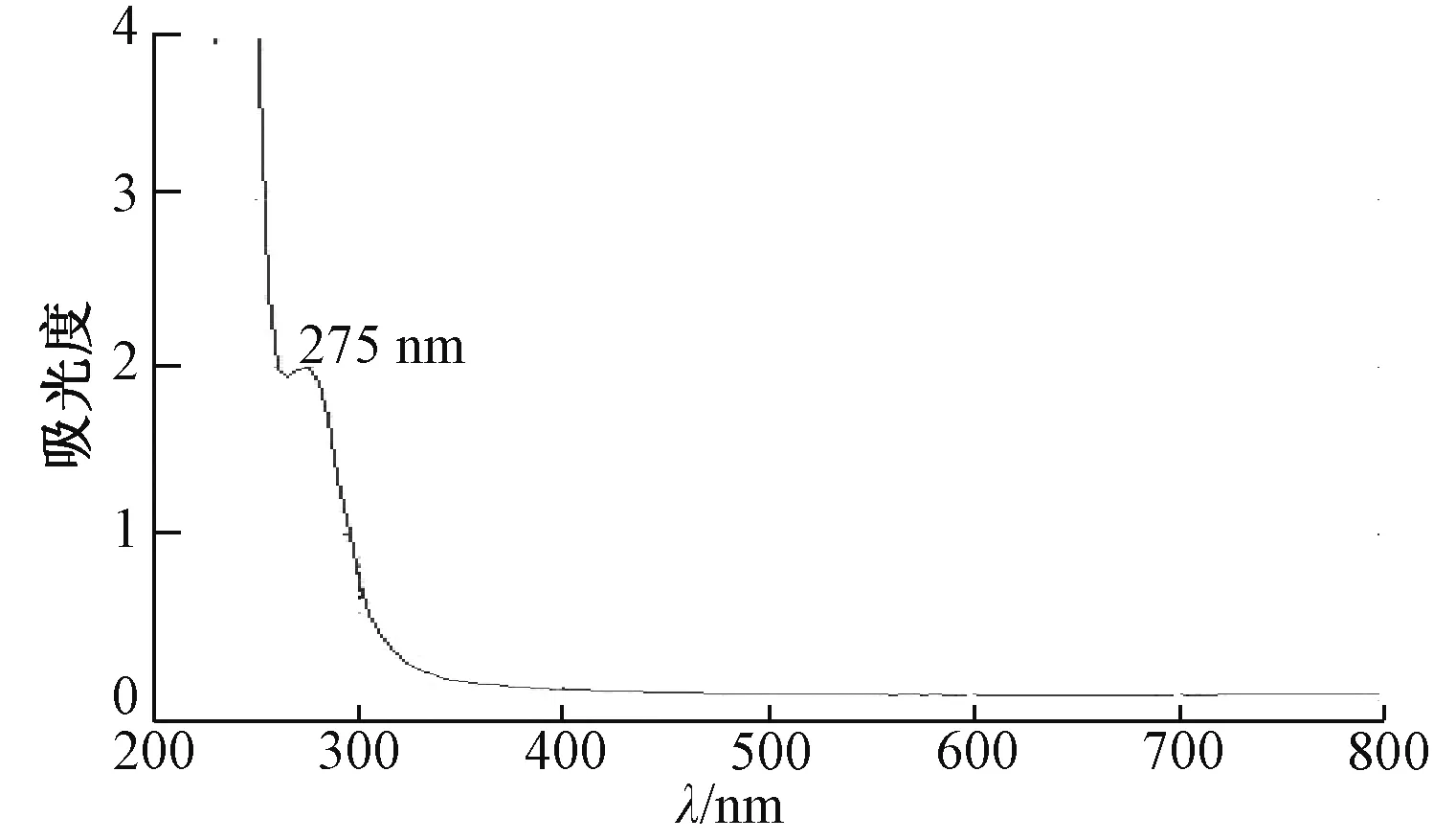
图1 柴胡注射液的紫外光谱图
2.3 GC-MS 分析 取市售柴胡注射液和“2.1.1” 项下4种工艺制备的柴胡注射液各10 mL, 分别密封于50 mL 顶空进样瓶, 水浴80 ℃, 平衡10 min, 取顶空气体1 mL 上机检测, 40 ℃柱温保持5 min, 以5 ℃/min 升至50 ℃, 然后以20 ℃/min升至250 ℃, 保持5 min; EI 离子源; 电子能量70 eV; 离子温度230 ℃; 接口温度250 ℃; 载气为高纯氦气; 分流模式不分流; 体积流量1.0 mL/min; 进样器为手动进样; 进样口温度250 ℃; 传输线温度250 ℃; 溶剂延迟3 min; 采集质量范围m/z 30~350; 工作站为MASS HUNTER。
3 结果
3.1 吸光度 市售、 水蒸馏法制备、 盐析法制备、 酸浸法制备、 酸浸盐析法制备柴胡注射液吸光度分别为0.449 0、0.651 7、 0.5963、 1.1758、 0.824 4, 可知吸光度最低的为市售, 其次为盐析法、 水蒸法、 酸浸盐析法制备, 最高的为酸浸法制备。
3.2 色谱图 图2 ~6 显示, 市售不同工艺制备的样品色谱图有明显差异, 出峰时间和成分数量明显不同。 市售、水蒸馏法制备、 盐析法制备、 酸浸法制备、 酸浸盐析法制备的色谱峰总面积分别为100 218 400、 106 965 460、54 324 058、 58 264 089、 38 013 458, 差异很大, 最高的为水蒸法制备, 最低的为酸浸盐析法制备。
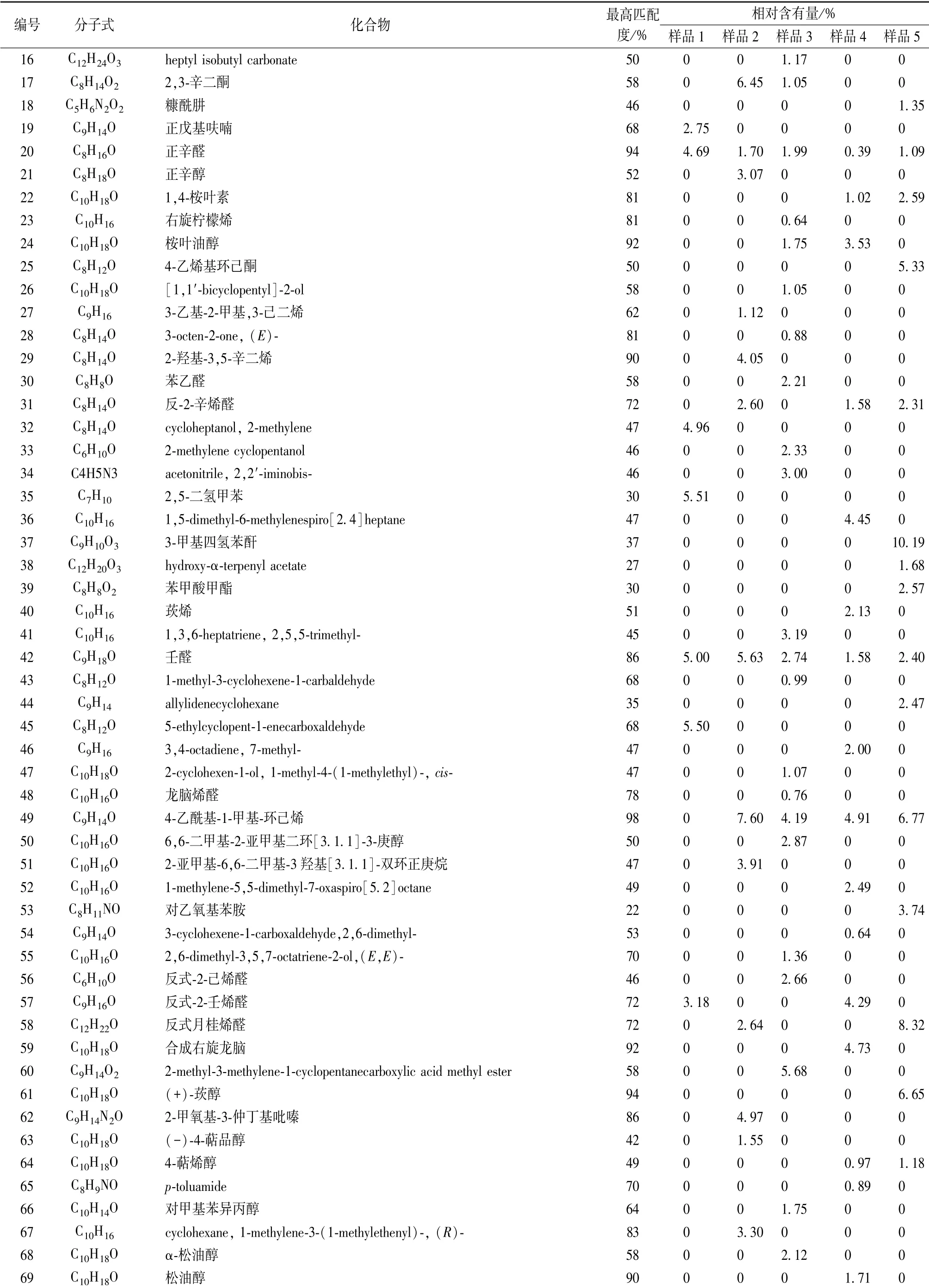
3.3 成分鉴定 根据MST14 谱库检索定性分析各组分,采用色谱峰面积归一法进行相对定量。 表1 显示, 5 种柴胡注射液中一共鉴定出140 种成分, 其中1 号样品25 种,2 号样品33 种, 3 号样品52 种, 4 号样品60 种, 5 号样品23 种, 正己醛、 庚醛、 苯甲醛、 壬醛、 正辛醛为这5 种样品的共有成分。
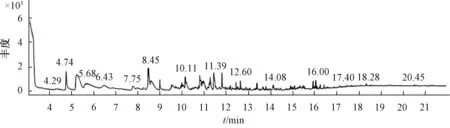
图2 市售样品GC-MS 色谱图
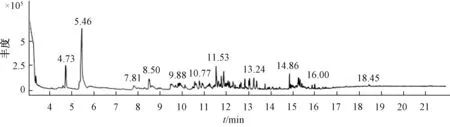
图3 水蒸法样品GC-MS 色谱图
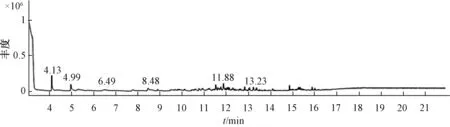
图4 盐析法样品GC-MS 色谱图
图5 酸浸法样品GC-MS 色谱图
图6 酸浸盐析法样品GC-MS 色谱图

表1 不同样品中成分鉴定结果
续表1

续表1
4 讨论
根据《中药成方制剂》 第十七册, 柴胡注射液稀释10倍后在278 nm 波长处的吸光度不小于0.65, 但只有水蒸法、 酸浸法和酸浸盐析法提取的样品达到了标准。 糠醛和5-甲基呋喃醛不仅是柴胡注射液的有害物质, 也是引起不良反应的主要成分; 糠醛是柴胡在酸盐条件下柴胡纤维的水解产物, 5-甲基呋喃醛是柴胡皂苷中糖的水解产物[14];注射液在275 nm 处的吸光度主要是糠醛的贡献[15], 故仅以吸光度来衡量柴胡注射液是否达标有失偏颇, 缺乏专属性, 也无法确定糠醛存在与否, 现行标准也已经取消了关于吸光度的限定。
有报道称, 正己醛、 正庚醛、 桉叶油醇、 桃金娘烯醇、匙桉醇、 桉叶素等具有解热、 抗炎、 抗菌、 治疗支气管炎、急慢性鼻窦炎、 平喘、 祛痰的药效学作用[16-21]。 GC-MS 结果表明, 5 种样品一共鉴定出140 种成分, 其中正己醛、庚醛、 正辛醛、 苯甲醛、 壬醛为5 种样品的共有成分, 它们与样品药效学的相关性值得进一步研究。
市售样品发现25 种成分, 有效成分正己醛28.38%、庚醛15.61%, 共占比约43.99%; 有害成分糠醛4.19%;其他主要成分有反式-2-壬烯醛3.18%、 5-ethylcyclopent-1-enecarboxaldehyde 5.50%、 壬 醛5.00%、 2, 5-二 氢 甲 苯5.51%、 2-methylene cycloheptanol, 4.96%、 正辛醛4.69%。
水蒸法提取样品发现33 种成分, 有效成分正己醛2.44%、 庚醛6.93%、 桃金娘烯醇1.72%、 匙桉醇2.48%,共占比约13.57%; 其他主要成分有顺-Z-α-环氧化红没药烯5.03%、 2-甲氧基-3-仲丁基吡嗪4.97%、 4-乙酰基-1-甲基-环 己 烯7.60%、 壬 醛5.63%、 2-羟 基-3, 5-辛 二 烯4.05%、 2, 3-辛二酮6.45%、 苯甲醛4.64%。
盐析法提取样品发现52 种成分, 有效成分正己醛4.75%、 庚醛5.92%、 桉叶油醇1.75%、 匙桉醇1.61%,共占比约14.03%; 有害成分糠醛3.08%; 其他主要成分有2, 5, 5-trimethyl-1, 3, 6-heptatriene 3.19%、 4-乙 酰 基-1-甲基-环己烯4.19%、 2-methyl-3-methylene-1-cyclopentanecarboxylic acid methyl ester 5.68%、 acetic acid、 1, 7, 7-trimethyl-bicyclo [2.2.1] hept-2-yl ester 3.83%。
酸浸法提取样品发现60 种成分, 有效成分正己醛2.32%、 庚 醛 0.77%、 1、 4-桉 叶 素 1.02%、 匙 桉 醇0.70%、 桉叶油醇3.53%, 共占比约8.34%; 有害成分糠醛19.33%、 5-甲基呋喃醛[16]2.62%, 共占比约21.95%;其他主要成分有bisabolol oxide B 3.76%、 合成右旋龙脑4.73%、 反式-2-壬烯醛4.29%、 4-乙酰基-1-甲基-环己烯4.91%、 1, 5-dimethyl-6-methylenespiro [2.4 ] heptanes 4.45%、 2-糠酸甲酯5.62%。
酸浸盐析法提取样品发现23 种成分, 有效成分正己醛17.15%、 庚 醛5.56%、 1、 4-桉 叶 素2.59%, 共 占 比 约25.30%; 有害成分糠醛3.87%、 3-糠醛4.72%, 共占比约8.59%; 其他主要成分有(+) -莰醇6.65%、 反式月桂烯醛8.32%、 对乙氧基苯胺3.74%、 4-乙酰基-1-甲基-环己烯6.77%、 3-甲基四氢苯酐10.19%、 4-乙烯基环己酮5.33%、2-糠酸甲酯5.75%。
根据现行标准[22], 柴胡注射液应是用水蒸法浸泡蒸馏所得, 气相色谱检测每1 mL 样品含糠醛不得超过60 μg。但结果显示, 水蒸法提取的样品是唯一不含糠醛、 3-糠醛、5-甲基呋喃醛这3 种有害成分的, 表明制备工艺对产品成分有决定性作用, 而酸浸法和酸浸盐析法提取制备的样品有害成分占比是最高的, 因此不建议使用这2 种生产工艺制备。 随着柴胡注射液在临床上的广泛应用, 为确保临床用药安全, 有必要对糠醛含有量进行更严格的限制。
现行标准中只有正己醛的特征图谱, 没有相应的含有量规定, 所以课题组认为标准不够完善, 一是目前还没有正己醛和柴胡注射液药效相关的直接证据; 二是柴胡注射液相关文献报道的可能有效成分除了正己醛外, 还有正庚醛、 桉叶油醇、 桃金娘烯醇、 匙桉醇、 桉叶素等; 三是若只对正己醛做特征图谱, 而没有最低含有量限制, 难免有不法厂家为了达到标准而对柴胡蒸馏液进行稀释, 进而既可降低糠醛含有量, 又可增加产量, 影响药效。 因而, 需对柴胡注射液进行药效学实验, 验证其作用物质基础和机制, 确定有效物质的种类及其含有量, 进一步完善该制剂质量标准。

