牛胆汁对化风丹药母发酵减毒的影响
曹国琼, 张永萍∗, 徐 剑, 高 莉, 廖小刚
(1. 贵阳中医学院, 贵州 贵阳 550002; 2. 遵义廖元和堂药业有限公司, 贵州 遵义 563000)
化风丹是贵州省传统名药, 收载于《国家中成药标准汇编内科分册》, 具有息风镇痉、 豁痰开窍的功效, 临床用于治疗风痰闭阻、 中风偏瘫、 癫痫等症, 疗效显著, 1951 年被列入国务院保护的四大名药之一, 2008 年入选国家级非物质文化遗产名录[1-2]。 化风丹的制备分为药母制备和成药制备, 药母的制备工艺为川乌、 半夏、 天南星、 白附子、 郁金打粉, 加入神曲和牛胆汁混匀, 自然条件下发酵2 至3 月, 阴干后即得, 其中含毒性药材川乌、 半夏、 天南星、 白附子, 故需进行发酵后方可制剂, 其主要目的是降低药母中毒性成分, 包括川乌中双酯型生物碱, 半夏、 天南星、 白附子中草酸钙针晶、 凝集素蛋白。 其中, 双酯型生物碱毒性最强, 小鼠灌胃给药乌头碱、 新乌头碱、 次乌头碱后, 三者半数致死量(LD50) 值分别为1.0 ~1.8、1.9、 5.8 mg/kg[3]。 目前, 化风丹的研究主要集中在药理和毒理[4-6], 而关于其药母发酵减毒仅有课题组前期的部分研究[7-8]。
牛胆汁为牛科动物黄牛Bos taurus domesticus Gmelin 或水牛Bubalus bubalis Linnaeus 的胆汁, 味苦, 性大寒, 无毒, 具有清肝明目、 利胆通畅、 解毒消肿的功效[9]。 除药用价值外, 牛胆汁常用于炮制有毒药物, 如天南星[10], 因牛的品种、 性别、年龄、 饲养条件不同, 其胆汁的pH 值、 密度、 胆酸等均存在差异, 对化风丹药母发酵降低毒性生物碱是否有影响还未见报道。
课题组前期研究发现, 化风丹药母随发酵时间的延长3 种双酯型生物碱含有量逐渐降低[7], 并优选出化风丹药母发酵的温度和湿度。 在此基础上,本实验研究牛胆汁对发酵过程中双酯型生物碱含有量的影响。
1 材料
LC-2010CHT 型高效液相色谱仪(UV-VIS 检测器、 LC Solution 色谱工作站, 日本岛津公司);AE240 型电子分析天平 (瑞士梅特勒-托利多公司); 超声波清洗仪(上海高信化玻仪器有限公司); HH-S 型恒温水浴锅 (江苏国胜实验仪器厂); LRH-150S 型恒温恒湿培养箱(广东医疗器械厂); GBC Cintra20 紫外可见分光光度计(澳大利亚照生公司); PHS-2C 型精密酸度计(武汉格莱莫检测设备有限公司)。
胆 酸 (100078-200414)、 乌 头 碱 (110720-200410)、 新 乌 头 碱 (0799-9403)、 次 乌 头 碱(11079-200805) 对照品均购自中国食品药品检定研究院。 乙腈为色谱纯(美国天地公司); 四氢呋喃、 异丙醇为色谱纯(天津市科密欧化学试剂有限公司); 其余试剂均为分析纯; 水为娃哈哈纯净水。
药母由遵义廖元和堂药业有限公司提供; 牛胆汁购于市场, 共36 份, 趁鲜取得, 置棕色瓶中,在-20 ℃冷藏, 备用。
2 方法
2.1 牛胆汁理化指标测定
2.1.1 pH 值 精密酸度计测定牛胆汁pH 值。
2.1.2 总固体 精密量取牛胆汁25 mL, 置于已干燥至恒定质量的蒸发皿中, 水浴上蒸干, 105 ℃下干燥3 h, 置于干燥器中冷却30 min, 迅速精密称定质量, 作为牛胆汁中的总固体。
2.1.3 密度 精密吸取牛胆汁25 mL, 称定质量,将其除以体积, 作为牛胆汁的密度。
2.1.4 总胆酸 按文献[11] 报道的方法, 测定牛胆汁中总胆酸含有量。
2.1.4.1 对照品溶液制备 精密称取胆酸对照品0.300 3 g, 置25 mL 量瓶中, 加60%冰醋酸溶解,定容, 摇匀, 即得(12.012 mg/L)。
2.1.4.2 供试品溶液制备 精密吸取牛胆汁0.5 mL于蒸发皿中, 80 ℃水浴挥干, 残渣用60%冰醋酸溶解, 转移至25 mL 量瓶中, 60%冰醋酸稀释至刻度, 摇匀。 从中精密吸取0.5 mL 置于25 mL量瓶中, 加入水-浓硫酸(1 ∶1) 混合液至刻度, 75 ℃水浴中加热10 min, 迅速移至冰浴中放置2 min, 取出, 即得。
2.1.4.3 标准曲线绘制 取对照品溶液2 mL, 置于50 mL 量瓶中, 60%冰醋酸定容至刻度, 取2、3、 4、 5、 6、 7 mL 置于25 mL 量瓶中, 加入水-浓硫酸(1 ∶1) 混合液至刻度, 75 ℃水浴中加热10 min, 迅速移至冰浴中放置2 min, 并以相应试剂为空白, 于388 nm 波长处测定。 以质量浓度为横坐标(X), 吸光度为纵坐标(A) 进行回归,得方程为A=0.128 5X +0.092 9 (R2=0.999 1),在0.961 0~3.333 4 mg/mL 范围内线性关系良好。
2.1.4.4 精密度试验 精密吸取对照品溶液1 mL, 置于25 mL 量瓶中, 60% 冰醋酸定容至刻度, 从中取出6 mL 于25 mL 量瓶中, 加入水-浓硫酸(1 ∶1) 混合液至刻度, 75 ℃水浴中加热10 min, 迅速移至冰浴中放置2 min, 以相应试剂为空白, 于388 nm 波长处测定6 次, 测得胆酸吸光度RSD 为0.51%, 表明仪器精密度良好。
2.1.4.5 重复性试验 精密吸取同一批胆汁6 份,每份0.5 mL, 按“2.1.4.2” 项下方法制备6 份供试品溶液, 在388 nm 波长处测定吸光度, 计算含有量。 结果, 胆酸含有量RSD 为2.45%, 表明该方法重复性良好。
2.1.4.6 稳定性试验 精密吸取同一份胆汁0.5 mL, 按“2.1.4.2” 项下方法制备供试品溶液和空白对照液, 在0、 20、 40、 60、 80、 100 min测定吸光度。 结果, 胆酸吸光度RSD 为2.27%,表明样品在100 min 内稳定性良好。
2.1.4.7 加样回收率试验 精密吸取含有量已知的胆汁0.25 mL, 共6 份, 加入胆酸对照品适量,按“2.1.4.2” 项下方法制备供试品溶液, 测得胆酸的平均加样回收率为99.82%。
2.1.4.8 样品含有量测定 按“2.1.4.2” 项下方法制备供试品溶液和空白对照液, 在388 nm 波长处测定吸光度, 计算含有量。
2.2 发酵药母制备 按药母处方量称取生川乌、生半夏、 生南星、 白附子、 郁金、 神曲, 混合均匀, 分为36 份, 加入已测定过pH 值、 总固体、密度、 胆酸的36 份牛胆汁混匀, 于温度35 ℃、 相对湿度60%下发酵, 在未发酵及发酵4 周取样用于检测(发酵温度、 湿度为课题组前期通过正交试验确定的最佳条件, 药母发酵4 周左右即可)。
2.3 发酵药母含有量测定 参照文献[7] 报道的方法, 测定未发酵及发酵4 周川乌中乌头碱、 新乌头碱、 次乌头碱的含有量。
2.3.1 对照品溶液制备 取乌头碱、 新乌头碱、次乌头碱对照品适量, 精密称定, 加异丙醇-三氯甲烷 (1 ∶ 1) 混 合 液 制 成 每1 mL 含 乌 头 碱0.129 mg、 新乌头碱0.161 mg、 次乌头碱0.140 mg,即得。
2.3.2 供试品溶液制备 取药母约2.5 g, 精密称定, 置具塞锥形瓶中, 加入氨试液1.5 mL, 精密加入异丙醇-乙酸乙酯(1 ∶1) 混合溶液25 mL,称定质量, 超声30 min, 放冷, 再称定质量, 混合溶液补足减失质量, 摇匀, 过滤, 精密量取续滤液12.5 mL, 50 ℃水浴挥干, 残渣精密加入1.5 mL混合溶液溶解, 过滤, 取续滤液, 即得。
2.3.3 色谱条件 Inertsil ODS-SP 色谱柱(4.6 mm×250 mm, 5 μm); 流动相(乙腈-四氢呋喃) (A) -0.1 mol/L 乙酸铵(B), 梯度洗脱(0~22 min, 20% ~23% A; 22 ~40 min, 23% ~25%A); 体积流量1.0 mL/min; 柱温30 ℃; 检测波长235 nm。
2.3.4 线性关系考察 精密吸取对照品溶液2、4、 6、 8、 10、 12 μL, 以峰面积为纵坐标 (Y),进样量为横坐标(X) 进行回归, 得乌头碱、 新乌头碱、 次乌头碱方程分别为Y=824.18X +455.61(r=0.999 9)、 Y=1 014.1X-16 161 ( r=0.999 9)、Y= 1 089.5X-7 990.3 (r = 0.999 9), 分别在0.258~1.548、 0.322~2.254、 0.280 ~1.960 μg 范围内线性关系良好。
2.3.5 精密度试验 精密吸取同一对照品溶液,进样量10 μL, 连续测定6 次, 记录峰面积, 测得乌头碱、 新乌头碱、 次乌头碱峰面积RSD 分别为1.58%、 1.47%、 1.19%, 表明仪器精密度良好。
2.3.6 稳定性试验 按“2.3.2” 项下方法制备供试品溶液, 于0、 2、 4、 6、 12、 24 h 进样10 μL测定, 测得乌头碱、 新乌头碱、 次乌头碱峰面积RSD 分别为2.96%、 1.27%、 0.73%, 表明供试品溶液在24 h 内稳定性良好。
2.3.7 重复性试验 取同一批药母粉末6 份, 按“2.3.2” 项下方法制备供试品溶液, 进样10 μL测定, 测得乌头碱、 新乌头碱、 次乌头碱含有量RSD 分别为2.11%、 1.50%、 2.52%, 表明该方法重复性良好。
2.3.8 加样回收率试验 精密称取乌头碱、 新乌头碱、 次乌头碱对照品各0.66、 1.68、 2.12 mg 至10 mL 量瓶中, 甲醇稀释至刻度。 精密称定含有量已知的药母粉末约1.25 g, 共6 份, 加入对照品溶液0.5 mL, 按“2.3.2” 项下方法制备供试品溶液, 在“2.3.3” 项色谱条件下进样测定, 计算回收率。 结果, 乌头碱、 新乌头碱、 次乌头碱平均加样回收率 (RSD) 分别为98.64% (2.72%)、96.61% (1.15%)、 98.80% (1.91%)。
2.3.9 样品含有量测定 分别精密吸取对照品、供试品溶液各10 μL 进样测定, 计算含有量。
2.4 数据处理 采用SPSS 17.0 软件计算实验数据的平均值、 标准差、 变异系数和极差。 主成分和聚类分析采用DPS 7.0 软件, 各样本间的聚类距离为欧氏距离, 聚类采用离均差平方和法。
3 结果与分析
3.1 药母未发酵生物碱含有量 取未发酵药母3份, 按“2.3.2” 项下方法制备供试品溶液, 测定其中乌头碱、 新乌头碱、 次乌头碱含有量, 并计算其总和, 见表1。
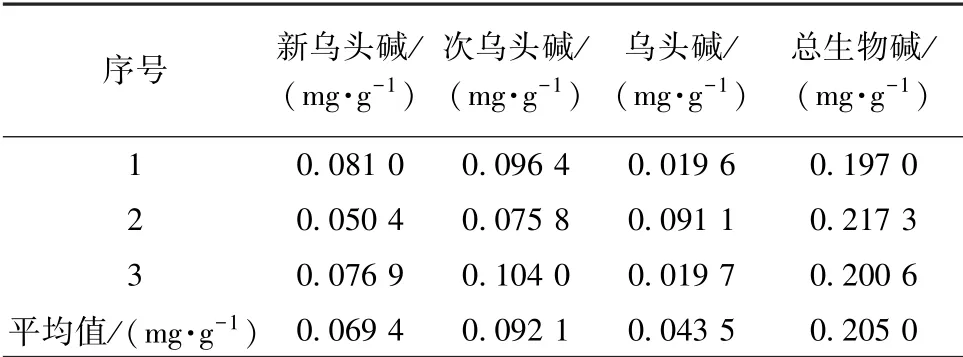
表1 未发酵药母中3 种双酯型生物碱含有量Tab.1 Contents of three kinds of diester-alkaloids in unfermented medicine
3.2 牛胆汁理化指标和双酯型生物碱含有量 测定牛胆汁密度、 pH 值、 总固体、 胆酸和双酯型生物碱含有量, 见表2。 药母经发酵4 周后, 新乌头碱、 次乌头碱、 乌头碱含有量均减少。
3.3 统计分析 药母中乌头碱(0~0.005 0 mg/g)、新乌头碱(0~0.024 3 mg/g)、 次乌头碱(0.011 5~0.066 5 mg/g)、 总生物碱(0.011 5~0.090 8 mg/g)及牛胆汁中总固体(0.037 7 ~0.194 1 g)、 胆酸(9.940 1~37.236 4 mg/mL) 差异较大, 变异系数分别 为 280.00%、 78.05%、 29.02%、 34.13%、48.83%、 30.77%; 胆汁密度(0.998 ~1.100 g/mL)和胆汁pH 值(6.27~7.29) 差异较小, 变异系数仅为2.14%、 4.55%。 见表3。
3.4 相关性分析 牛胆汁pH 值与胆汁密度、 胆酸含有量存在极显著正相关(P<0.01), 胆汁密度与胆酸含有量亦然(P<0.01); 胆酸含有量与次乌头碱、 乌头碱含有量存在显著负相关(P<0.05),胆汁的其他指标与双酯型生物碱含有量无显著相关性(P>0.05); 新乌头碱含有量与次乌头碱、 总生物碱含有量存在极显著正相关(P<0.01)。 见表4。
3.5 主成分分析 3 个主成分累计贡献率达78.589%, 其中主成分一贡献率最大, 为38.69%;
其次为二、 三, 贡献率分别为26.662%, 13.238%。见表5。
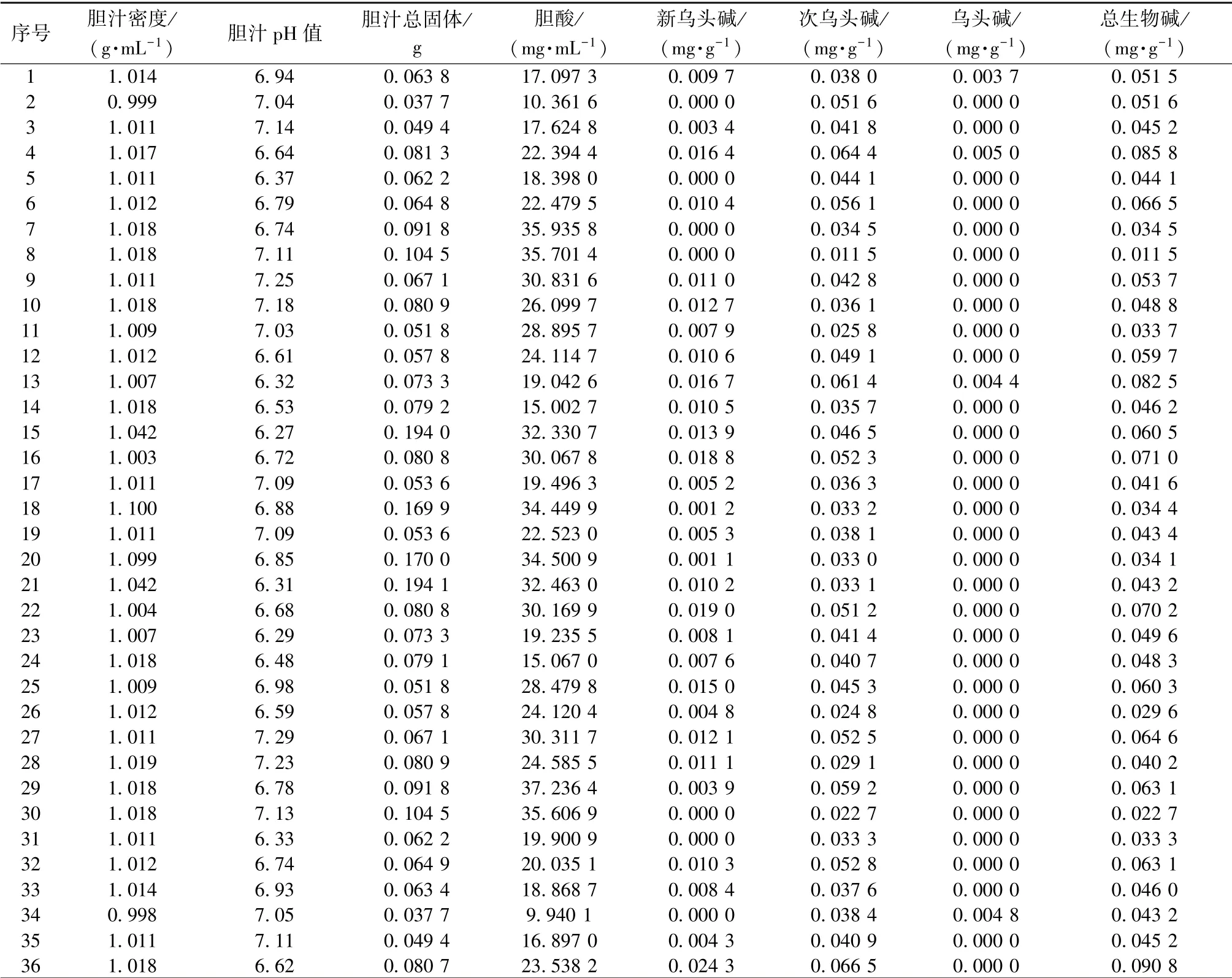
表2 牛胆汁及药母主要指标Tab.2 Main indices of cattle bile and medicine
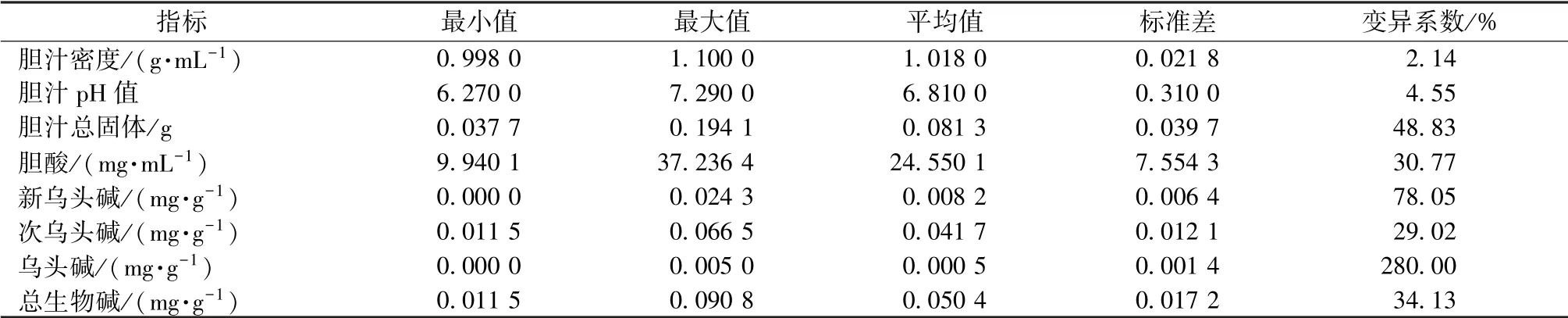
表3 牛胆汁及药母主要指标变化范围Tab.3 Variation ranges of main indices of cattle bile and medicine
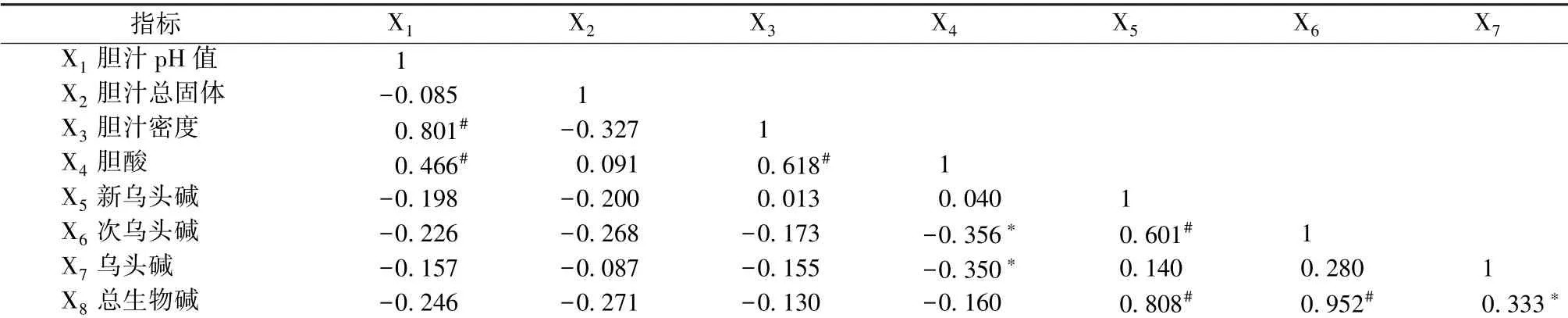
表4 牛胆汁及药母主要指标相关性分析Tab.4 Correlation analysis of main indices of cattle bile and medicine
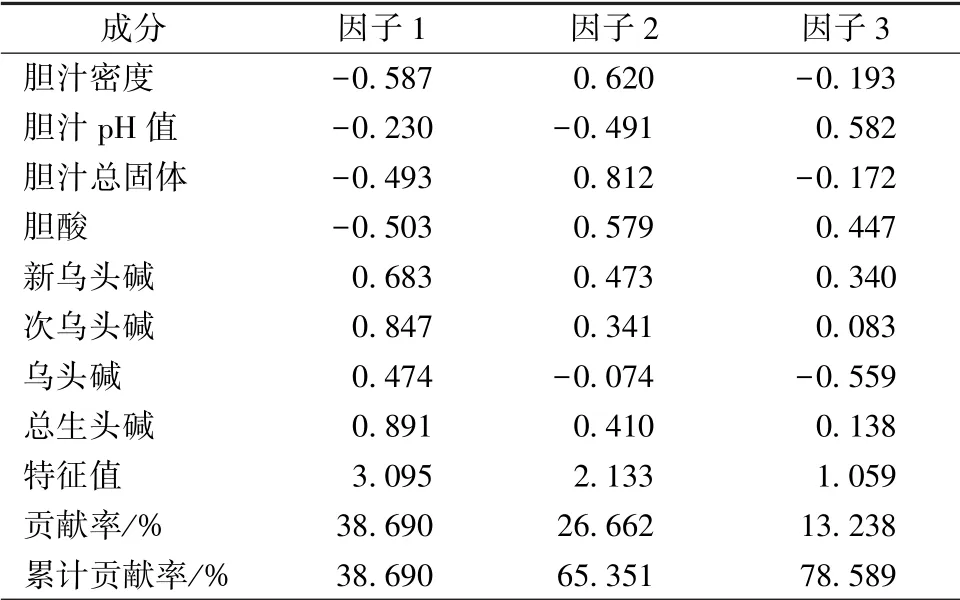
表5 牛胆汁及药母指标主成分分析Tab.5 Principal component analysis of main indices of cattle bile and medicine
第一主成分特征值3.095, 贡献率38.69%。在特征向量中, 载荷较高符号为正的指标有新乌头碱、 次乌头碱、 总生物碱, 其特征向量值分别为0.683、 0.847、 0.891, 所以因子1 可作为生物碱因子; 符号为负的有胆汁密度、 胆汁pH 值、 总固体和胆酸。
第二主成分特征值2.133, 贡献率26.662%。在特征向量中, 载荷较高符号为正的指标有胆汁密度、 总固体、 胆酸, 其特征向量值分别为0.620、0.812、 0.579, 所以因子2 可作为牛胆汁因子; 符号为负的有胆汁pH 值和总生物碱。
第三主成分特征值1.059, 贡献率13.238%。在特征向量中, 载荷较高符号为正的指标有胆汁pH 值、 胆 酸, 其 特 征 向 量 值 分 别 为 0.582、0.447, 所以因子3 可作为胆汁因子; 符号为负的有胆汁密度、 总固体和乌头碱。
3.6 聚类分析 在聚类距离35 处将样品聚为3 大类群, 见图1, 又有不同的亚类(在此不作细分)。各类群的平均值和变幅见表6。
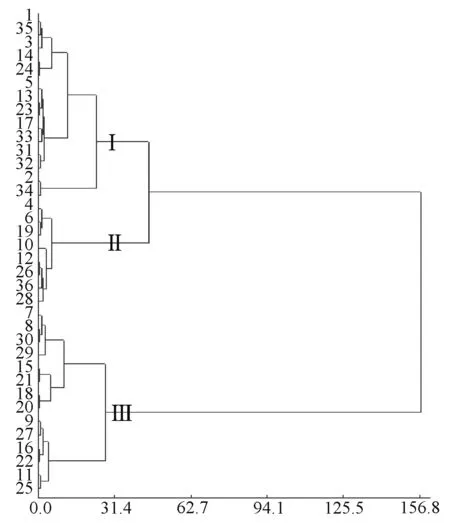
图1 各样品树状图Fig.1 Dendrogram of various samples
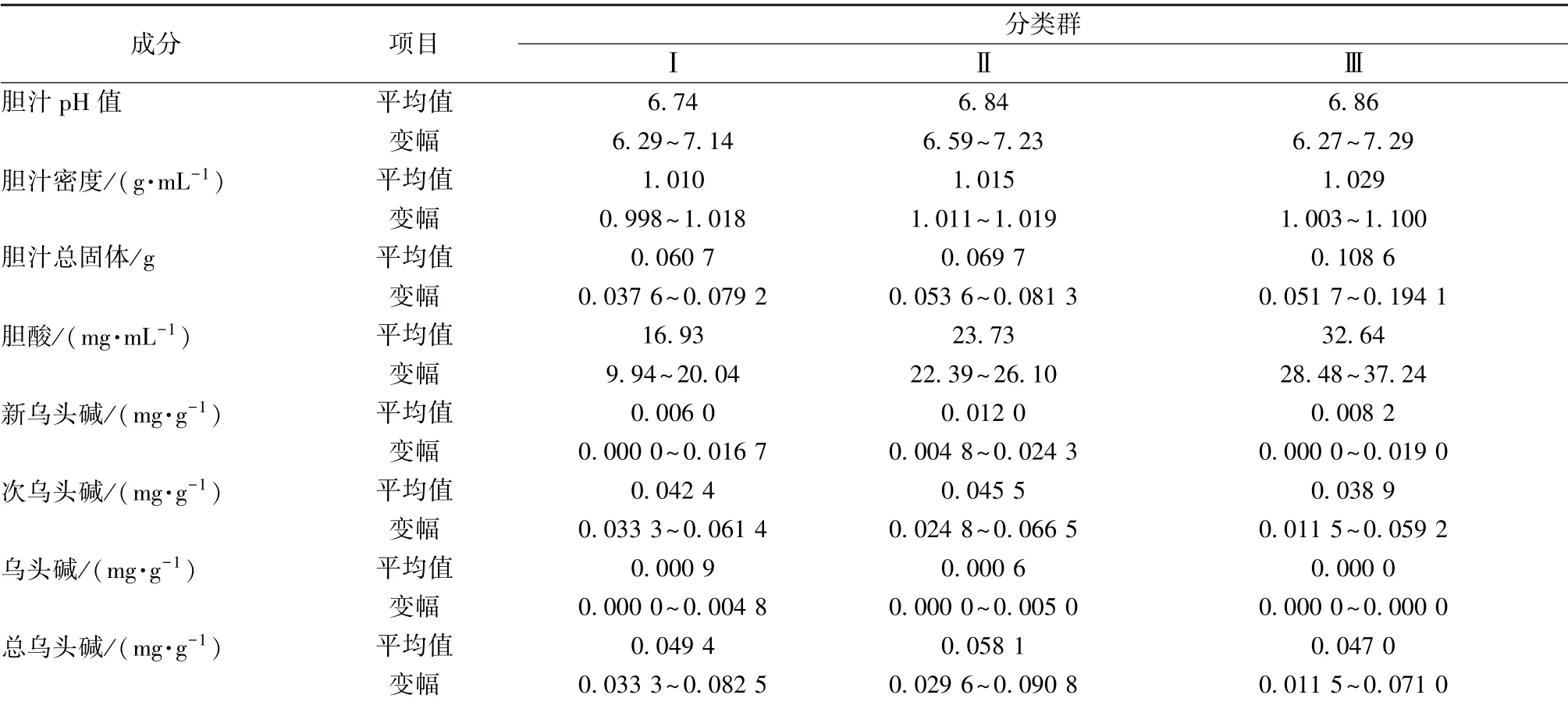
表6 牛胆汁及药母指标各类群特征Tab.6 Characteristics of various groups of cattle bile and medicine
第一类群包含14 份材料, 主要特征是胆汁pH值6.74、 密度1.010 g/mL、 总固体0.060 7 g、 胆酸16.93 mg/mL; 新乌头碱0.006 0 mg/g、 次乌头碱0.042 4 mg/g、 乌头碱0.009 mg/g、 总生物碱0.049 4 mg/g。 其中胆汁pH 值、 密度、 总固体、胆酸含有量在3 个类群中最小; 药母中双酯型生物碱含有量分别为新乌头碱含有量在3 个类群中最小, 乌头碱含有量最大, 次乌头碱、 总生物碱含有量处于中间位置。
第二类群包含8 份材料, 主要特征是胆汁pH值6.84、 密度1.015 g/mL、 总固体0.069 7 g、 胆酸23.73 mg/mL; 新乌头碱0.012 0 mg/g、 次乌头碱0.045 5 mg/g、 乌头碱0.000 6 mg/g、 总生物碱0.058 1 mg/g。 其中胆汁pH 值、 密度、 总固体、胆酸含有量在3 个类群中排在中间位置; 药母中双酯型生物碱含有量分别为新乌头碱、 次乌头碱、 总生物碱含有量在3 个类群中最大, 乌头碱含有量处于中间位置。
第三类群包含14 份材料, 主要特征是胆汁pH值6.86、 密度1.029 g/mL、 总固体0.108 6 g、 胆酸32.64 mg/mL; 新乌头碱0.008 2 mg/g、 次乌头碱0.038 8 mg/g、 乌头碱0.000 0 mg/g、 总生物碱0.047 0 mg/g。 其中胆汁pH 值、 密度、 总固体、胆酸含有量在3 个类群中最大; 药母中双酯型生物碱含有量分别为新乌头碱含有量处于中间位置, 次乌头碱、 乌头碱、 总生物碱含有量在3 个类群中最小。
由此可知, 第三类群双酯型生物碱含有量较低, 适宜化风丹药母的发酵。 胆汁pH 值范围6.27~7.29, 密度范围1.003 ~1.100 g/mL, 总固体范围0.051 7 ~0.194 1 g, 胆酸范围28.48 ~37.24 mg/mL。
4 讨论与结论
化风丹药母中川乌、 半夏、 天南星、 白附子均有毒, 其中川乌毒性最大, 采用自然发酵时可降低药母毒性。 文献报道, 化风丹药母药用真菌对川乌、 草乌进行发酵时可明显降低乌头碱、 新乌头碱、 次乌头碱含有量[12-13]; 本研究结果表明, 化风丹药母经过发酵后, 川乌中3 种双酯型生物碱乌头碱、 新乌头碱、 次乌头碱含有量降低。 发酵实际上是生物转化的过程, 微生物在生长代谢时产生丰富的酶, 如淀粉酶、 纤维素酶、 蛋白酶等, 能产生多种反应, 分解转化原料中特定的底物, 生成新的活性成分, 同时产生丰富的次级代谢产物, 起到增效减毒作用。
化风丹药母加入牛胆汁进行发酵时, 后者对药双酯型生物碱含有量降低发挥着一定作用, 胆酸含有量与次乌头碱、 乌头碱含有量存在显著负相关(P<0.05), 而胆酸含有量与胆汁pH 值存在极显著正相关(P<0.01), 推测在发酵过程中胆汁pH值可能对药母毒性成分有较大影响, 作用机制有待进一步研究。 本实验揭示了化风丹药母在发酵过程中牛胆汁理化指标、 双酯型生物碱含有量的变化规律及两者相关性, 为相关辅料选用提供依据。

