高效液相色谱法测定牛黄解毒片中胆酸和猪去氧胆酸的含量及其质量分析
陈小红,陈广云
(淮安市食品药品检验所,江苏淮安 223001)
牛黄解毒片具有清热解毒的功效,是临床常用的一味中药,用于火热内盛,咽喉肿痛,牙龈肿痛,口舌生疮,目赤肿痛。牛黄解毒片由人工牛黄﹑雄黄﹑石膏﹑大黄﹑黄芩﹑桔梗﹑冰片及甘草八味药材组成,其中人工牛黄具有清热解毒,化痰定惊的功效。人工牛黄由牛胆粉﹑胆酸﹑猪去氧胆酸﹑牛磺酸﹑胆红素﹑胆固醇﹑微量元素等加工制成[1]。胆酸是一种有机酸,对于支气管炎和慢性支气管炎有一定的治疗效果,可以保护患者的胃肠道黏膜,防止黏膜受损还可以降低血脂,治疗高血脂,缓解胆囊炎等作用。猪去氧胆酸是一种有机化合物,是从猪胆汁中提取的一种胆烷酸,具有治疗胆道炎,胆囊炎,胆石症和其它非阻塞性胆汁淤积的功效,还能够促进肠道脂肪分解和脂溶性维生素吸收,同时可以降低血中的胆固醇,治疗﹑预防冠心病和高血压,因此测定牛黄解毒片中胆酸和猪去氧胆酸的含量具有重要意义。
目前对牛黄解毒片中胆酸﹑猪去氧胆酸的研究采用双波长薄层扫描法,此方法操作方便﹑设备简单﹑显色容易,展开速率快,但有时分离效果不理想,结果不准确,重现性较差。《中国药典》2020 年版牛黄解毒片只分析了黄芩苷的含量,并没有考察胆酸﹑猪去氧胆酸的含量。不同厂家﹑不同批次的牛黄解毒片所用人工牛黄的品质有差异,进而造成胆酸及猪去氧胆酸的含量有差异,笔者采用HPLC(高效液相色谱)法,蒸发光散射检测器检测,测定牛黄解毒片中胆酸[2–8]和猪去氧胆酸[9–14]的含量,通过其两者之和来评价牛黄解毒片质量的分类情况。该方法简单,重复性好,结果准确,适用于测定胆酸和猪去氧胆酸的含量,从而达到控制牛黄解毒片的质量,为临床用药提供指导性建议。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Aglient 1260 型,OpenLAB工作站,安捷伦科技(中国)有限公司。
数控超声波清洗器:KH7200DE 型,昆山市禾创超声仪器有限公司。
超纯水机:ELGA PureLab Classic 型,英国埃尔格公司。
电子天平:(1)XSDU205 型,感量为0.01 mg,(2)XP6 型,感量为0.001 mg,瑞士梅特勒–托利多仪器公司。
胆酸对照品:批号为100078–201415,质量分数为98.9%,中国食品药品检定研究院。
猪去氧胆酸对照品:批号为100087–200610;质量分数为97.3%,中国食品药品检定研究院。
甲醇﹑乙腈:色谱纯,德国默克公司。
甲酸:分析纯,国药集团化学试剂有限公司。
牛黄解毒片样品:批数为60,样品编号为1~60,市售。
1.2 色谱条件
色 谱 柱:Welch Ultimate LP–C18柱(250 mm×4.60 mm,5 µm,Welch 公司);流动相:甲醇–乙腈–0.1%甲酸溶液(体积比为63∶17∶20);检测器:蒸发光散射检测器;流量:0.8 mL/min;柱温:30℃;进样体积:20 µL。
1.3 对照品混合溶液的制备
精密称取胆酸对照品2.586 mg﹑猪去氧胆酸对照品2.505 mg,置于10 mL 容量瓶中,加甲醇溶解并稀释至标线,摇匀,配成胆酸﹑猪去氧胆酸质量浓度分别为0.258 6﹑0.250 5 mg/mL 的对照品混合溶液。
1.4 样品溶液制备
取样品20 片,精密称定,研细,精密称取适量(约相当于人工牛黄16.5 mg),置于25 mL 容量瓶中,加甲醇适量,超声处理30 min(功率为500 W,频率为40 kHz),放冷,用甲醇稀释至标线,摇匀,用微孔滤膜过滤,取续滤液作为样品溶液。
2 结果与讨论
2.1 系统适应性试验
精密吸取对照品溶液5 µL,样品溶液20 µL,按1.2 色谱条件分别进样测定,对照品混合溶液﹑样品溶液色谱图如图1﹑图2 所示。
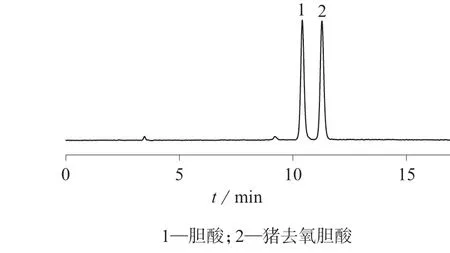
图1 对照品混合溶液色谱图

图2 样品溶液色谱图
结果表明,对照品混合溶液﹑样品溶液中胆酸﹑猪去氧胆酸分离度均大于2.0,拖尾因子分别为1.02﹑1.03,理论板数按胆酸﹑猪去氧胆酸计均大于6 000,系统适应性试验符合要求。
2.2 提取条件选择
以编号为6 的牛黄解毒片样品为待测对象,以甲醇﹑乙醇﹑60%甲醇溶液﹑65%乙醇溶液四种溶剂提取胆酸﹑猪去氧胆酸,结果表明,提取溶剂为甲醇时,效果最好,故选用甲醇为提取溶剂。以甲醇为提取溶剂,分别采用回流法﹑超声法提取胆酸﹑猪去氧胆酸,结果表明,两者提取效果相当,但回流法需要时间较长,超声法所用时间较短且操作简便,故选用超声法提取样品。将样品分别置25 mL﹑50 mL 容量瓶中提取,比较不同体积的提取效果,发现并无显著性差异,本着节约试剂﹑节约成本的原则,提取溶剂体积选择25 mL。考察样品提取时间30 min﹑1 h,两者提取色谱峰面积接近,表明30 min 提取完全,故选择超声时间30 min。
2.3 色谱条件优化
分别考察甲醇–乙腈–0.1%甲酸溶液(体积比为68∶17∶15)﹑甲醇–乙腈–0.1%甲酸溶液(体积比为68∶12∶20)﹑甲醇–乙腈–0.1%甲酸溶液(体积比为65∶14∶21)﹑甲醇–乙腈–0.1%甲酸溶液(体积比为63∶17∶20)四种流动相体系。结果发现,以甲醇–乙腈–0.1%甲酸溶液(68∶17∶15)为流动相时,胆酸﹑猪去氧胆酸出峰时间较快,胆酸﹑猪去氧胆酸分离度为1.1;以甲醇–乙腈–0.1%甲酸溶液(68∶12∶20)为流动相时,两个色谱峰的拖尾因子分别为1.1﹑1.2;以甲醇–乙腈–0.1%甲酸溶液(65∶14∶21)为流动相时,胆酸﹑猪去氧胆酸色谱峰交叉重叠,不能达到基本分离;以甲醇–乙腈–0.1%甲酸溶液(63∶17∶20)为流动相时,胆酸﹑猪去氧胆酸色谱峰分离良好,拖尾因子在规定范围内,理论板数均大于6000,且保留时间适中,故选用甲醇–乙腈–0.1%甲酸溶液(63∶17∶20)为流动相。
2.4 线性方程与检出限
精密吸取1.3 中对照品溶液2﹑5﹑8﹑10﹑15﹑20µL,注入液相色谱仪,在1.2 色谱条件下测定色谱峰面积,以色谱峰面积的对数Y为纵坐标,胆酸﹑猪去氧胆酸质量的对数(X)为横坐标,绘制工作曲线,计算线性方程和相关系数。用甲醇不断稀释对照品混合溶液,在1.2 色谱条件下测定,以S/N为3 时对照品浓度为检出限。胆酸﹑猪去氧胆酸的线性方程﹑线性范围﹑相关系数及检出限见表1。

表1 胆酸、猪去氧胆酸的线性方程、线性范围、相关系数及检出限
2.5 精密度试验
精密称取60 号样品(约相当于人工牛黄16.5 mg)6 份,按1.4 方法制备样品溶液,在1.2 色谱条件下测定,结果见表2。由表2 可知,胆酸﹑猪去氧胆酸质量浓度测定结果的相对标准偏差分别为0.4%﹑0.7%,表明该方法精密度良好。
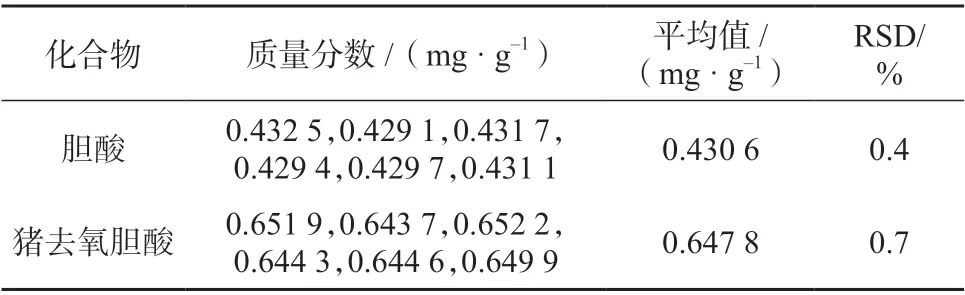
表2 精密度试验结果
2.6 稳定性试验
分别于0﹑2﹑4﹑8﹑10﹑12 h测定对照品混合溶液,测定胆酸﹑猪去氧胆酸峰面积,结果见表3。由表3可知,胆酸﹑猪去氧胆酸峰面积的相对标准偏差分别为0.4%﹑0.6%,表明对照品混合溶液在12 h 内稳定。

表3 稳定性试验
2.7 准确度试验
精密称取6 号样品细粉(约相当于人工牛黄16.5 mg)6 份,分别置于50 mL 量瓶中,精密加入等量的胆酸﹑猪去氧胆酸对照品,按1.4 方法制备样品溶液,在1.2 色谱条件下测定,进行加标回收试验,结果见表4。
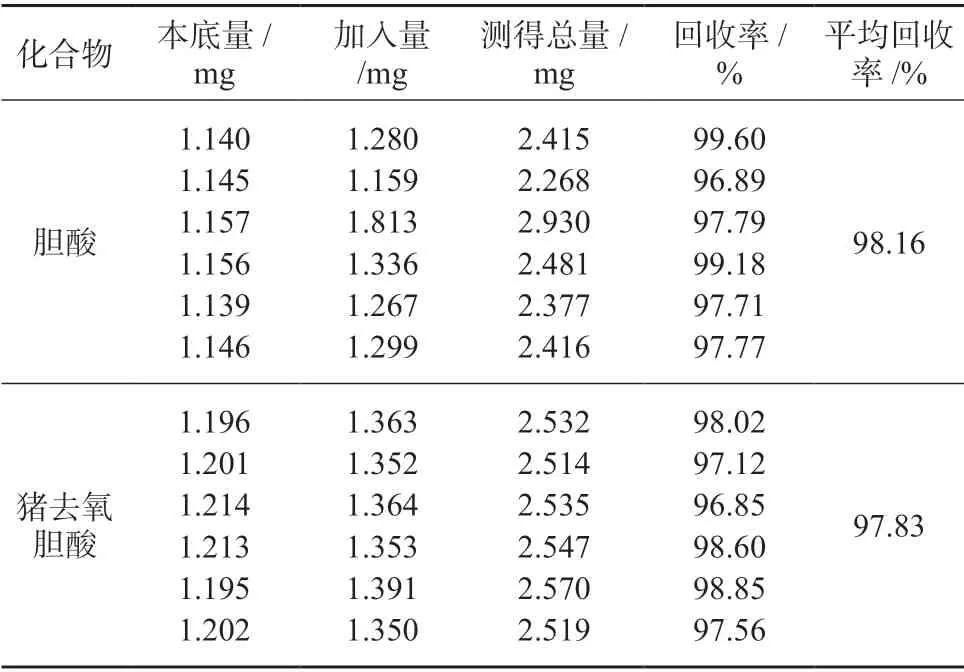
表4 准确度试验
由表4 可知,胆酸﹑猪去氧胆酸平均回收率分别为98.16%﹑97.83%,说明该方法具有较高的准确度。
2.8 样品测定
取60 批牛黄解毒片样品,按1.4 方法制备样品溶液,在1.2 色谱条件下测定,结果见表5。
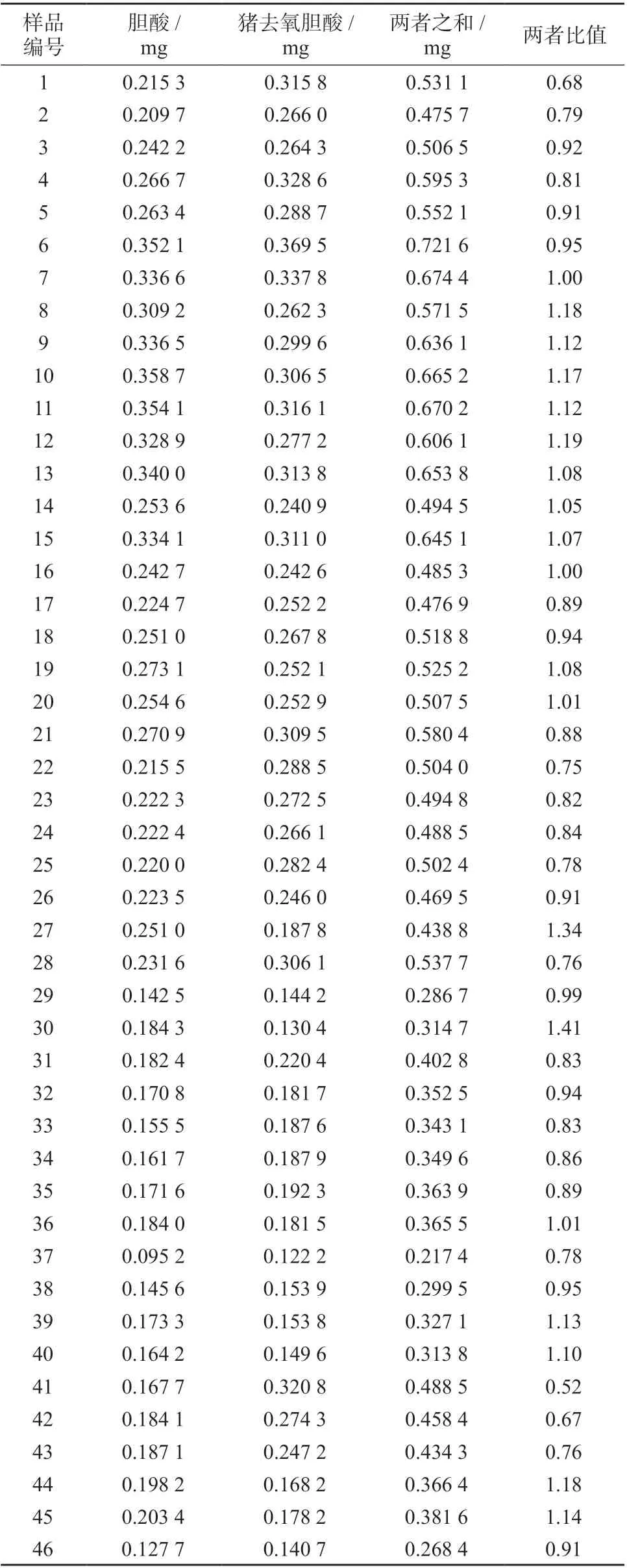
表5 每片牛黄解毒片中胆酸、猪去氧胆酸的含量测定结果

续表5
由表5 可知,牛黄解毒片中胆酸﹑猪去氧胆酸总量为0.2174 ~0.721 6 mg/片,不同厂家﹑不同批号的牛黄解毒片所含两者总量差异较大,胆酸与猪去氧胆酸的比值也存在一定的差异。
3 质量分析
对60 批牛黄解毒片中所含胆酸﹑猪去氧胆酸及两者之和,通过SPSS 22.0 版软件进行系统聚类分析。采用平方Euclidean 距离法,计算不同样品间的相似度,聚类分析结果见图3。
由图3 可知,60 批牛黄解毒片样品整体聚为一类,考虑到其差异性较大,大致分为四类:一类包括编号为1,2,3,4,5,8,12,14,16,17,18,19,20,21,22,23,24,25,26,28,41,42,58 的23 批样品;二类包括编号为6,7,9,10,11,13,15 的7 批样品;三类包括编号为29,30,37,38,39,40,46,47,48,49 的10 批样品;四类包括编号为27,31,32,33,34,35,36,43,44,45,50,51,52,53,54,55,56,57,59,60 的20 批样品。
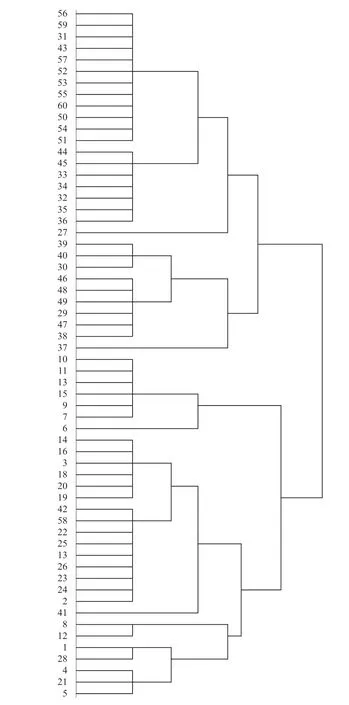
图3 聚类分析树状图
对60 批牛黄解毒片样品中所含胆酸﹑猪去氧胆酸两者比值,通过SPSS 22.0 版软件进行K平均值聚类分析。采用比值平均值法,考察不同厂家﹑不同批次样品间的差异,K平均值聚类分析结果见表6。
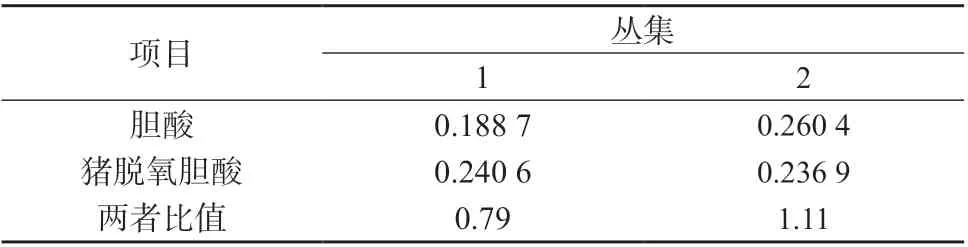
表6 最终丛集中心
60 批牛黄解毒片样品大体分为两类:一类胆酸﹑猪去氧胆酸比值均值为0.79,有38 批样品;二类胆酸﹑猪去氧胆酸比值均值为1.11,有22 批样品;表明这两类样品所用人工牛黄存在一定的差异性。
4 结论
(1)文献中胆酸﹑猪去氧胆酸含量的测定基本采用薄层扫描法,此方法存在一定的缺点,故在参考相应资料[15–16]后采用HPLC–ELSD 法测定其含量,该方法操作简便,准确度高,可有效控制牛黄解毒片的质量。
(2)不同厂家﹑不同批号的牛黄解毒片中含胆酸及猪去氧胆酸总量存在较大差异,可能与其所用人工牛黄品质及生产工艺有相应关系。
(3)人工牛黄中胆酸与猪去氧胆酸的比值是一定的,每个厂家胆酸与猪去氧胆酸的比值不尽相同,可能合成人工牛黄时胆酸与猪去氧胆酸的投料有一定的差异,影响了人工牛黄的质量,进而影响牛黄解毒片的质量。

