胆南星中胆酸类成分含量测定及发酵前后含量比较△
刘晓峰,崔亚晨,单国顺,许枬,高慧
辽宁中医药大学 药学院,辽宁 大连 116600
胆南星为制天南星的细粉与牛、羊或猪胆汁经加工而成,或为生天南星细粉与牛、羊或猪胆汁经发酵加工而成[1]。炮制能缓和天南星燥烈之性,降低毒性,转变药性,性由温转凉,味由辛转苦,功能也由温化寒痰转为清化热痰,即所谓相畏为制、生毒熟减、以寒制热[2]。课题组通过市场及生产企业的走访调研,了解到因为缺少相应的质控指标,胆南星发酵工艺不规范,发酵时间从24 h至数月不等,所用胆汁多为猪胆汁(或猪胆膏),胆汁用量相差数倍,产品质量参差不齐,故急需建立胆南星的质控标准,改善胆南星当前所存在的一些问题[3]。
关于胆南星含量测定的方法有一些报道[3-7],但因炮制机理不清,所选指标未体现出与质量控制的相关性。课题组前期研究发现,胆南星发酵后结合型胆酸转化为游离型胆酸,如甘胺猪胆酸、牛磺猪胆酸转化为猪胆酸;甘胺猪去氧胆酸、牛磺猪去氧胆酸转化为猪去氧胆酸;甘胺鹅去氧胆酸、牛磺鹅去氧胆酸转化为鹅去氧胆酸。因此足够的发酵时间和充足胆汁量是几种游离型胆酸含量的保证,本文建立猪胆酸、猪去氧胆酸、鹅去氧胆酸3个增量成分的含量测定方法,为胆南星发酵原理、工艺规范化研究提供参考。
1 材料
Waters Acquity Arc高效液相色谱仪;奥泰2000蒸发光散射检测器;KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);MettLer AE240型十万分之一分析天平;HWS-080恒温恒湿箱(上海精宏实验设备有限公司)。
猪去氧胆酸对照品(中国食品药品检定研究院,批号:100087-200610,纯度97.3%);鹅去氧胆酸对照品(中国食品药品检定研究院,批号:110806-201105,纯度99.2%);猪胆酸(自制,纯度99.3%);甲醇(色谱纯,天津市康科德科技有限公司);乙腈(色谱纯,美国TEDIA公司);重蒸水;其他试剂为分析纯;猪胆购自大连础明肉联厂。
东北天南星采自辽宁本溪市,经辽宁省药品检验检测院王维宁教授鉴定为天南星科植物东北天南星ArisaemaamurenseMaxim.的干燥块茎,按照《中华人民共和国药典》中天南星项下检测方法,测得水分(8.22%),总灰分(4.5%),浸出物质量分数(27.78%),总黄酮质量分数(0.32%),均符合《中华人民共和国药典》标准。
自制胆南星样品:取东北天南星细粉(过五号筛)与猪胆汁(经绢布滤过)约1∶1比例混合,置30~35 ℃,70%~80%的恒温恒湿培养箱中发酵15~20 d取出,至蒸制容器中蒸1 h至透,趁热切成1.5~2 cm的小块,晒至黑褐色,即得。
其余为10批市售商品胆南星样品见表1。

表1 胆南星样品信息
2 方法与结果
2.1 混合对照品制备
取猪胆酸、猪去氧胆酸、鹅去氧胆酸对照品适量,精密称定,加甲醇分别制成质量浓度为0.16、0.19、0.32 mg·mL-1的混合对照品溶液。
2.2 供试品溶液的制备
取胆南星粉末(过五号筛)约0.5 g,精密称定,置50 mL量瓶中,加入甲醇40 mL,超声处理(功率200 W,频率40 kHz)50 min,放至室温,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.3 色谱条件
色谱柱为Waters C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.5%冰乙酸溶液(60∶40);流速:1.0 mL·min-1;漂移管温度:105 ℃;气体流速:3.0 L·min-1;柱温为30 ℃;对照品进样体积为5、20 μL;样品进样量为5 μL,按上述条件进行测定。色谱图见图1。

注:A.胆酸混合对照品;B.自制胆南星样品;1.猪胆酸;2.猪去氧胆酸;3.鹅去氧胆酸。图1 胆酸混合对照品自制胆南星样品色谱图
2.4 方法学考察
2.4.1 线性关系的考察 用移液器分别精密吸取2.1项下混合对照品溶液0.2、0.3、1、2、6、8 mL,置于10 mL量瓶中,色谱甲醇稀释至刻度,摇匀,得6个系列浓度的混合对照品溶液。在2.3色谱条件下分别进样10 μL,以各成分的进样量(μg)的对数为横坐标(X),色谱峰面积的对数为纵坐标(Y),得回归方程:猪胆酸为Y=1.550 4X+6.059 0,r=0.999,结果表明,猪胆酸对照品进样量在0.032~1.28 μg线性关系良好。猪去氧胆酸为Y=1.449 3X+5.356,r=0.999,结果表明,猪去氧胆酸对照品进样量在0.038~1.52 μg线性关系良好。鹅去氧胆酸为Y=1.614 6X+5.660 3,r=0.999,结果表明,鹅去氧胆酸对照品进样量在0.064~2.56 μg线性关系良好。
2.4.2 精密度试验 吸取同一供试品溶液5 μL,连续进样6次,测定峰面积,RSD值分别为0.86%、1.4%、0.9%,表明精密度良好。
2.4.3 稳定性试验 吸取同一供试品5 μL,在0~24 h内进样,测定峰面积,RSD值分别为2.15%、1.90%、2.10%,结果表明,样品溶液在所考察时间内稳定性良好。
2.4.4 重复性试验 取同一批供试品(自制胆南星),精密称取6份,按同样方法操作,测得猪胆酸、猪去氧胆酸、鹅去氧胆酸的平均质量分数分别为2.212 0、8.413 3、9.104 2 mg·g-1,RSD值分别为2.60%、2.20%、2.80%,结果表明,该方法重复性良好。
2.4.5 加样回收率试验 取同一批供试品(自制胆南星),精密称取6份,每份约0.25 g,精密称定,至25 mL容量瓶,分别精密加入猪胆酸对照品溶液(0.660 6 mg·mL-1,纯度99.3%)1.0 mL、猪去氧胆酸(1.105 4 mg·mL-1,纯度97.3%)1.8 mL、鹅去氧胆酸(0.488 9 mg·mL-1,纯度99.2%)5 mL及甲醇溶液12 mL,超声处理(功率200 W,频率40 KHz)50 min,放至室温,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。测定加标样品中的猪胆酸、猪去氧胆酸、鹅去氧胆酸含量,结果见表2~4。
2.4.6 耐用性试验 吸取同一供试品溶液5 μL,按同法操作,分别考察了不同柱温(25、30、35 ℃)、不同流动相比例(乙腈占比50%、55%、60%)以及不同品牌色谱柱(waters和Ecosil),结果猪胆酸、猪去氧胆酸、鹅去氧胆酸色谱峰与其他组分可得到基线分离,表明该方法耐用性良好,见色谱图2~4。

表2 猪胆酸回收率试验结果(n=6)
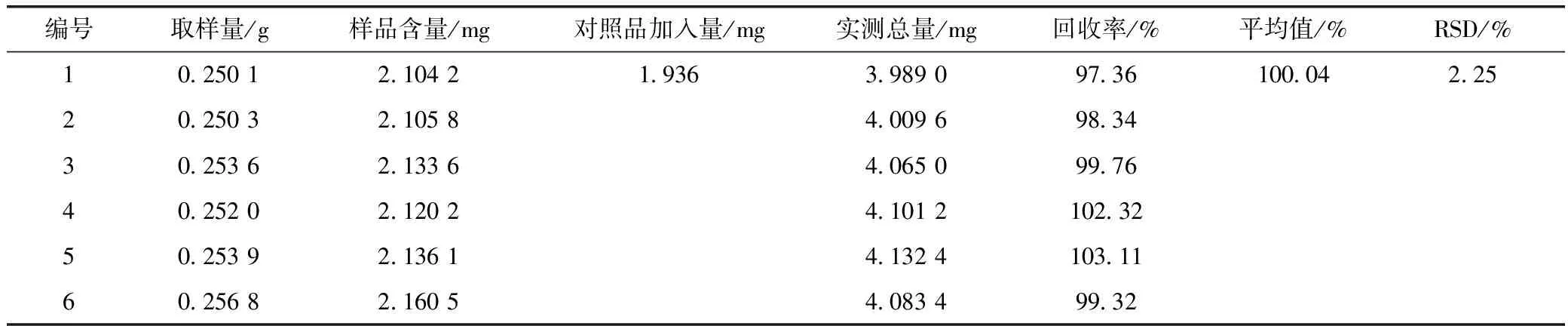
表3 猪去氧胆酸回收率试验结果(n=6)

表4 鹅去氧胆酸回收率试验结果(n=6)

注:A.25 ℃;B.30 ℃;C.35 ℃。图2 胆南星不同检测柱温色谱图

注:A.乙腈占比50%;B.乙腈占比55%;C.乙腈占比60%。图3 胆南星不同流动相比例检测色谱图

A.Waters C18色谱柱;B.Ecosil C18色谱柱。图4 胆南星不同色谱柱检测色谱图
2.4.7 检测限 应用《中华人民共和国药典》第四部检测限中方法1直观法可知,猪胆酸、猪去氧胆酸、鹅去氧胆酸的检测限分别为0.037 6、0.044、0.040 μg,所建立含量测定方法符合检测限要求。
2.4.7 样品含量测定 取胆南星样品,精密吸取对照品溶液,按同样项下方法操作,测得猪胆酸、猪去氧胆酸、鹅去氧胆酸的含量。

表5 胆南星样品含量测定结果 mg·g-1
注:“—”表示未检测到。
3 讨论
3.1 胆酸类含量测定方法的建立
本实验考察了不同提取时间(20、30、40、50、60 min),不同流动相比例(乙腈占比50%、55%和60%),不同柱温(25、30、35 ℃)以及不同品牌色谱柱(waters和Ecosil)对于胆南星不同样品胆酸类成分的影响。结果表明,提取50 min时猪胆酸、猪去氧胆酸、鹅去氧胆酸样品提取含量基本稳定且含量较高。乙腈占比50%、55%和60%均能使猪胆酸、猪去氧胆酸、鹅去氧胆酸色谱峰与其他组分可得到基线分离,为节省时间,本实验选择乙腈占比60%进行。柱温考察时,综合待测物峰面积及对色谱柱的影响,最终选择柱温为30 ℃。本法操作简单,所选指标与胆南星质量密切相关,可用于胆南星发酵工艺及质量的评价。
3.2 胆南星含量检测结果分析
在调研中了解到,部分厂家存在发酵时间短(24 h)、胆汁加入量差异较大等问题。调研结果与本实验结果相符,即不同厂家的胆南星样品中几种胆酸类成分含量相差较大,部分样品未检测到游离型胆酸类成分(结合型胆酸未转化或转化不完全,以致游离型胆酸含量过低)。由此可见,本研究建立的游离型胆酸含量测定的方法能够反映发酵周期、胆汁加入量,可以评价胆南星的质量。
3.3 胆南星炮制原理研究
胆南星发酵工艺不规范、缺少科学有效的控制指标等问题,均源于胆南星的发酵机理不清楚。为此,课题组前期做了天南星、胆南星的多成分对比,包括胆酸类成分、总黄酮、总糖、夏佛托苷、腺苷等核苷类成分[8],其中胆南星发酵前后胆酸类成分有明显的变化规律,即发酵后结合型胆酸转变为游离型胆酸,且游离型胆酸的含量与发酵时间、胆汁加入量密切相关,可用于胆南星的质量控制。
本文以几种增量的游离型胆酸成分为检测指标,建立高效液相-蒸发光散射检测器(HPLC-ELSD)的含量测定方法,可为胆南星发酵工艺的规范化、胆南星质量的控制等提供依据。在今后的研究中,将对天南星中成分(如总黄酮、糖类)在发酵前后的变化予以关注,以期更好地阐释胆南星的发酵原理。

