巴氏杀菌和超巴氏杀菌对牛乳清蛋白结构及热稳定性的影响
王喜波,张安琪,王玉莹,崔 强,周国卫,王 琳
巴氏杀菌和超巴氏杀菌对牛乳清蛋白结构及热稳定性的影响
王喜波,张安琪,王玉莹,崔 强,周国卫,王 琳
(东北农业大学食品学院,哈尔滨 150030)
为了研究巴氏杀菌与超巴氏杀菌处理对牛乳清蛋白结构的影响,采用热力学和光谱学等方法测定乳清蛋白结构及稳定性。红外光谱分析结果显示巴氏杀菌处理对乳清蛋白二级结构影响不显著,而经超巴氏杀菌处理后的乳清蛋白中-螺旋结构含量显著减少,无规则卷曲结构含量显著增多,结构转变的更为无序,其稳定性更好;荧光光谱分析结构表明经121 ℃、5 s超巴氏杀菌处理的乳清蛋白样品发生红移,说明超巴氏杀菌改变了乳清蛋白二级和三级结构;差示扫描量热法分析结果显示121 ℃、5 s热处理的乳清蛋白样品热变性温度为99.9 ℃,高于巴氏杀菌处理的乳清蛋白样品,表明超巴氏杀菌处理后的乳清蛋白样品的稳定性显著提高,期望为制备高品质乳提供理论基础。
热处理;结构分析;热性能;巴氏杀菌;超巴氏杀菌;乳清蛋白
0 引 言
牛乳中乳清蛋白较酪蛋白对热处理更敏感、更易发生变性,牛乳在加工过程中通常采用热处理控制微生物生长。国内外常用的巴氏杀菌方法主要有2种[1]:第一种方法是将原料乳加热到62~65 ℃,持续30 min,称低温长时灭菌法,能够杀灭原料乳中生长型致病菌,灭菌率高达97.3%~99.9%[2];第二种方法是将牛乳加热到72~85 ℃,持续15 s,称高温短时灭菌法,能够将全部的病原微生物杀死,但是也会造成少量营养成分的损失以及风味的改变[3]。还有一种热处理方法被称为超巴氏杀菌[4],即采用120~125 ℃,处理数秒,其温度超过巴氏杀菌的温度低于超高温瞬时灭菌温度。超巴氏杀菌是一种延长货架期的技术,它最大可能的避免了加工和再包装过程的污染[5],其杀菌效果达到99%以上,可以有效控制乳中的微生物指标[6],并且经过感官和仪器分析表明超巴氏杀菌牛奶具有明显的煮熟和硫磺味道[7];Lee等[8]研究不同热处理条件对液态奶感官知觉的影响,表明低温短时巴氏杀菌处理的牛奶比超巴氏杀菌牛奶具有更低的烹饪风味;Bogahawaththa等[9]研究了脱脂乳的高压处理对乳清蛋白结构的影响,并表明高温长时巴氏杀菌处理对乳蛋白变性影响较小;Jiang等[10]研究热处理对聚合乳清蛋白浓缩物和聚合乳清蛋白分离物的理化和乳化性能的影响,并通过测定乳清蛋白的黏度、乳化性及理化性质比较两种蛋白的乳化能力和稳定性。目前,国内外关于超巴氏杀菌处理对牛乳乳清蛋白的结构和热稳定性研究鲜有报道,本文以新鲜牛乳为原料,以巴氏杀菌为对照,研究超巴氏杀菌热处理后乳清蛋白的结构及其热稳定性变化,为高品质乳制品生产提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜牛乳(当天产),哈尔滨本地奶站;考马斯亮蓝,甘油,十二烷基磺酸钠(SDS, sodium dodecyl sulfate),-巯基乙醇,牛血清白蛋白(BSA, bovine albumin),美国通用公司;其他化学试剂均为分析纯。
1.2 主要仪器设备
EPS601凝胶电泳仪,美国伯乐公司;Nicolet 6700傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;PE Pyris 6差示扫描量热仪,美国PerkinElmer公司;J-815圆二色谱仪,日本佳司科公司;F-4500荧光分光光度计,日本日立公司;Zetasizer Nano S90纳米粒度测定仪,马尔文仪器公司等。
1.3 试验方法
1.3.1 脱脂乳的制备及热处理
将新鲜牛奶进行离心脱脂,离心条件为:4 ℃、4 000 r/min离心30 min,然后弃去上层脂肪,得到脱脂乳。未经过热处理的脱脂乳作为对照组,将脱脂乳样品放于水浴锅中进行低温长时巴氏杀菌(65 ℃,30 min)和高温短时巴氏杀菌(72 ℃,15 s),当脱脂乳中心温度达到试验所需温度时开始计时,此处所有温度的测定均用温度计进行;采用高压锅加热模拟超巴氏杀菌(121 ℃,5 s),将脱脂乳样品置于高压锅中,设置高压锅为试验温度,开始加热,当高压锅显示达到所需温度和时间后,进行断电自然泄压。将热处理后的脱脂乳迅速于冷水中冷却至室温,然后置于4 ℃避光保存。
1.3.2 乳清蛋白的制备
采用等电点沉淀法[11]提取乳清蛋白,用1 mol/L HCl将脱脂乳的pH值调至4.6,然后在4 ℃、12 000 r/min离心15 min,保留上清液。所用乳清蛋白样品最后都要用0.45m的注射器过滤器进行过滤,滤液于-20 ℃冷冻保存。
1.3.3 SDS-PAGE凝胶电泳的测定
样品SDS-PAGE凝胶电泳图谱的测定是根据Emmanuelle等[12-13]的方法并加以改动。对照样品和处理样品分别用去离子水将体积稀释5倍,混合震荡,与缓冲液按体积比4∶1进行混合,煮沸5 min后,冷却至室温进行上样,采用120 V恒压电泳1.5 h。电泳结束,凝胶用蒸馏水清洗3次,然后浸泡在考马斯亮蓝染色液中,进行染色6 h。染色后的凝胶用脱色液浸泡脱色,脱色期间需要更换3次脱色液,至凝胶背景无色为止。
1.3.4 蛋白浓度测定
参考Toyama等的考马斯亮蓝方法[14]制作标准曲线,分别取0、0.01、0.02、0.04、0.06、0.08、1.0 mL牛血清白蛋白(BSA, bovine albumin)标准蛋白溶液于试管中,用去离子水补充到0.1 mL,再加入5 mL考马斯亮蓝染液,震荡摇匀使其充分反应,2 min后于可见光分光光度计595 nm波长下测量其吸光值,绘制标准曲线。其次用相同方法测定乳清蛋白样品,将其吸光值与标准曲线进行对比,得出待测蛋白浓度。
1.3.5 红外光谱分析
取100L乳清蛋白溶液,按照Qi等[15]的方法风干处理,设置红外光谱仪的分辨率为4 cm-1,在波数范围为4 000 cm-1~400 cm-1进行扫描,扫描次数为32次,利用Peak-Fit 4.12对红外光谱进行分峰拟合计算。
1.3.6 荧光光谱分析
参考Gu等[16]的方法,将乳清蛋白样品用去离子水稀释10倍,设置激发波长为290 nm,在此波长下进行发射波长的扫描,扫描光谱范围为300~450 nm,扫描速度为60 nm/min,激发和发射狭缝宽度均为5 nm。
1.3.7 粒径测定
将乳清蛋白溶液用去离子水稀释5倍,调整颗粒折射率为1.45,分散剂折射率为1.33,颗粒吸收率为0.887 2,采用Zetasizer Nano S90型纳米粒度测定仪进行粒径分布的测定[17]。
1.3.8 DSC曲线的测定
将乳清蛋白溶液置于铝盒中,密封后放于样品箱内,室温条件下平衡8 h,空铝盒为空白对照,加热温度从20~110 ℃,升温速率为10 ℃/min,得到DSC曲线[18]。
1.3.9 数据分析
2 结果与讨论
2.1 乳清蛋白纯度及浓度的测定
乳清蛋白的纯度测定结果见图1。由图1的乳清蛋白电泳图中可以看出,酪蛋白条带颜色非常浅,而-乳球蛋白(-Lg)和-乳白蛋白(-La)条带清晰可见,这说明,该方法提取的乳清蛋白中酪蛋白含量较低,乳清蛋白纯度较高。
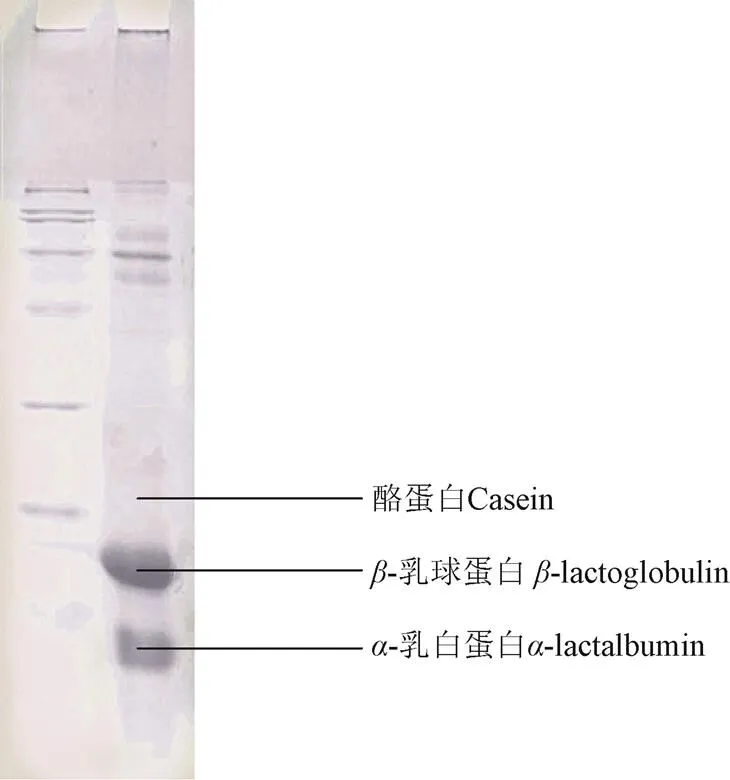
图1 等电点沉淀法提取乳清蛋白SDS-PAGE图 Fig 1 SDS-PAGE patterns of whey protein under isoelectric precipitation
以考马斯亮蓝G250和梯度标准蛋白所形成的络合物在595 nm处的吸光值为纵坐标,以标准蛋白溶液蛋白浓度为横坐标,绘出标准曲线,得回归方程=0.692 09+ 0.005 57,R=0.997 42,乳清蛋白浓度结果如表1所示,65 ℃,30 min和72 ℃,15 s处理的乳清蛋白样品蛋白浓度下降不明显,而121 ℃,5 s处理的样品蛋白浓度降低约50%(从97%降至52%),是因为经高温热处理后部分乳清蛋白形成较大的聚集体[19]无法透过0.45m过滤膜,导致蛋白含量减少。

表1 不同热处理条件下蛋白浓度 Table1 Protein concentration under different heat treatment conditions
2.2 热处理对乳清蛋白红外光谱的影响
图2为不同热处理条件下乳清蛋白的红外光谱结果。由图可以看出,1 500~1 750 cm-1处的峰值发生了变化,这表明由于热处理使得乳清蛋白二级结构发生了变化。
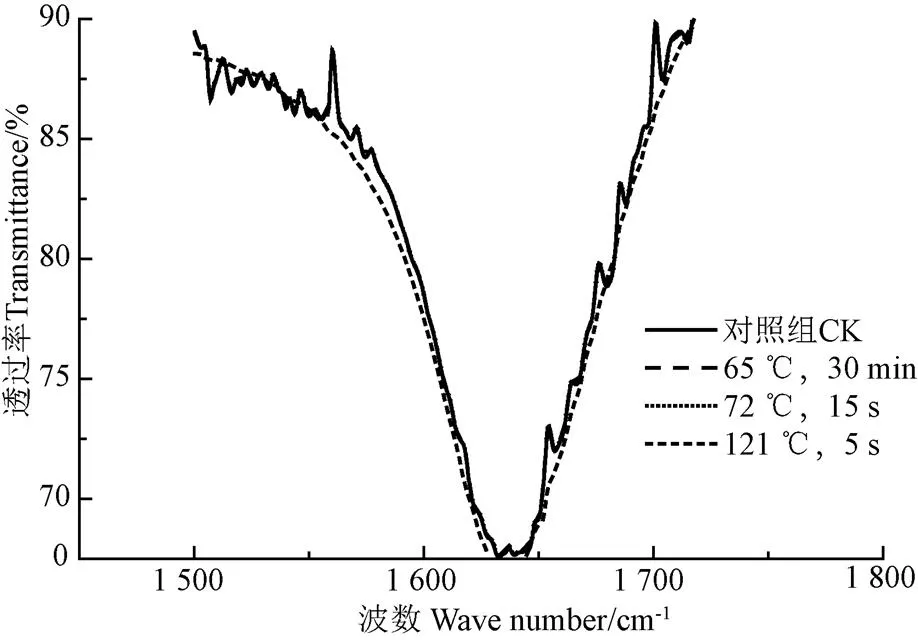
注:除了121 ℃处理牛乳后提取的乳清蛋白,其他3组的红外光谱图重合为一个谱图。
参考文献[20-21]可知,二级结构与各个子峰对应关系为:-折叠结构峰为1 615~1 637 cm-1和1 682~1 700 cm-1[20],无规则卷曲结构峰为1 637~1 645 cm-1,-螺旋结构峰为1 646~1 664 cm-1,-转角结构峰为1 664~1 681 cm-1[21]。将不同热处理条件下乳清蛋白的酰胺Ⅰ带红外光谱做二阶导数,并利用Gauss峰型进行拟合,通过峰型处理确定二级结构各峰位,如图 3所示。
根据峰位指认确定各子峰与二级结构的对应关系后,计算其积分面积,从而得到各二级结构的相对占比,如表2所示,蛋白质二级结构的变化通过表中4种结构含量变化来表示。3种热处理方式与对照组相比可以看出,蛋白质二级结构发生了变化,均表现为-螺旋和-折叠含量减少,-转角和无规则卷曲含量增加。其中,65 ℃,30 min组-螺旋和-折叠含量变化最大,-折叠的含量变化相对较小,降低了3.5 %。Lee等[22]研究表明-折叠含量也减少,可能是由于-折叠结构位于蛋白质凝聚体内部,由于较长时间的热处理,使乳清蛋白中部分蛋白发生凝聚,在经过0.45m的滤膜过滤后-折叠结构随着凝聚体过滤出去而含量减少。72 ℃,15 s组二级结构含量变化不大,说明此条件对乳清蛋白二级结构无明显影响。而121 ℃,5 s组-螺旋含量减少最多,表明此条件下蛋白质发生了去折叠,这可能是由于过高温导致蛋白质分子间或分子内氢键的断裂[23],超巴氏杀菌处理后乳清蛋白-转角和无规则卷曲含量的增加是因为在高温处理时,-折叠结构易转变为-转角结构,同时还会发生-转角向无规则卷曲转变[24],而结构变得更为无序,所以超巴氏杀菌处理后乳清蛋白结构会更加稳定。
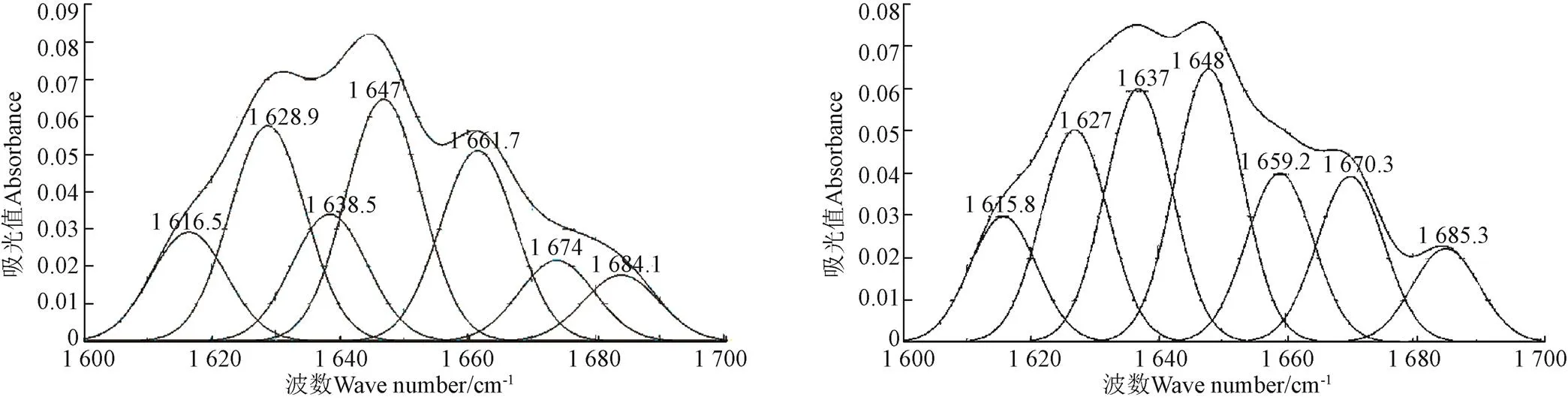

a. 对照组CKb. 65 ℃,30 min

c. 72 ℃,15 sd. 121 ℃,5 s
2.3 热处理对乳清蛋白荧光光谱的影响
本研究条件激发波长设为290 nm,以色氨酸(Trp)为发射基团的荧光光谱,如图4所示,4个样品的初始浓度基本相同,3种热处理对乳清蛋白荧光光谱形状并无显著影响,但是经过不同热处理条件后,其色氨酸荧光强度都有所减小,而荧光强度随着温度的升高先减小后增大,具体结果表示于表3。
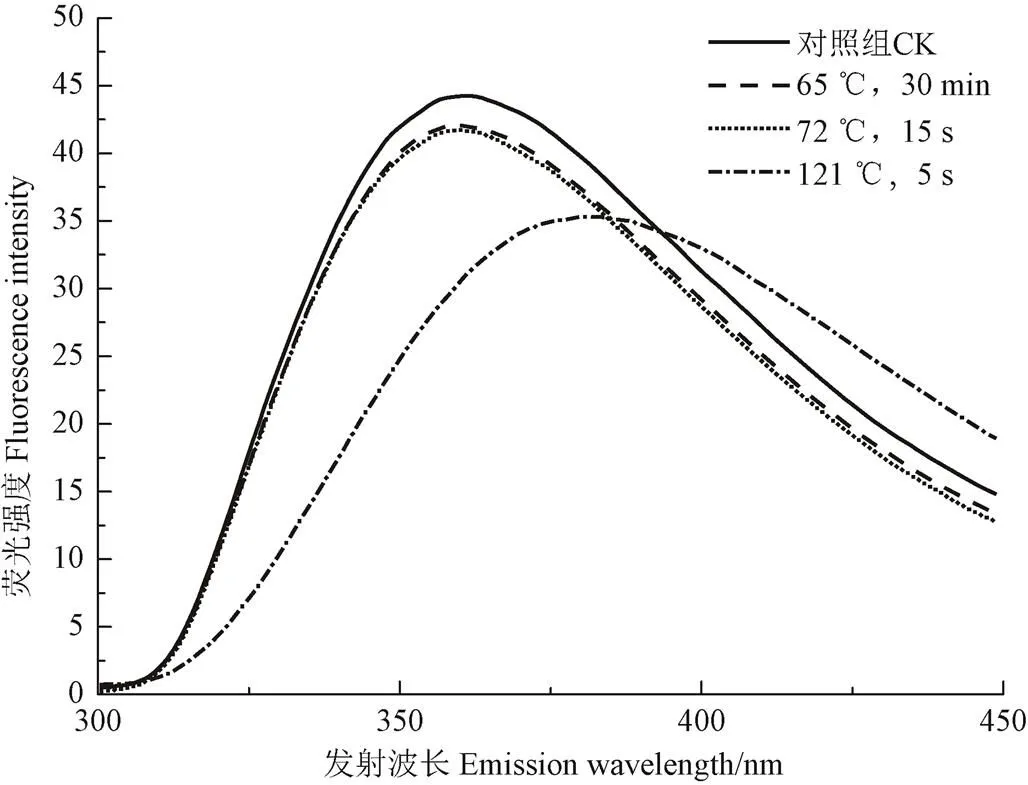
图4 不同条件热处理下乳清蛋白荧光光谱图
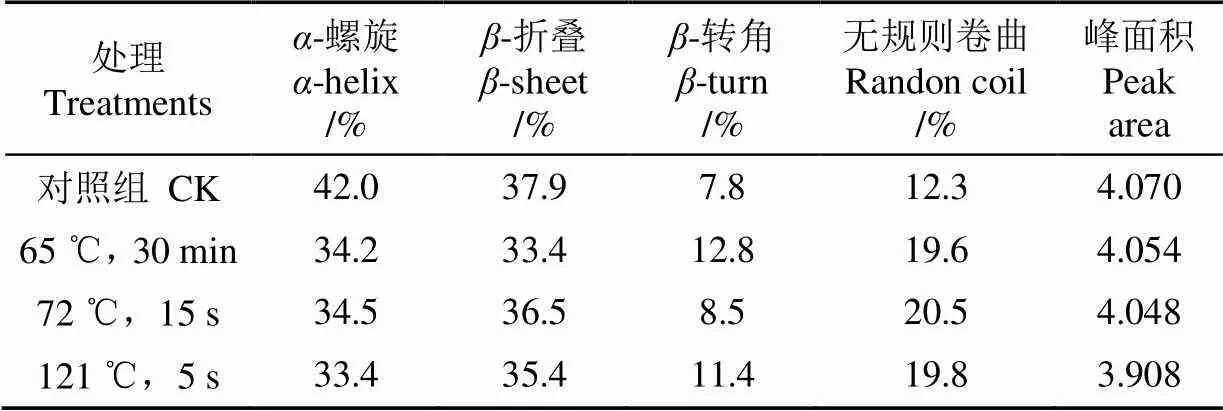
表2 不同热处理条件下乳清蛋白的二级结构占比
由表3可知,最大荧光强度值可以反映色氨酸残基的微环境情况,乳清蛋白样品的最大荧光强度值都大于330 nm,当最大荧光强度>330 nm时,表示色氨酸残基处于蛋白质分子外部的极性环境在中,当最大荧光强度<330 nm时,表示色氨酸残基处于蛋白质分子内部的非极性环境中[25],故本研究中乳清蛋白的色氨酸残基都是位于蛋白质分子外部的极性环境中。与对照组相比,65 ℃,30 min和72 ℃,15 s热处理的乳清蛋白样品的最大荧光强度值无明显变化,而经过121 ℃,5 s热处理的乳清蛋白样品的最大荧光强度发生红移,这说明温度过高会使维持蛋白质构象的疏水相互作用被破坏,从而引起蛋白质三级结构变化,蛋白的极性环境会增加,导致Trp的侧链逐渐暴露于溶剂中。与对照样品相比,经过巴氏杀菌处理的乳清蛋白样品其荧光强度都降低,而超巴氏杀菌处理的乳清蛋白样品降低最为显著,这可能是由于过高温破坏了蛋白质结构,使发色团暴露到溶剂中去,造成荧光强度降低[26]。

表3 不同热处理条件下乳清蛋白荧光光谱的λmax及λ值
2.4 热处理对乳清蛋白粒径的影响
经过热处理的乳清蛋白会发生变性,这可能是因为乳清蛋白分子之间或者乳清蛋白与酪蛋白、乳糖之间发生相互作用而形成凝聚物;也可能是因为高温处理使乳清蛋白三级结构被破坏,从而导致蛋白质发生降解[27],这都会导致蛋白的平均粒径发生变化,粒径是影响乳液稳定性的一个重要因素[28]。图5和图6显示出不同热处理条件下乳清蛋白的粒径分布和平均粒径。

图5 不同热处理条件下乳清蛋白粒径分布图

图6 不同热处理条件下乳清蛋白平均粒径
由图5可知,80 %以上的乳清蛋白的粒径主要分布在100~1 000 nm之间,平均粒径为171.3 nm。未经过热处理的对照组乳清蛋白的粒径分布只出现一个单峰,而65和72 ℃处理的乳清蛋白,表现出双峰结构,并且分布范围变宽,这表明热处理可能导致了可溶性-Lg凝聚体产生,所以出现了双峰,随着热处理温度的上升,凝聚物的体积微微增大,同时尺寸分布曲线变得更宽,Durand等[29]用色谱法测定乳清蛋白尺寸的结果的趋势与本试验的趋势类似,这是由于经过热处理后形成的凝聚物的尺寸比天然蛋白质的尺寸大。由图6可知,72 ℃处理的乳清蛋白的平均粒径(173.2 nm)比65 ℃处理后的平均粒径(166.1 nm)大,这可能是由于加热时间较长而增加了分子间相互作用的时间,从而形成的不溶性凝聚物经过0.45m滤膜过滤而导致粒径减小。而121 ℃处理后的乳清蛋白只出现一个峰,是由于加热产生的可溶性凝聚体通过共价键与非共价键的相互作用重新形成了更大的不溶性凝聚体,无法通过0.45m滤膜过滤后,导致样品中可溶性蛋白减少。
2.5 热处理对乳清蛋白热稳定性的影响
图7是不同热处理条件下乳清蛋白的DSC分析图谱,4个样品表现出不同的变性温度和变性焓,这可能是由于4种蛋白质中存在的聚合体是以不同的比例的-Lg、-La、BSA等蛋白质形成的,这些不同蛋白质的共价键数以及非共价键数存在很大差异,使得蛋白结构也存在巨大差异[30]所致。从图中可以看出,与对照样品相比,经过巴氏杀菌热处理的样品乳清蛋白初始变性温度都有所下降,而超巴氏杀菌处理的样品变性温度升高,说明超巴氏杀菌处理的乳清蛋白样品稳定性提高,这可能是因为热处理改变了蛋白质的空间结构,使4个样品的分子结构存在差异。


a. 对照组CKb. 65 ℃,30 min

c. 72 ℃,15 sd. 121 ℃,5 s
由表4可知,65 ℃,30 min和72 ℃,15 s处理的2个样品,都表现为变性温度下降,热焓升高,这是生成的-Lg凝聚体对热较不稳定,虽然都呈现出相同的趋势,但变化程度有所不同,这可能是由于温度不同导致两者的变性程度和方向均有所差异。121 ℃,5 s处理的样品的变性温度高于其他样品,这说明该处理条件下,乳清蛋白的稳定性最好,这可能是由于高温处理使乳清蛋白充分变性,蛋白中无序结构含量增多,这与红外光谱测定的乳清蛋白二级结构的变化相吻合。
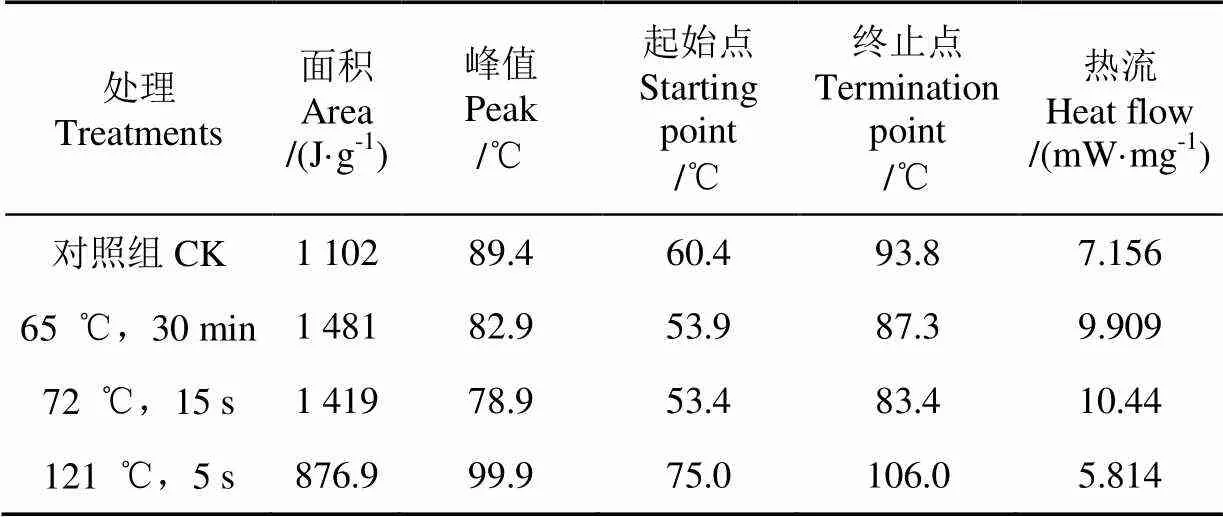
表4 DSC图谱峰的综合分析
3 结 论
1)牛乳经巴氏杀菌后蛋白浓度无明显变化,超巴氏杀菌使得蛋白浓度下降约50%,加热温度超过70 ℃以后乳清蛋白变性显著;
2)巴氏杀菌对乳清蛋白的二级与三级结构无显著影响;超巴氏杀菌处理后的乳清蛋白,其二级结构中以-螺旋为主的有序蛋白结构转变为以无规则卷曲为主的无序蛋白结构,其结构会变得更加稳定;
3)超巴氏杀菌的高温能够破坏乳清蛋白的三级结构以及蛋白分子的疏水相互作用,其最大荧光强度发生红移,使蛋白质微环境的极性增加;
4)超巴氏杀菌后的乳清蛋白热稳定性增加,其热变性温度最高为99.9 ℃,会延长乳的保质期,但其二级三级结构都发生显著改变,其营养价值也会发生变化。
[1] 吕加平,张书文,刘鹭,等. 巴氏杀菌奶加工技术及质量控制现状[J]. 食品科学技术学报,2016,34(1): 9-15.
[2] 顾佳升. 关于巴氏杀菌奶[J]. 乳业科学与技术,2005,3(3): 97-99.
[3] SMIT G. 现代乳品加工与质量控制[M]. 任发政,韩北忠,罗永,等主译. 北京: 中国农业大学出版社,2006.
[4] 顾佳升,龚林妹,夏静. 我国液态奶产品的系统分类和命名[J]. 食品工业,2004(1):23-24.
[5] 高婵. 浅谈乳制品的热处理[J]. 农民致富之友,2017(3):72.
[6] 黄庆飞,戴永恒,徐雪华. 玻璃瓶装巴氏杀菌奶微生物指标的控制[J]. 广西畜牧兽医,2004(5):207-209.
[7] Jo Y, Benoist D M, Barbano D M, et al. Flavor and flavor chemistry differences among milks processed by high-temperature, short-time pasteurization or ultra-pasteurization[J]. Journal of Dairy Science, 2018, 101(5): 3812-3828.
[8] Lee A P, Barbano D M, Drake M A. The influence of ultra-pasteurization by indirect heating versus direct steam injection on skim and 2% fat milks[J]. Journal of Dairy Science, 2017, 100(3): 1688-1701.
[9] Bogahawaththa D, Buckow R, Chandrapala J, et al. Comparison between thermal pasteurization and high pressure processing of bovine skim milk in relation to denaturation and immunogenicity of native milk proteins[J]. Innovative Food Science & Emerging Technologies, 2018, 47: 301-308.
[10] Jiang S, Altaf hussain M, Cheng J, et al. Effect of heat treatment on physicochemical and emulsifying properties of polymerized whey protein concentrate and polymerized whey protein isolate[J]. LWT- Food Science and Technology, 2018, 98: 134-140.
[11] 陈静廷,卜登攀,马露,等. 不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析[J]. 食品科学,2014,35(20):180-184. Chen Jingting, Bu Dengpan, Ma Lu, et al. Analysis of whey protein extracted by different isoelectric precipitations and ultracentrifugation methods from cow milk[J]. Food Science, 2014, 35(20): 180-184. (in Chinese with English abstract)
[12] Emmanuelle R, Palatasa H, Owen M, et al. Behavior of protein in the presence of calcium during heating of whey proteinconcentrate solutions[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 13156-13164.
[13] 韩奕奕,黄菲菲,王建军,等. 凝胶电泳法(SDS-PAGE)测定乳与乳制品中Lg的含量[J]. 乳业科学与技术,2009,2(2):74-77.
[14] Toyama H, Nishibayashi E, Saeki M, et al. Factors required for the catalytic reaction of PqqC/D which produces pyrroloquinoline quinine[J]. Biochem Biophys Res Commun, 2007, 354(1): 290-295.
[15] Qi P X, Ren D, Xiao Y, et al. Effect of homogenization and pasteurization on the structure and stability of whey protein in milk[J]. Journal of Dairy Science, 2015, 98(5): 2884-2897.
[16] Gu C F, Lan X F, Yu Y S, et al. Fluorescence spectrum of milk solution[J]. Acta Photonica Sinica, 2012, 41(1): 107-111.
[17] 李子超,徐明芳,向明霞,等. 巴氏杀菌与超高温灭菌牛乳酪蛋白结构差异性的研究[J]. 华南农业大学学报,2013,34(2):192-196. Li Zichao, Xu Mingfang, Xiang Mingxia, et al. Research on the structural differences of the casein from milk by pasteurization and ultrahigh temperature sterilization[J]. Journal of South China Agricultural University, 2013, 34(2): 192-196. (in Chinese with English abstract)
[18] Frydenberg R P, Hammershoj M, Andersen U, et al. Protein denaturation of whey protein isolates (WPIs) induced by highintensity ultrasound during heat gelation[J]. Food Chemistry, 2016, 192: 415-423.
[19] Matsudomi N, Kanda Y, Yoshika Y, et al. Ability of casein to suppress the heat aggregation of ovotransferrin[J]. Journal of Agricultural and Food Chemistry, 2004, 52( 15) : 4882-4886.
[20] Meng G, Ma C Y. Characterization of globulin from(red bean)[J]. International Journal of Food Science & Technology, 2002, 37(6): 687-695.
[21] Long G, Ji Y, Pan H, et al. Characterization of thermal denaturation structure and morphology of soy glycinin by FTIR and SEM[J]. International Journal of Food Properties, 2015, 18(4): 763-774.
[22] Lee H L, Choi C, Lee S J. Membrane-bound-synuclein has a high aggregation propensity and the ability to seed the aggregation of the cytosolic from[J]. Journal of Biological Chemistry, 2002, 277(1): 671-678.
[23] Plaza D, Duvetter T, Van D P, et al. Influence of environmental conditions on thermal stability of recombinant aspergillus aculeatus pectinmethylesterase[J]. Food Chemistry, 2008, 111(4): 912-920.
[24] 李杨,王中江,王瑞,等. 不同热处理条件下大豆分离蛋白的红外光谱分析[J]. 食品工业科技,2016,37(8):104-109.
[25] Halder U C J, Chakraborty N, Das S, et, al. Tryptophan dynamics in the exploration of micro-conformational changes of refolded-lactoglobulin after thermal exposure: A steady state and time-resolved fluorescence approach[J]. Acta Endocrinologica, 2012, 109(2): 227-230.
[26] 王喜波,张泽宇,葛洪如,等. 超声辅助制备抗冻融大豆分离蛋白工艺优化[J]. 农业工程学报, 2016, 32(14): 272-278. Wang Xibo, Zhang Zeyu, Ge Hongru, et al. Processing optimization for improving fstability of soybean protein isolate by ultrasonic assisted glycosylation[J]. Transactions of the Chinese Society of AEngineering (Transactions of the CSAE), 2016, 32(14): 272-278. (in Chinese with English abstract)
[27] 李飞,隋新,刘红娟,等. 热处理对乳蛋白质的影响[J]. 北京联合大学学报:自然科学版,2015,29(1):35-40.
[28] 王喜波,崔强,张安琪,等. 超声处理改善不同比例大豆-乳清混合蛋白理化性质[J]. 农业工程学报, 2018, 34(22): 299-305. Wang Xibo, Cui Qiang, Zhang Anqi, et al. Ultrasonic treatment improving physical and chemical properties of soybean-whey mixed protein in different proportions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 299-305. (in Chinese with English abstract)
[29] Durand D, Nicolai T. Heat induced aggregation, gelation and phase separation of the globular protein-lactoglobulin[J]. Handbook of Food Science, Technology, and Engineering, 2006, 93(93): 1-18.
[30] 刘振艳,徐红华. 热致乳蛋白微米凝胶的特性[J]. 中国乳品工业,2012,40(11):7-9.
Effect of pasteurization and ultra-pasteurization on structure and thermal stability of fresh milk whey protein
Wang Xibo, Zhang Anqi, Wang Yuying, Cui Qiang, Zhou Guowei, Wang Lin
(,,150030,)
Milk is rich in nutrition, and it is a good medium for microorganisms, therefore, heat treatment are commonly used to sterilize in the process of liquid milk processing. Although the heat treatment can kill microorganisms in milk, it is possible to change the nutritional value and functional properties of milk, so it is essential to study the effects of heat treatment on the structural and properties of milk proteins, especially on whey protein monomers and casein monomers. The heat treatment of milk is generally carried out by pasteurized, and the ultra-pasteurized milk is also very popular recently. At present, there are few reports on the effects of heat treatment on the structural properties of milk whey protein. In this paper, defatted milk obtained by centrifugation through fresh milk as raw material. Then, the skim milk is subjected to low temperature long-term and high-temperature pasteurization and ultra-pasteurization treatment, and the casein are extracted by isoelectric precipitation, and finally whey protein was detected by different detection methods and techniques. So the effects of pasteurization and ultra-pasteurization on the structure and thermal stability of whey protein were discussed. The results of the protein concentration and SDS-PAGE gel electrophoresis showed that the whey protein content extracted by the isoelectric point method after heat treatment was high and the casein content was substantially absent. The results of infrared spectroscopy showed that pasteurization had little effect on the secondary structure of whey protein, while the content of-helix in whey protein was significantly reduced after ultra-pasteurization treatment, and the random curl content increased significantly, it indicated that there was no significant change in the secondary structure of whey protein after pasteurization treatment, and the development of disordered structure changed from ordered structure to disordered structure after superpasteurization treatment, thereby improving the thermal stability of whey protein. Fluorescence analysis showed the whey protein sample heat-treated at 121 ℃ for 5 s was red-shifted, indicating that super-pasteurization greatly changed the secondary and tertiary structure of whey protein, it is shown that too high temperature will destroy the tertiary structure of whey protein and increase the polarity of the protein microenvironment. DSC analysis showed thermal denaturation of whey protein sample treated at 121 ℃ for 5 s, the peak temperature was 99.9 ℃, which was higher than that of the pasteurized whey protein sample, indicating that the stability of the whey protein sample after the ultra-pasteurization treatment was significantly improved. This may be due to the ultra-high temperature treatment to fully denature the whey protein and increase the disordered structure in the protein, which also indicates that the whey protein aggregate formed by ultra-high temperature was heat stable and the degree of denaturation was irreversible. The production and demand of dairy products in China are very large and the consumer groups are extensive. Therefore, it is very important to carry out research on the related technology of dairy processing to ensure the quality and safety of dairy products and promote the healthy and rapid development of China’s dairy industry.
heat treatment; structural analysis; thermodynamic properties; pasteurization; ultra-pasteurization; whey protein
2018-10-22
2019-03-11
乳品科学教育部重点实验室开放课题(KLDS-18-004)
王喜波,教授,博士,研究方向为食品科学。Email:wangxibo@neau.edu.cn
10.11975/j.issn.1002-6819.2019.06.037
TS252.4
A
1002-6819(2019)-06-0307-06
王喜波,张安琪,王玉莹,崔 强,周国卫,王 琳. 巴氏杀菌和超巴氏杀菌对牛乳清蛋白结构及热稳定性的影响[J]. 农业工程学报,2019,35(6):307-313. doi:10.11975/j.issn.1002-6819.2019.06.037 http://www.tcsae.org
Wang Xibo, Zhang Anqi, Wang Yuying, Cui Qiang, Zhou Guowei, Wang Lin. Effect of pasteurization and ultra-pasteurization on structure and thermal stability of fresh milk whey protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(6): 307-313. (in Chinese with English abstract) doi:10.11975/j.issn.1002- 6819.2019.06.037 http://www.tcsae.org

