宫颈细胞系化学转染与电穿孔转染效率的比较与优化
林洁,高建,段永恒,段山,林圣
(深圳市卫生健康发展研究中心分子医学实验室 深圳518040)
宫颈癌是最常见的妇科恶性肿瘤之一,高发年龄为30 ~55 岁,近年来其发病有年轻化的趋势,其发病率仍居于女性癌症发病前列[1,2]。宫颈癌从宫颈上皮内瘤样病变或鳞状上皮内病变发展而来,按组织结构可划分为鳞癌、腺癌和腺鳞癌3 种类型,通常都伴随有人乳头瘤病毒(HPV)的感染[3,4]。永生化的宫颈正常组织细胞系和宫颈癌细胞系是开展宫颈癌体外研究的重要材料,且不同的细胞系具有不同的HPV 亚型感染和差异化的细胞特性[5]。
通过转染实现基因沉默或过表达是研究细胞内基因功能的重要技术手段[6,7]。转染是将外源性基因或基因的反义序列导入细胞内,并在胞内有效表达。常规转染技术按效果可分为两大类,一类是瞬时转染,一类是稳定转染(永久转染);按转染方式的不同又可分为电击法、磷酸钙法、脂质体介导法和病毒介导法等[8]。其中脂质体介导的化学转染法和电穿孔转染法是常用的两类转染方式。本研究分别采用多种不同的化学转染试剂比较它们在转染常用宫颈(癌)细胞系HeLa、SiHa、CaSki、C33A 和Ect1/E6E7 中的效能,对于所有试剂转染效果皆不佳的细胞系则测试电穿孔转染的适用性,从而确定针对不同的宫颈(癌)细胞系最佳的转染方式和转染试剂,为相关研究提供参考方案。
材料与方法
1 研究采用的细胞系
宫颈细胞系HeLa、SiHa、CaSki、C33A、Ect1/E6E7 均购自于中国医学科学院。其中HeLa 细胞为HPV18 感染,SiHa 和CaSki 细胞为HPV16 感染,C33A 细胞无HPV 感染,而Ect1/E6E7 细胞为无HPV感染的永生化的正常宫颈上皮细胞。为保证研究的可靠性,我们采用STR 分型技术分别对实验用的这五个细胞系进行鉴定,以避免细胞间的混淆污染。
2 主要试剂与仪器
转染试剂Lipofectamine 2000 和Lipofectamine 3000 购自美国Life 公司,FuGENE HD 购自美国Roche 公司,jetPRIME 购自中国达科为生物技术有限公司。细胞培养所用的DMEM 培养基和胎牛血清(FBS)购自美国HyClone 公司。pcDNA3.1-EGFP质粒由实验室构建。
电转化仪BEX CUY21 EDIT II 购自日本BEX公司,细胞计数仪Cellometer K2 购自中国达科为生物技术有限公司,倒置荧光显微拍照系统购自德国Leica 公司,恒温CO2细胞培养箱购自美国Thermo公司,其它细胞培养耗材购自美国Corning 公司。
3 脂质体介导的化学转染
在转染实验前一天,在24 孔板的每个孔的1ml培养基中加入1×106个细胞。每个条件设3 个平行重复。同时制备实验所需的pcDNA3.1-EGFP 质粒(以下简称EGFP 质粒),按照NucleoSpin Plasmid 试剂盒步骤提取。
3.1 FuGENE HD 转染方案
将FuGENE HD 转染试剂、EGFP 质粒放置于室温中,DMEM 复温,转染试剂使用前轻弹混匀。质粒使用前快速涡旋几秒,随后瞬离。将100μl 无血清培养基加入到无菌1.5ml EP 管中,随后加入0.5μg EGFP 质粒,并充分混匀。再加入1.5μl FuGENE HD并猛烈弹EP 管混匀。室温静置15min。将净置完毕的25μl 转染复合物加入孔中。轻轻地前后摇动培养板混合均匀。37℃,5%CO2培养箱中静置培养。
3.2 jetPRIME 转染方案
将50μl jetPRIME buffer加入EP管中,再加0.5μg EGFP 质粒。涡旋10s,瞬离。再加1μl jetPRIME reagent,涡旋10s,瞬离。室温放置10min。将静置完毕的50μl 转染复合物加入孔中,轻轻地前后摇动培养板混合均匀。37℃,5%CO2培养箱中静置培养4h 后换液,继续培养。
3.3 Lipofectamine 2000 转染方案
转染试剂Lipofectamine 2000、EGFP 质粒和DMEM 放置于室温中,转染试剂使用前轻弹混匀。将50μl Opti-MEM®培养基加入到无菌1.5ml EP 管中,随后加入0.5μg EGFP 质粒,轻轻混匀。将50μl DMEM 加入到无菌1.5ml EP 管中,随后加入1.25μl Lipofectamine 2000,室温孵育5min。孵育完毕后,将上述DNA 稀释液和Lipofectamine 2000 稀释液混合,轻轻混匀,室温孵育20min。将静置完毕的100μl转染复合物加入孔中,轻轻地前后摇动培养板混合均匀。37℃,5%CO2培养箱中静置培养。4~6h 后给细胞换液。
3.4 Lipofectamine 3000 转染方案
将转染试剂Lipofectamine 3000、EGFP 质粒和DMEM 放置于室温中,转染试剂使用前轻弹混匀或涡旋几秒,随后瞬离。将25μl DMEM 分别加入到两个无菌1.5ml EP 管中,随后各加入0.75μl Lipofectamine 3000 转染试剂。将50μl DMEM 加入到另一无菌1.5ml EP 管中,随后加入0.5μg 待转染EGFP 质粒,再加入1μl P3000 Reagent。将稀释好的DNA 加入到稀释好的Lipofectamine 3000 中各25μl。室温静置5min。将静置完毕的50μl 转染复合物加入孔中,轻轻地前后摇动培养板混合均匀。37℃,5%CO2培养箱中静置培养。
4 电穿孔转染
电转之前细胞传两个或多个10cm 大皿。细胞长到90%时,离心收集细胞,350×g 离心4min,弃掉上清。加6ml 的OPTI-MEM 培养基充分重悬细胞,离心,弃上清。用1ml OPTI-MEM 重悬细胞,液体移到EP 管,进行细胞计数。同时重悬的细胞350×g 离4min,彻底去掉上清。用OPTI-MEM 重悬细胞(15μl OPTI-MEM/100 万细胞)。取足量细胞液到另一EP 管,加质粒(5μg 质粒/100 万细胞),充分混匀液体。用OPTI-MEM 润洗电极杯,吸尽OPTI-MEM,缓慢加入18μl 混合液到电极杯,保证液体落到杯底部,并防止气泡产生,以免影响转化效率。将电极杯放入电极杯座上,测定电阻,通过添加OPTI-MEM调节电阻值在140Ω到200Ω之间后开始电转化。电转结束后取出电极杯,向其中添加150μL 的OPTI-MEM。用吸管充分混匀细胞,种到培养板中,加1.5ml 培养基,混匀。空白对照加18μl细胞液,每组设3 个平行。然后在37℃,5%CO2培养箱中静置培养。
5 转染效率的检测与比较
转染24h 之后在倒置荧光显微镜下分别对每个孔的细胞在明场和荧光场下进行指定位置的拍照,以获取直观的转染效率图像。再用胰酶消化五株宫颈(癌)细胞系,10%小牛血清培养液终止消化,吹打,制成细胞悬液。500×g 离心5min。弃去上清,用PBS 重悬,500×g 离心5min。弃去上清,用适量PBS 重悬,最后使用Cellometer K2 细胞计数仪自动化测定携带荧光的细胞占总细胞数的比例。
6 统计学分析
所有检测结果均采用SPSS Statistics 22 软件进行统计分析。每个样本机器检测3 次取均值作为观测值。每个细胞的每种处理取3 个复孔的观测值计算均值和标准差,并用方差分析对多组均数做显著性检验,如差异有显著性意义,则进一步采用LSD法做样本均数之间的两两比较,确定哪两个均数之间有显著性差异,以评估各种转染方案的优劣。
结 果
1 STR 分型鉴定研究采用的宫颈(癌)细胞系
本实验研究对象为广泛应用的5 种宫颈(癌)细胞系HeLa、SiHa、CaSki、C33A、Ect1/E6E7。它们有不同的形态特征、生长特性和HPV 感染状态,对于全面探索宫颈癌变机理具有重大的价值[5]。然而有报道指出,目前世界范围内许多实验室冻存的细胞株存在着严重的交叉污染问题,导致研究结果与实际有较大偏差[9,10]。鉴于此,我们对于此前购买并冻存和培养的以上5 个细胞系,采用STR 分型技术进行了鉴定,鉴定结果如表1 所示,5 个细胞系均与ATCC 等原始出处给予的鉴证信息相匹配,表明细胞系纯粹无污染,可准确应用于相应的研究。
2 四种常用化学转染试剂转染五个宫颈(癌)细胞系的效果比较
脂质体转染是实验研究中最常用也是最便捷的传递核酸进细胞的方式[11]。我们检测了4 种常用的以脂质体介导为原理的化学转染试剂:FuGENE HD、jetPRIME、Lipofectamine 2000(以下简称Lipo 2000)和Lipofectamine 3000(以下简称Lipo3000),在分别转染上述5 个常见的宫颈(癌)细胞系HeLa、SiHa、CaSki、C33A 和Ect1/E6E7 时的效率。在各转染试剂用户指南推荐的操作流程和推荐的质粒与转染试剂浓度配比下,实验达到的转染效率有显著差异。在倒置荧光显微镜下同一视野的影像(图1)显示,明场展示所有存活的贴壁细胞,荧光场展示转染EGFP 质粒成功在激发光下发出绿色荧光的细胞。为了进一步定量地比较转染效率的差异,我们将细胞消化后在自动化细胞计数仪的辅助下测定荧光细胞比例(图2)。可以看到,在HeLa 细胞中,jetPRIME 的转染效率最高达到66.3%,而Lipo 3000也达到较高的效率为37.4%。HeLa 是宫颈癌研究最为广泛应用的细胞系,大多数化学转染试剂在开发时都以此细胞系作为测试和优化,因此都能达到比较高的转染效率。四种转染试剂在SiHa 细胞系中的转染效率相接近,均在10%~15%左右。在C33A细胞系Lipo3000 和jetPRIME 中分别取得16.0%和11.9%的转染率,而FuGENE HD 和Lipo 2000 的转染率都很低下。对于CaSki 细胞系和Ect1/E6E7(简称为E6E7)细胞系,4 种转染试剂的转染效率都很低,不能够满足基因功能研究的需求。

表1 各细胞系STR 分型鉴定结果Tab. 1 The STR genotyping verification results of each cell line
3 电穿孔法提升化学转染法难转细胞系的转染效率
对于化学难转的CaSki 细胞系和Ect1/E6E7 细胞系,我们尝试采用电穿孔转染的方式提高其基因转染效率。BEXCUY21 EDIT II 具有一套组合脉冲系统:高压“穿孔脉冲”和低压“驱动脉冲”。极短的高压穿孔脉冲在细胞表面形成很多小孔,随后低压驱动脉冲可引导DNA 或药物进入细胞,通过调整脉冲时间和脉冲间隔可得到极佳的转染效率和细胞生存率。电穿孔转染最重要的影响条件为其穿孔电压,因而我们测试了在梯度电压下其转染效率的变化。在相同的7ms 脉冲波长、10ms 脉冲间隙和20V 驱动电压下,不同穿孔电压得到的CaSki 细胞系和Ect1/E6E7 细胞系转染效率呈现一定的波动,在170V 处转染效率达到最高,且均高于化学转染法(图3)。
讨 论
通过比较选择和优化转染方案是开展众多细胞学和动物学研究的前提条件[12,13]。本实验按照四种转染试剂说明书推荐的质粒和转染试剂用量,针对5株宫颈癌细胞,比较4 种转染试剂转染GFP 质粒的转染效率。细胞的生长状态也是影响转染效率的一个重要因素,本研究选择对数生长期的细胞进行试验,保证细胞在最佳状态下进行转染。研究表明同一种转染试剂进行不同细胞株的转染,得到的转染效率不同[14]。例如jetPRIME 转染试剂在Hela 细胞中的转染效率达到66%,而在CaSki 细胞中低到0.3%。这可能与细胞膜的结构不同有关。同样的,实验表明,4 种转染试剂在同一株细胞中的转染效率不同。例如,在Hela 细胞中jetPRIME 转染试剂的转染效率达到66%,而Lipofectamine 2000 只有7.4%。也有其他研究者证明不同转染试剂转染同一株细胞得到的转染效率不同,这可能与转染复合物进入细胞内的方式有关[15-18]。再者,多个实验证实Lipofectamine 2000 转染试剂对细胞有一定的毒性[15,16,19-22],在本实验中不仅转染效果差,在转染4h 之后还要换液,操作麻烦且易造成换液过程中细胞的损失,因此不推荐使用[23]。

图1 倒置荧光显微镜下4 种转染试剂转染效率比较。比例尺,100μmFig. 1 Comparison for transfection efficiency of 4 transfection reagents under the inverted fluorescence microscope. Scale bar, 100μm
FuGENE HD、jetPRIME、Lipofectamine 2000 和Lipofectamine 3000 这4 种转染试剂对Ect1/E6E7、CaSki 细胞的转染效果都很差,转染效率均低于10%。因此我们考虑用电穿孔转染法探索最佳转染条件。实验首先对电转染法的转染参数进行了系统的摸索和优化,最后在相同的脉冲波长7ms、脉冲间隙10ms 和驱动电压20V 的条件下,设计穿孔电压梯度,探索最佳穿孔电压。Cellometer K2 定量检测结果表明,针对难转细胞系Ect1/E6E7、CaSki,在穿孔电压为170V 时,电穿孔转染法可以得到高出化学转染法三、四倍的转染效率,改善了难转细胞转染效率很低的情况。但电转染给细胞造成很大的损伤,细胞存活率不高,细胞恢复正常的生长状态慢[20,24-27]。因此,电穿孔转染法更适用于难转细胞的稳定转染[28]。
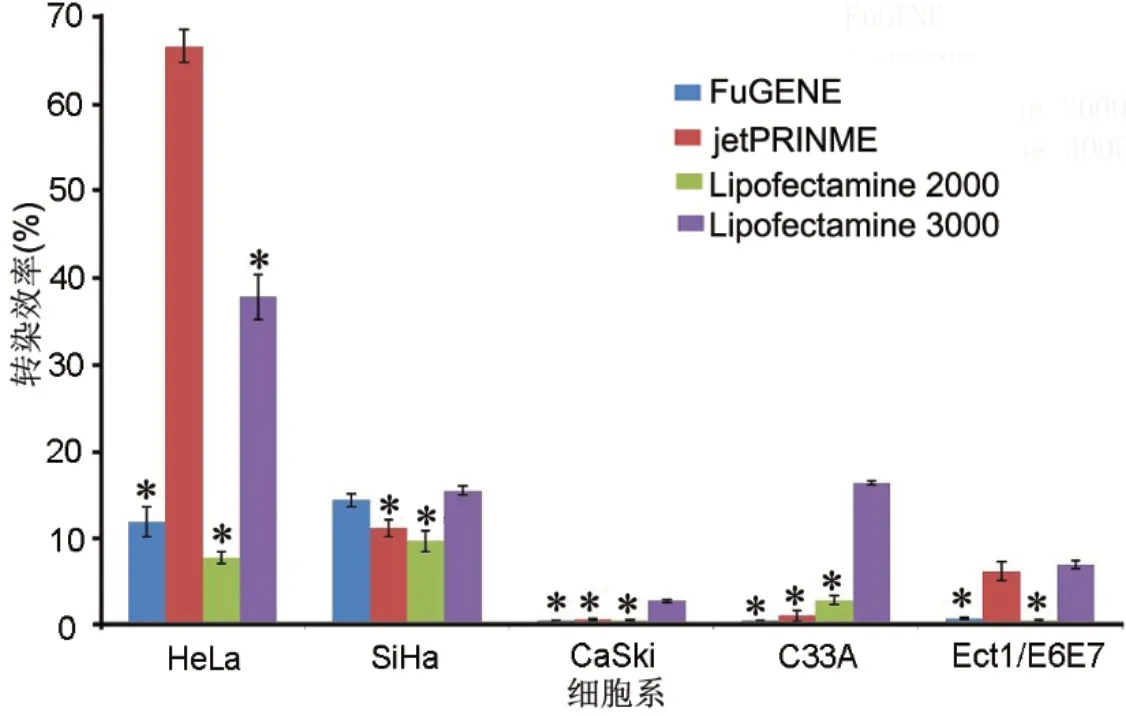
图2 4 种转染试剂在各细胞系中转染效率比较。*,与转染效率最高的试剂比较, P<0.001Fig. 2 Comparison for transfection efficiency of 4 transfection reagents in each cell line. *, P<0.001 compared with the highest transfection efficiency group

图3 CaSki 和Ect1/E6E7 细胞系在不同穿孔电压下电转效率比较。与转染效率最高的电压比较:*,0.01<P<0.05;**,P<0.01;***,P<0.001Fig. 3 Comparison for electransfection efficiency in CaSki and Ect1/E6E7 cells under series of poration pulse voltage. Compared with the voltage with the highest transfection efficiency∶ *, 0.01<P<0.05; **, P<0.01; ***, P<0.001
在后续针对宫颈细胞系开展的研究中,根据以上实验结果有目的性地选择合适的化学转染试剂或电穿孔转染方案,将能显著地提升实验效果,简化条件摸索的过程。

