干扰SET8 在胃癌细胞肿瘤进展和顺铂敏感性中的作用
张琪,王文义
(平煤神马医疗集团总医院肿瘤科,平顶山 467000)
胃癌是世界上第五大最常见的癌症,占所有癌症死亡的8.8%[1]。目前胃癌治疗主要依靠外科切除术后辅以常规疗程化疗[2]。最近研究表明,基因表达的表观遗传学机制如DNA 和组蛋白的异常修饰在肿瘤的发生过程中起至关重要的作用[3]。组蛋白甲基转移酶以S-腺苷甲硫氨酸为甲基供体,催化甲基转移到组蛋白赖氨酸或精氨酸上[4]。其中SET8 是组蛋白H4 第20 位赖氨酸(H4K20)甲基转移酶,而H4K20 单甲基化修饰在细胞周期、基因转录和染色质固缩等过程具有重要作用,这些过程与癌症发展密切相关[5]。然而SET8 在胃癌进展以及胃癌细胞对顺铂敏感性中的作用并不明晰。本研究检测了胃癌患者癌组织中SET8 表达水平,并研究了干扰SET8表达后对胃癌BGC-823 细胞增殖、细胞迁移及侵袭能力的影响,最后研究了SET8 在胃癌细胞顺铂敏感性中的作用。
材料和方法
1 试剂
胎牛血清以及DEME 培养基购买自美国Gibco公司;Taq PCR Master Mix试剂盒购买自德国Qiagen公司;PVDF 膜购自美国Thermo Scientific 公司;兔抗人SET8 抗体购买自美国Genetex 公司;TRIzol 试剂、逆转录试剂盒和Taq PCR Master Mix 试剂盒均购买自日本TAKARA 公司;CCK-8 试剂盒购买自日本Dojindo 公司;SET8-shRNA 和对照NC-shRNA由上海吉玛公司合成。
2 临床样本
临床收集16例行肿瘤切除术的胃癌患者的胃癌组织和癌旁组织。经病理学检验,癌旁组织为正常组织。所有患者术前未接受辅助助化疗、放疗或其他药物治疗。手术过程中获得样品后快速冷冻并储存在-80℃。所有患者均获得知情同意,此研究获得了伦理委员会批准。
3 免疫组织化学
临床胃癌切除术中获得的组织后快速固定于4%福尔马林缓冲液中,48h 内进行石蜡包埋处理,随后制备4μm 厚切片。石蜡切片脱蜡至水后,滴加3% H2O2室温下孵育10min 阻断内源性过氧化物酶,蒸馏水冲洗2 次;用10%山羊血清室温封闭10min。去除血清,将切片在4℃下用抗SET8(1∶100)抗体孵育过夜;第二天PBS 清洗3 次,每次5min;用生物素标记山羊抗兔IgG 二抗(1∶100,北京中杉金桥生物技术有限公司)37℃孵育1h 后,PBS 冲洗3次,每次3min;用辣根酶标记链亲合素(1∶100,北京中杉金桥生物技术有限公司)37℃孵育30min,PBS 冲洗3 次,每次5min;用AEC 显色液室温孵育30min,自来水冲洗,苏木精复染2min;然后切片经常规脱水、透明后,中性树胶封片,在显微镜下任取5 个视野拍照。
4 细胞培养
胃粘膜上皮细胞系RGM-1、和胃癌细胞系BGC-823、SGC-7901均购自ATCC,培养于含有10%胎牛血清和100U/mL 青霉素DMEM 培养基中,培养条件为37°C,5% CO2。在细胞处于对数期用于后续实验。
5 细胞转染
取对数期胃癌BGC-823 细胞接种到6 孔板,待细胞贴壁后,更换为无血清和无青霉素的DMEM培养基培养6h 后,采用 LipofectamineTM2000(美国Invitrogen 公司)对细胞分别进行转染30MOI SET8-shRNA 和对照NC-shRNA,继续培养48h 后,收集细胞用于后续检验。
6 实时定量PCR
采用TRIzol 试剂提取胃粘膜上皮细胞系RGM-1、和胃癌细胞系BGC-823、SGC-7901 中总RNA。取RNA 使用逆转录试剂盒逆转录成cDNA,然后根据Taq PCR Master Mix 试剂盒说明书,将cDNA 作为RT-qPCR 的模板,在体系中加入Taq DNA 聚合酶以及引物进行RT-qPCR 分析。引物序列委托广州锐博生物科技有限公司合成,SET8 上游引物5’-AGCCATGCCCGCATTAGCTC-3’,下游引物3’-AAAGGAATGCAAC‘ITCCCAA-5’; β-actin 上游引物5’-TCCCTGGAGAAGAGCTACGA- 3’,下游引物3’-TGCTCCTTCAGGACATGG ACT- 5’。采用2-ΔΔCt法进行量化分析。
7 细胞增殖实验
采用CCK-8 法评估细胞增殖。取已经转染SET8-shRNA 和 对 照NC-shRNA 的BGC-823 细 胞以5000 细胞/孔的数量接种到96 孔板中。分别培养24h、48h 和72h 后,按照CCK-8 试剂盒(日本Dojindo 公司)说明书对各孔加入10μl CCK-8 试剂,并在37℃条件下孵育2.5h 后,用酶标仪(Bio-Rad,USA)在450nm 波长下测量光密度值(OD)。
8 集落形成实验
取已经转染SET8-shRNA 和对照NC-shRNA 的BGC-823 细胞以20 细胞/孔的数量接种到24 孔板中,每3d 换液一次,培养15d。 吸弃培养液,PBS洗涤细胞2 次后,用4%多聚甲醛固定细胞,然后用0.1%结晶紫染色,拍照。
9 细胞迁移和侵袭测定
通过Transwell 法检测细胞迁移和侵袭能力。取已经转染 SET8-shRNA 和对照NC-shRNA的BGC-823 细胞,用无血清培养基分别制备成5×104/ml 的细胞悬液。细胞侵袭实验:分别取100μl细胞悬液接种于Matrigel(1∶8)包被的Transwell 小室底部膜的上室面;下室采用600μl 含有10%胎牛血清的DMEM 培养基;培养24h 后,取上室,并擦除膜上表面未穿膜的细胞,用4%多聚甲醛固定下表面细胞,用0.1%结晶紫染色,显微镜下随机选择10 个视野计数。对于细胞迁移实验,采用未被Matrigel 包被的Transwell 小室,其余实验方法同细胞侵袭实验。
1 0 蛋白免疫印迹实验
分别取胃癌组织、癌旁组织和已经转染SET8-shRNA 和对照NC-shRNA 的BGC-823 细胞,RIPA 裂解后,离心萃取总蛋白。总蛋白经过BCA 法进行蛋白定量。随后在10%SDS-PAGE 凝胶上分离30μg 总蛋白,电泳结束后转移到PV 膜上。PV 膜经5%脱脂奶粉封闭后,加SET8 一抗(1∶1000 稀释)4°C 过夜。 第二天用PBST 洗膜后,室温下用HRP标记的山羊抗兔IgG(上海碧云天生物技术有限公司)孵育1h,PBST 洗膜后加入显影液曝光显像,以GAPDH 为内参,采用Image—Pro(R) Plus 软件进行光密度测定分析。
1 1 免疫荧光染色
取已经转染 SET8-shRNA 和对照NC-shRNA 的BGC-823 细胞用4%多聚甲醛溶液固定15min 后,用0.3%Triton X-100 室温处理20min。然后加入抗SET8 一抗(1∶300)4℃下孵育过夜,第二天用PBST洗涤细胞3 次后,以Alexa Fluor® 405 标记山羊抗兔IgG(1∶500,美国Abcam 公司)避光孵育50min,并用DAPI 染核5min 后,在荧光显微镜下随机选取10 个视野拍照。
1 2 转染SET8-shRNA 对顺铂敏感性的影响
分别取已经转染 SET8-shRNA 和对照NC-shRNA 的BGC-823 细胞以5000 细胞/孔的数量接种到96 孔板中。待细胞贴壁后,分别向每个孔中加入20、40、60 和80μmol/L 的顺铂,细胞继续孵育24h 后,按照CCK-8 试剂盒说明书对各孔加入10μl CCK-8 试剂,并在37℃条件下孵育2.5h 后,用酶标仪(Bio-Rad,USA)在450nm 波长下测量光密度值(OD)。
1 3 统计分析
本实验数据均用平均值±标准差表示,采用SPSS20.0 软件进行统计分析,两组之间比较采用成组t检验;P<0.05 认为有统计学意义。
结 果
1 SET8 在胃癌组织和胃癌细胞系中高表达
本实验首先采用免疫组织化学染色以及蛋白免疫印迹的方法,对胃癌患者癌组织中的SET8 的表达情况进行分析。免疫组织化学结果显示,相对于正常癌旁组织,胃癌组织中SET8 呈弥漫性强表达(图1A);蛋白免疫印迹结果显示,胃癌组织中SET8 蛋白表达水平相比于癌旁组织明显升高(图1B)。qRT-PCR 检测显示,SET8 mRNA 在胃癌细胞系BGC-823 和SGC-7901 中的表达水平相比于胃粘膜细胞RGM-1 显著升高(图2A)。
2 沉默SET8 抑制胃癌细胞系BGC-823 细胞增殖
将SET8-shRNA 转染至胃癌细胞系BGC-823 中后,蛋白免疫印迹(图2B)以及免疫荧光实验结果(图2C)检测显示,细胞内SET8 表达水平显著下降。随后通过CCK-8 法检测沉默SET8 对细胞增殖的影响,结果显示:干扰SET8 表达后可显著降低BGC-823 细胞的增殖(图2D)。

图1 SET8 在胃癌组织中表达的免疫组织化学和Western blot 检测。A,SET8 代表性免疫组织化学染色图像,比例尺,100μm;B,SET8 代表性Western blot 检测结果;C,Western blot 检测SET8 水平的统计学分析; ***,P <0.001 vs 癌旁组织;n=16Fig. 1 The expression of SET8 in gastric cancer tissues detected by immunohistochemistry and Western blot. A, representative immunohistochemical images of SET8 in adjacent tissues and tumor tissues, scale bar, 100μm; B, representative result of Western blot of SET8; C, statistical analysis for SET8 protein level detected by Western blot; ***, P <0.001 vs adjacent tissues; n=16
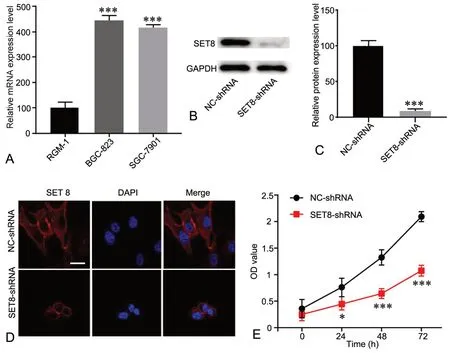
图2 RGM-1、BGC-823 和SGC-7901 细胞中SET8 mRNA 表达及沉默SET8 对BGC-823 细胞增殖的影响。A,qRT-PCR 检测BGC-823 细胞中SET8 mRNA 表达水平的统计学分析;B,沉默SET8 对BGC-823 细胞中SET8 水平影响的代表性Western blot 检测结果;C,Western blot 检测沉默SET8 对BGC-823 细胞中SET8 水平影响的统计学分析;D,沉默SET8 对BGC-823 细胞中SET8 水平影响的代表性免疫荧光检测结果 (比例尺,10μm);E,沉默SET8 对BGC-823 细胞增殖影响的统计学分析;*,0.01<P <0.05 vs NC-shRNA;***,P <0.01 vs NC-shRNA;n=3Fig. 2 The expression of SET8 mRNA in RGM-1, BGC-823 and SGC-7901 cell lines and the effect of silencing SET 8 on proliferation of BGC-823 cell line. A, statistical analysis for levels of SET8 mRNA detected by qRT-PCR in RGM-1, BGC-823 and SGC-7901 cells; B, representative Western blot results of the effect of silencing SET8 on SET8 level in BGC-823 cells; C, statistical analysis for the effect of silencing SET8 on SET8 level in BGC-823 cells detected by Western blot; D, representative immunofluorescence results of the effect of silencing SET8 on SET8 level in BGC-823 cells (scale bar, 10μm); E, statistical analysis for the effect of silencing SET8 on proliferation of BGC-823 cells; *, 0.01<P<0.05 vs NC-shRNA;***, P <0.01 vs NC-shRNA; n=3
3 沉默SET8 抑制胃癌BGC-823 细胞集落形成能力、迁移及侵袭能力
集落形成实验显示,沉默SET8 可显著降低BGC-823 细胞集落形成能力(图3A 和3B)。随后采用transwell 法检测显示,沉默SET8 可降低胃癌细胞系BGC-823 迁移能力(图3C 和3 D)以及侵袭能力(图3E 和3F)。
4 沉默SET8 增强胃癌BGC-823 细胞顺铂敏感性
CCK-8 法检测显示,相对于NC-shRNA 组,干扰SET8 表达可显著增强胃癌BGC-823 细胞对顺铂敏感性(图4)。
讨 论
胃癌是人类最常见的恶性肿瘤之一,是世界第三大癌症相关死亡原因[6]。尽管近年来胃癌治疗有所改善,但由于肿瘤转移和高复发率,胃癌仍然是一个沉重的世界健康问题[7]。胃癌由于早期发病隐匿,多数患者在出现症状时已经进入中晚期,为胃癌的治疗以预后带来沉重负担[8]。尽管许多分子途径和基因被报道与胃癌发生有关,但发现新的肿瘤治疗靶点仍然至关重要。
现有的研究证明,DNA 甲基化、异染色质形成的表观遗传学改变在肿瘤发生过程中起到重要作用[9]。SET8 主要催化组蛋白H4 的甲基化修饰,已被证明对肺癌、乳腺癌等肿瘤的发生发挥重要作用[10-12]。在本研究中,我们发现胃癌组织中SET8 的表达水平相比于癌旁组织明显升高,体外胃癌细胞培养也证明了同样的结果。随后我们通过RNA 干扰技术研究了干扰SET8 对胃癌细胞进展影响。实验结果显示,干扰SET8 可显著降低胃癌细胞细胞增殖、细胞集落形成能力,并抑制了细胞迁移与侵袭。
手术切除辅助放化疗仍然是胃癌的主要治疗方法。然而,化疗的有效性往往受到肿瘤细胞对化疗敏感性的影响,增强化疗敏感性有助于增强疗效和减轻副作用[13]。顺铂(cisplatin, DDP)是癌症化疗过程中广泛使用的化疗药物,可以导致DNA 交联从而引起细胞凋亡[14]。近些年,顺铂在胃癌中的敏感性问题也越来越引起重视。我们发现,干扰SET8 可显著增强胃癌细胞对顺铂的敏感性,而其具体机制还需进一步研究。
综上,SET8 在胃癌组织及胃癌细胞中高表达,抑制SET8 表达可降低胃癌细胞增殖及迁移侵袭能力,并且能够提高胃癌细胞对顺铂的敏感性。我们的研究为胃癌的治疗提供了新的目标靶点。

