黄芪甲苷调控自噬抑制缺氧缺糖/复氧复糖HT22细胞凋亡
张 怡,靳晓飞,周晓红,董贤慧,张 颖,于文涛,高维娟
(河北中医学院河北省中医药防治心脑血管病基础研究重点实验室,河北 石家庄 050091)
缺血性脑卒中是临床常见病和多发病,其治疗基础主要为梗死组织周边缺血半暗带的血流恢复,但有时缺血区血流恢复后导致的再灌注损伤会造成更为严重的脑损伤[1-2]。细胞凋亡和细胞自噬是影响脑缺血/再灌注损伤(cerebral ischemia- reperfusion injury,CIRI)发生发展的重要机制。研究发现,在脑缺血发生后,激活细胞自噬可抑制细胞凋亡的发生,从而减轻脑组织损伤[3]。中药黄芪味甘,性微温,广泛应用于气虚血瘀型脑血管病的临床治疗[4]。黄芪甲苷是黄芪的主要活性成分之一,本课题组前期研究证实,黄芪甲苷可有效抑制缺氧缺糖/复氧复糖(oxygen and glucose deprivation/reoxygenation, OGD/R)PC12细胞凋亡,但黄芪甲苷能否通过调控自噬,发挥其对OGD/R神经细胞的保护作用,少有报道。因此,本研究采用HT22细胞为研究对象,通过OGD/R模拟CIRI过程,探讨黄芪甲苷是否通过调控自噬,抑制HT22细胞凋亡,从而发挥神经保护作用。
1 材料
1.1细胞株小鼠海马神经元细胞系HT22,由河北医科大学附属第一医院实验中心许顺江教授惠赠。
1.2试剂黄芪甲苷(纯度>98 %),购于上海源叶生物科技有限公司;胎牛血清,购自浙江天杭生物科技股份有限公司;DMEM高糖培养基、DMEM无糖培养基、胰蛋白酶,均购于美国Gibco公司;青链霉素混合液,购自BIOND公司;Triton X-100、多聚赖氨酸,均购自北京索莱宝科技有限公司;Bcl-2单克隆抗体购自abcam公司;Bax多克隆抗体、Alexa Fluor488标记的山羊抗小鼠IgG、Cy3标记驴抗兔IgG、DAPI染液均购自武汉谷歌生物科技有限公司;CCK-8试剂盒,购自北京庄盟国际生物基因科技有限公司;乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒,购自南京建成生物工程研究所;3-甲基腺嘌呤(3-methyladenine,3-MA)、雷帕霉素(rapamycin,Rapa),购于美国Sigma公司。
1.3仪器3111型CO2培养箱、3131型三气培养箱、Varioskan LUX型多功能微孔板读数仪(Thermo公司);超净工作台SW-CJ-ID型(苏州净化公司);DMI3000B型倒置显微镜、DM5000B型荧光显微镜(Leica公司)。
2 方法
2.1HT22细胞的培养HT22细胞接种于含10%胎牛血清和1%青链霉素混合液的DMEM高糖培养基中,置于37 ℃、5% CO2饱和湿度的CO2培养箱中培养,细胞复苏后,培养1~2代进行OGD/R模型建立。
2.2HT22细胞OGD/R模型的建立及实验分组取对数生长期的 HT22细胞,随机分为8组:正常对照组(Control)、模型组(Model)、溶剂对照组(DMSO)、黄芪甲苷组(AS-IV)、黄芪甲苷组加正常细胞组(AS-IV+N)、黄芪甲苷加自噬抑制剂组(AS-IV+3-MA)、自噬抑制剂组(3-MA)、自噬激活剂组(Rapa)。除正常对照组及黄芪甲苷组加正常细胞组外,其余各组均缺氧缺糖6 h后复氧复糖,建立OGD/R细胞模型:HT22细胞弃去正常细胞培养液(含10%胎牛血清、1%青链霉素混合液的DMEM高糖培养基),用预热的PBS清洗2遍后,更换培养液为DMEM无糖培养基以模拟细胞缺血状态,然后放入含94% N2+5% CO2+1% O2的37 ℃三气培养箱中培养,氧糖剥夺6 h后,将DMEM无糖培养基更换为正常细胞培养液,放入37 ℃、5% CO2培养箱中继续培养。各给药组于复氧复糖的同时分别给予含黄芪甲苷(终浓度为100 μmol·L-1)、自噬抑制剂3-MA(终浓度为5 mmol·L-1)、黄芪甲苷+3-MA和自噬激活剂Rapa(终浓度为250 nmol·L-1)的不同细胞培养液,溶剂对照组给予含等体积的DMSO细胞培养液,培养24 h后观察各组细胞形态,并进行指标检测。
2.3CCK-8法检测细胞存活率各组细胞于OGD/R 24 h后,分别于96孔板中每孔加入10 μL CCK-8溶液,于37 ℃、5% CO2培养箱中孵育45 min后,在多功能微孔板读数仪中测定OD450 nm值,检测细胞存活率。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
2.4LDH漏出率检测在96孔板中加入细胞上清液及LDH试剂,混匀,室温静置5 min后,在多功能微孔板读数仪中测OD450值,此为细胞上清中LDH释放量。向原含细胞的培养板中加入1% Tritonx-100,室温反应20 min后,取细胞反应液及LDH试剂混匀,室温静置5 min,450 nm测定吸光值为细胞破膜液LDH释放量。LDH漏出率=上清LDH /(上清LDH+细胞破膜液LDH )×100%。
2.5免疫荧光检测Bax、Bcl-2将盖玻片用多聚赖氨酸包被,细胞种植于包被好的玻片上,制备细胞爬片,然后进行造模及给药处理。细胞爬片用4%多聚甲醛固定20 min;1% Triton X-100破膜15 min;BSA室温孵育30 min;甩掉封闭液后,先后滴加配好的Bax(1 ∶100)和Bcl-2(1 ∶100),4 ℃孵育过夜;PBS洗去一抗后,滴加相应二抗,避光室温孵育50 min;PBS洗去二抗后,滴加DAPI染液,避光室温孵育10 min;封片;每张细胞爬片随机选取3个视野进行拍照,采用Image-Pro Plus 6.0软件进行分析。
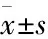
3 结果
3.1OGD/R模型HT22细胞的形态学变化如Fig 1所示,正常组细胞表现为贴壁生长,细胞呈两极或多极,突触明显,突触之间相互交织成网状,细胞膜光滑、完整,胞体折光性强;与正常组相比,模型组和DMSO组细胞胞体突触明显减少,细胞皱缩、变圆,胞质凝聚,细胞间连接大量减少,细胞贴壁不紧,部分细胞团脱落,胞体折光性下降;与模型组比较,AS-IV组上述表现有所缓解。
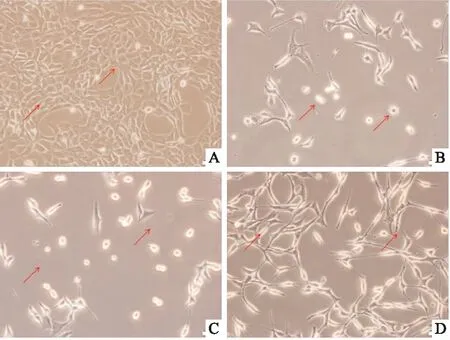
Fig 1 Morphological observation under optical microscope in each group (scale bar=50 μm)
A: Control; B: Model; C: DMSO; D: AS-IV. Arrow indication: A: Normal cells; B, C: Damaged cells after OGD/R; D; Damage-relieving cells after Astragaloside IV treatment.
3.2黄芪甲苷明显提高OGD/R的HT22细胞存活率如Fig 2所示,与正常组相比,模型组细胞存活率明显下降(P<0.01),AS-IV+N组无差别;与模型组比较,AS-IV组细胞存活率明显升高(P<0.01),DMSO组细胞存活率无差别。
3.3黄芪甲苷通过调控自噬提高OGD/R的HT22细胞存活率如Fig 3所示,与正常组相比,模型组细胞存活率明显下降(P<0.01);与模型组比较,AS-IV、Rapa组细胞存活率明显升高(P<0.01),3-MA组细胞存活率明显下降(P<0.01),AS-IV+3-MA 组细胞存活率无差别;与AS-IV组比较,AS-IV+3-MA组、3-MA组细胞存活率明显降低(P<0.01)。
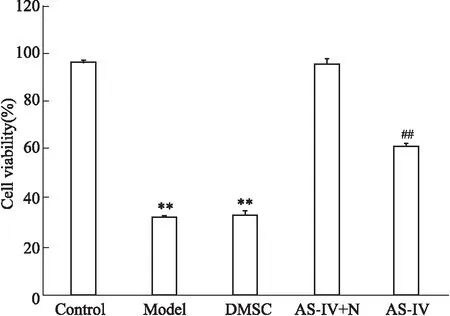
Fig 2 Cell viability of HT22 cells treated by astragaloside IV after OGD/R n=6)
**P<0.01vscontrol group;##P<0.01vsmodel group
Fig 3 Cell viability of HT22 cells under different
**P<0.01vscontrol group;##P<0.01vsmodel group;▲▲P<0.01vsAS-IVgroup
3.4黄芪甲苷明显降低OGD/R的HT22细胞LDH漏出率如Fig 4所示,与正常组相比,模型组LDH漏出率明显升高(P<0.01),AS-IV+N组无差别;与模型组比较,AS-IV组LDH漏出率明显降低(P<0.01),DMSO组无差别。
3.5黄芪甲苷通过调控自噬降低OGD/R的HT22细胞LDH漏出率如Fig 5所示,与正常组相比,模型组细胞LDH漏出率明显升高(P<0.01);与模型组比较,AS-IV、Rapa组细胞LDH漏出率明显降低(P<0.01),3-MA组、AS-IV+3-MA 组无差别;与AS-IV组比较,AS-IV+3-MA组、3-MA组细胞LDH漏出率明显升高(P<0.01)。与细胞存活率检测趋势基本一致。
3.6OGD/R的HT22细胞中Bcl-2、Bax的表达Fig 6的免疫荧光检测结果显示,与正常组相比,模型组细胞Bax/Bcl-2明显升高(P<0.01);与模型组比较,AS-IV、Rapa组细胞Bax/Bcl-2明显降低(P<0.05),3-MA组细胞Bax/Bcl-2明显升高(P<0.01),AS-IV+3-MA组无差异;与AS-IV组比较,3-MA组、AS-IV+3-MA组细胞Bax/Bcl-2明显升高(P<0.01)。
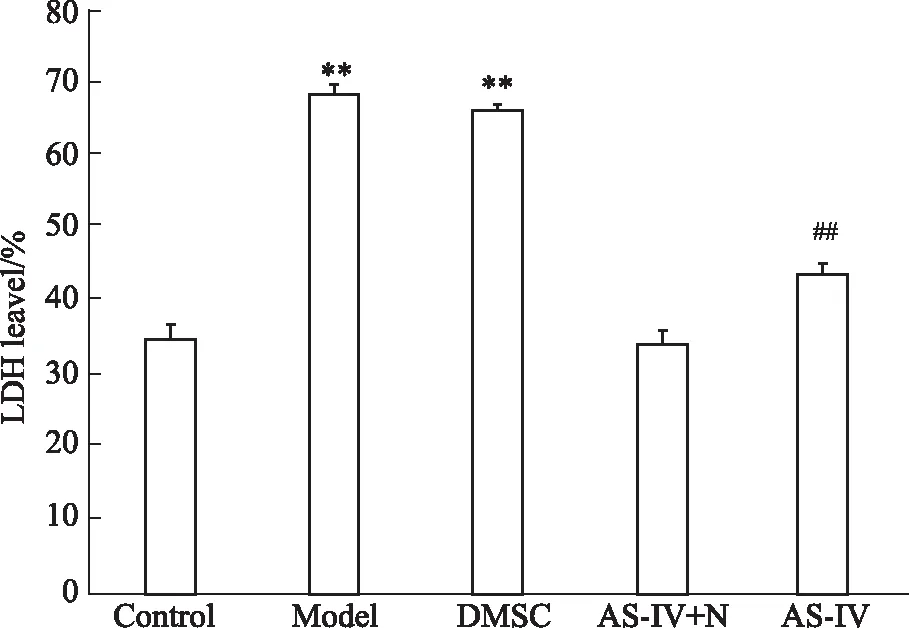
Fig 4 LDH level of HT22 cells treated by astragaloside IV after OGD/R
**P<0.01vscontrol group;##P<0.01vsmodel group
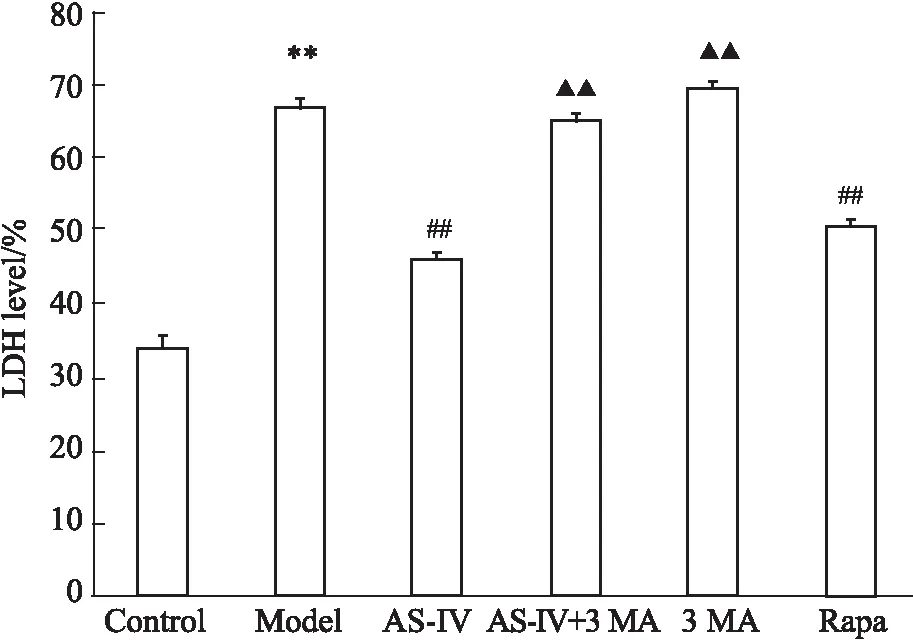
Fig 5 LDH level of HT22 cells under different treatment after n=6)
**P<0.01vscontrol group;##P<0.01vsmodel group;▲▲P<0.01vsAS-IV group
4 讨论
关于缺血性脑卒中的治疗,恢复缺血区的血流供应是避免脑组织缺血损伤的首要条件,但随之带来的再灌注损伤也日益受到医学界的重视。CIRI的发生机制十分复杂,涉及细胞凋亡和细胞自噬等多种病理生理过程。诸多研究证实,细胞凋亡是CIRI继发性损伤发生的重要机制[5]。Bax和Bcl-2是调控凋亡的重要蛋白,两者的比值是决定凋亡发生与否的重要因素[6]。CIRI后,大量活性氧、自由基等所引起的氧化应激等因素,也会引发自噬的发生[7]。研究发现,CIRI后自噬被适度激活能够明显缩小CIRI后梗死容积,减少神经元死亡,减轻神经功能障碍,从而减轻缺血/再灌注损伤[8-9]。凋亡和自噬作为细胞自我销毁的两种主要机制,两者之间存在着密切关系。自噬可通过清除受损细胞器或蛋白,为细胞重新供能,使细胞免于凋亡,对CIRI的预后发挥着重要作用[10]。
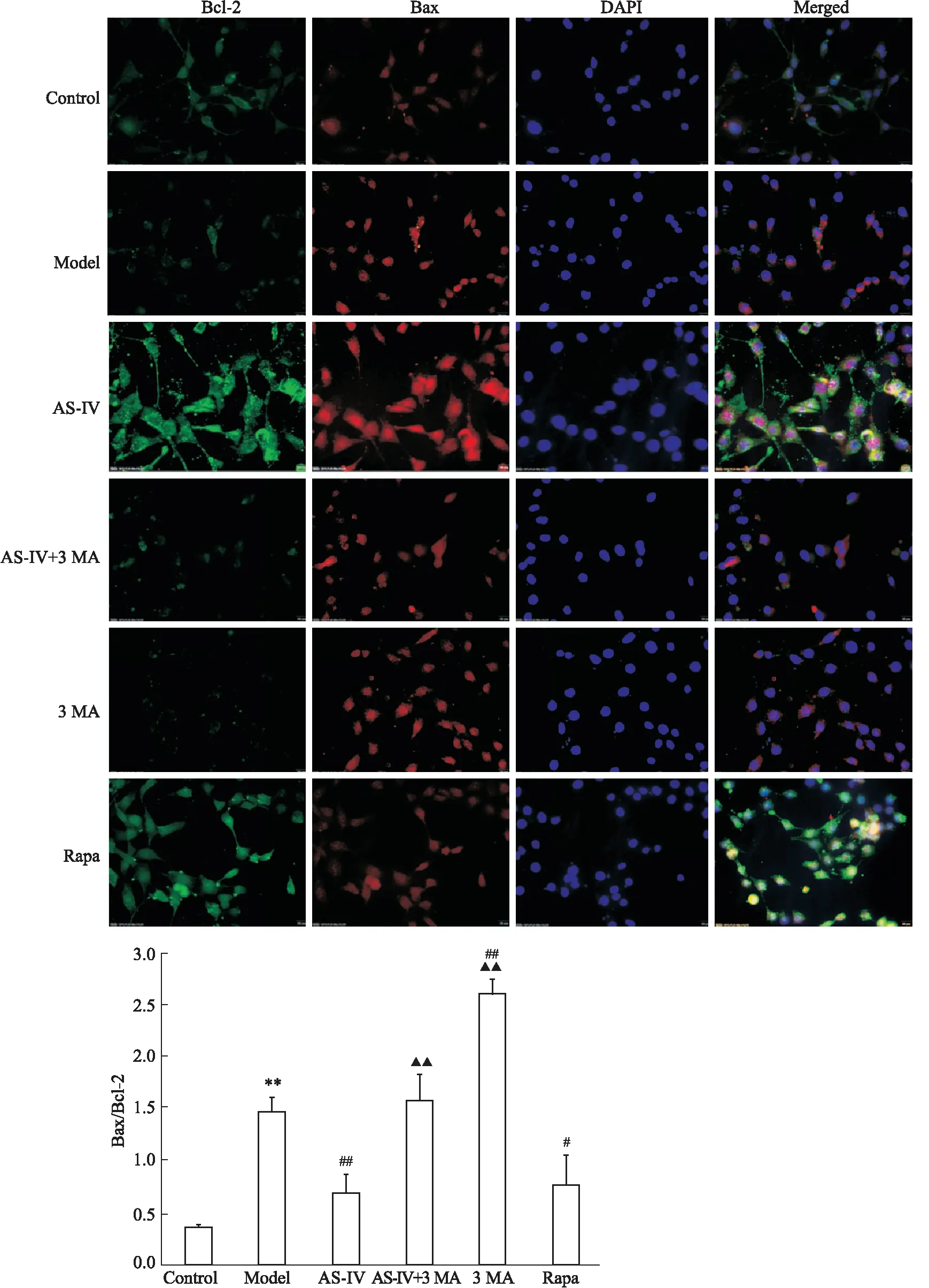
A: Immunofluorescence of Bax and Bcl-2; B:Ratio of Bax and Bcl-2.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group,▲▲P<0.01vsAS-IV group
中药黄芪为豆科植物蒙古黄芪或膜荚黄芪的根,临床上用于治疗脾胃虚弱、表虚自汗、脓毒溃疡、半身不遂等,具有补气健脾、固表敛汗、化瘀消肿、生肌敛疮的功效。现代药理学研究发现,黄芪具有扩张血管、改善脑血流量、降低血液黏度、增加微循环灌注等作用,为治疗缺血性卒中的常用药[11-12]。黄芪甲苷为黄芪主要活性成分,具有清除氧自由基、抗炎、抗病毒、抗衰老、抗血小板凝集等生物活性,可通过抑制细胞凋亡、改善能量代谢等途径,抑制脑缺血/再灌注损伤[13-14]。
本研究以常用于神经系统疾病研究的HT22细胞为实验对象,通过OGD/R模拟CIRI过程。OGD/R后给予黄芪甲苷处理,实验结果显示,黄芪甲苷能够有效提高OGD/R HT22细胞的存活率、降低LDH漏出率,对细胞发挥保护作用。同时对正常细胞给予黄芪甲苷处理后证实,黄芪甲苷对正常细胞无影响。基于上述结果,进一步探索黄芪甲苷发挥神经保护作用的机制。HT22细胞经OGD/R处理后,分别给予黄芪甲苷、黄芪甲苷+自噬抑制剂、自噬抑制剂和自噬激活剂处理。结果显示,黄芪甲苷和自噬激活剂均能明显提高OGD/R HT22细胞存活率,降低LDH漏出率及Bax/Bcl-2值,抑制细胞凋亡的发生,但黄芪甲苷治疗效果优于自噬激活剂;而同时给予黄芪甲苷和自噬抑制剂处理后,黄芪甲苷的保护作用被阻断;单独给予自噬抑制剂后,HT22细胞存活率较模型组明显降低,LDH漏出率及Bax/Bcl-2明显升高,细胞损伤加重。证实激活自噬对OGD/R HT22细胞具有保护作用,抑制自噬则导致损伤加重。因此,本研究认为黄芪甲苷对OGD/R HT22 细胞具有神经保护作用,且这种保护作用可能是通过激活自噬,抑制细胞凋亡实现的。

