HIV-1衣壳蛋白抑制剂体外筛选方法研究进展
张大为,许晓双,常 珊
(江苏理工学院生物信息与医药工程研究所,江苏 常州 213001)
人类免疫缺陷病毒(human immunodeficiency virus, HIV)是艾滋病(acquired immunodeficiency syndrome, AIDS)的病原体[1]。HIV主要有2种亚型:HIV-1和HIV-2,后者具有更高的毒力和传染性,导致了全球大多数国家的HIV感染[2]。AIDS是全球最为致命的传染性疾病之一,目前仍无法治愈。30年来,经美国 FDA批准上市的抗HIV-1药物多达30余种,这些药物的联用(亦被称为高效抗逆转录病毒疗法)使得艾滋患者的死亡率大幅下降,寿命得到了极大延长,AIDS甚至已经被“驯服”成一种慢性传染性疾病[3]。然而,由于存在患者依从性差、药物副作用大和耐药性病毒株等诸多问题,使得AIDS治疗的效果明显降低[4]。因此,寻找具有优良特点(比如毒副作用小、便于给药、耐药基因屏障高)的新一代抗HIV-1药物显得非常必要。
1 衣壳蛋白(capsid protein, CA)是理想的抗病毒药物靶点
HIV-1为逆转录病毒,将RNA和重要的病毒蛋白包裹于衣壳中,是该类病毒的重要特征。衣壳由CA组装而成。近年来,人们逐渐认识到HIV-1衣壳在病毒复制过程中并非是一个“小角色”,而是一个重要的“多面手”[5]:参与病毒的逆转录;病毒基因组的核输入及整合;防止固有免疫效应器的激活。病毒衣壳的组装和稳定性均会影响HIV-1病毒分子的自我复制和感染性,因此,CA成为潜在的药物作用靶点。目前,已有研究报道了若干靶向CA的抑制剂,只有Gilead Sciences公司宣布其开发的CA抑制剂 GS-CA1进入了I期临床试验[6]。尽管没有一种CA抑制剂被批准用于临床,但是这些已经发现的CA抑制剂却有力地证明了CA是开发抗病毒药物的有效靶点。此外,与HIV-1病毒的其它蛋白相比,CA蛋白序列相对保守。通过构建单点氨基酸残基突变库发现,70%的CA残基在发生突变后,会导致病毒丧失感染性,CA表现出极度的遗传脆弱性(genetic fragility)[7]。CA的遗传脆弱性能在一定程度上降低耐药性的出现,也提示我们在寻找CA抑制剂的时候,应重点关注CA蛋白遗传脆弱性最为严重的位点。综上所述,CA是一个理想的药物作用靶点,发现CA抑制剂具有重要意义。
2 HIV-1衣壳蛋白的结构
HIV衣壳由大约1 500个CA蛋白单体组装而成。CA源于病毒gag结构基因编码的前体蛋白,由N端结构域(N-terminal domain,NTD)、C端结构域(C- terminal domain,CTD)和中间的柔性部分组成[8]。NTD由150个氨基酸残基组成,CTD由70个氨基酸残基组成,前者主要由α-螺旋、β发卡结构和亲环素A结合环组成,后者则包括α-螺旋、310螺旋和保守区域MHR。CA的NTD相互作用,形成环形六聚体(hexamer, HA)和五聚体(pentamer, PA),HA或PA再通过 CTD之间的相互连接,形成网状晶格。最终,由大约250个 HA和12个PA组成了圆锥形的“富勒烯”型衣壳[5]。HIV-1衣壳的分解和组装依赖于CA两个结构域之间的相互作用[9]。
3 HIV-1的CA抑制剂筛选方法
简单有效的药物筛选方法是发现CA抑制剂的前提。目前,已有研究报道了基于不同技术的多种CA抑制剂的筛选方法。本文将对这些筛选方法进行综述。
3.1非同位素标记非均相筛选法在体外,CA组装成与真实病毒类似的富勒烯的稳定结构需要苛刻的反应条件:高浓度CA和高离子强度(> 1 mol·L-1NaCl)缓冲液,限制了其直接应用。研究发现,在脱氧寡核苷酸存在下,较低浓度的HIV-1 Gag蛋白就能够在低离子强度的缓冲液中完成组装。基于此原理,研究人员设计了一种在体外高通量筛选CA抑制剂的方法:将5′端标记生物素(biotin)的脱氧寡核苷酸d(TG25)固定到中性亲和素(neutravidin)包被的黑色384孔板,过夜孵育,洗去未结合的biotin-d(TG25),加入5′端标记荧光素(fluorescein)的脱氧寡核苷酸d(TG25)和CA-NC蛋白。溶液中的fluorescein-d(TG25)引发CA-NC组装,之后fluorescein-d(TG25)-CA-NC复合物会结合至biotin-d(TG25)。通过检测荧光,将实现对CA-NC组装的检测。如果CA-NC组装被小分子抑制,fluorescein-d(TG25)和CA-NC将一同被洗掉,无法检测到荧光信号,CA-NC的组装数量与荧光信号呈正相关(Fig 1)[10]。使用该方法,他们发现苯二氮类(benzodiazepines)和苯并咪唑类化合物具有抑制CA组装的活性。该筛选方法采用生物素-亲和素系统,优点是:结合牢固,信号多级放大,操作简单,可实现高通量筛选。缺点是:亲和素包被的微孔板和荧光标记的脱氧寡核苷酸底物,易造成非特异性吸附,需要通过洗板消除背景信号造成的干扰。
3.2同位素标记均相筛选法邻近闪烁分析(scintillation proximity assay, SPA)是通过检测放射性同位素衰变中产生的β射线激发闪烁剂发光,实现对分子相互作用检测的一种技术,被广泛用于药物筛选中。有研究发现,在体外,化合物PF-3450074(PF74)能与CA六聚体发生高亲和力结合(Kd值为262 nmol·L-1)[11]。为了筛选能够竞争PF74结合位点的抑制剂,研究人员基于SPA技术,设计了一种高通量的CA抑制剂筛选方法(Fig 2):先在体外准备好生物素化的CA六聚体(bhCA-1),然后将bhCA-1、链霉亲和素包被的SPA微珠和3H同位素标记的PF74([3H]PF74)加入384孔板中孵育。没有竞争性小分子存在的时候,3H标记的PF74与CA六聚体结合,同位素3H衰变产生的弱β粒子将其能量转移给SPA微珠表面的闪烁剂,激发闪烁剂发射光子并被检测器记录;当没有竞争性小分子存在时,[3H]PF74将很少甚至不会结合到CA六聚体,3H衰变产生的弱β粒子因距离关系(>1.5 μm)无法将其能量转移给SPA微珠表面的闪烁剂,检测信号减弱或者消失[12]。该法的优点是:无需离心、洗涤和过滤等物理过程,灵敏、快速、均相,信号稳定,技术成熟,能用于高通量筛选,筛选得到的化合物结合位点明确。不足之处在于:实验中产生的同位素污染物需要特殊处理,检测信号易受小分子自身发色基团的影响而淬灭;SPA微珠表面会因非特异性吸附同位素标记的配体而产生非特异性信号;SPA 技术所用到的材料都非常昂贵,且为少数几家美国公司所垄断。
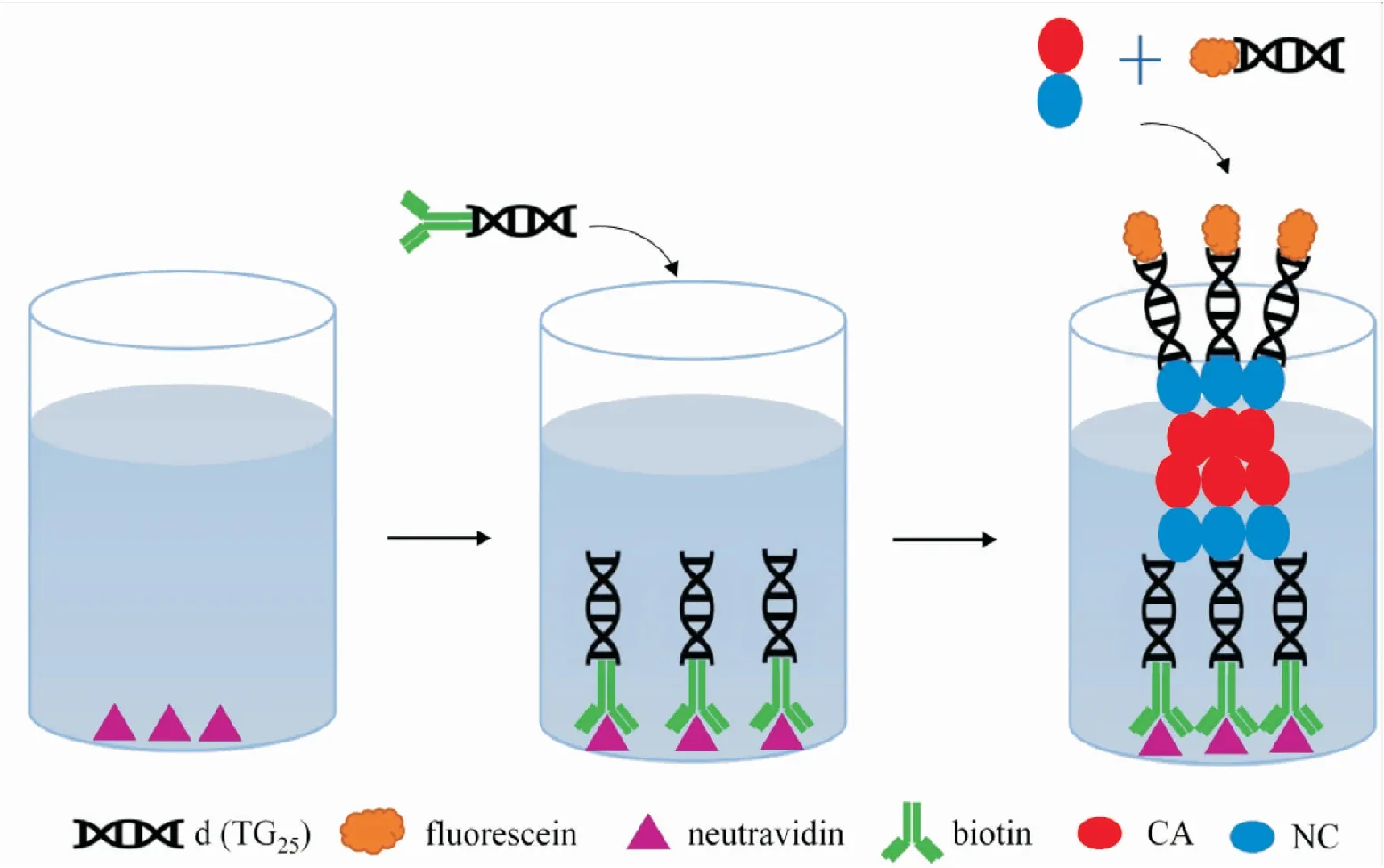
Fig 1 Schematic representation of in vitro capsid assembly assay based on association of CA-NC subunits on immobilized oligonucleotides d (TG25)
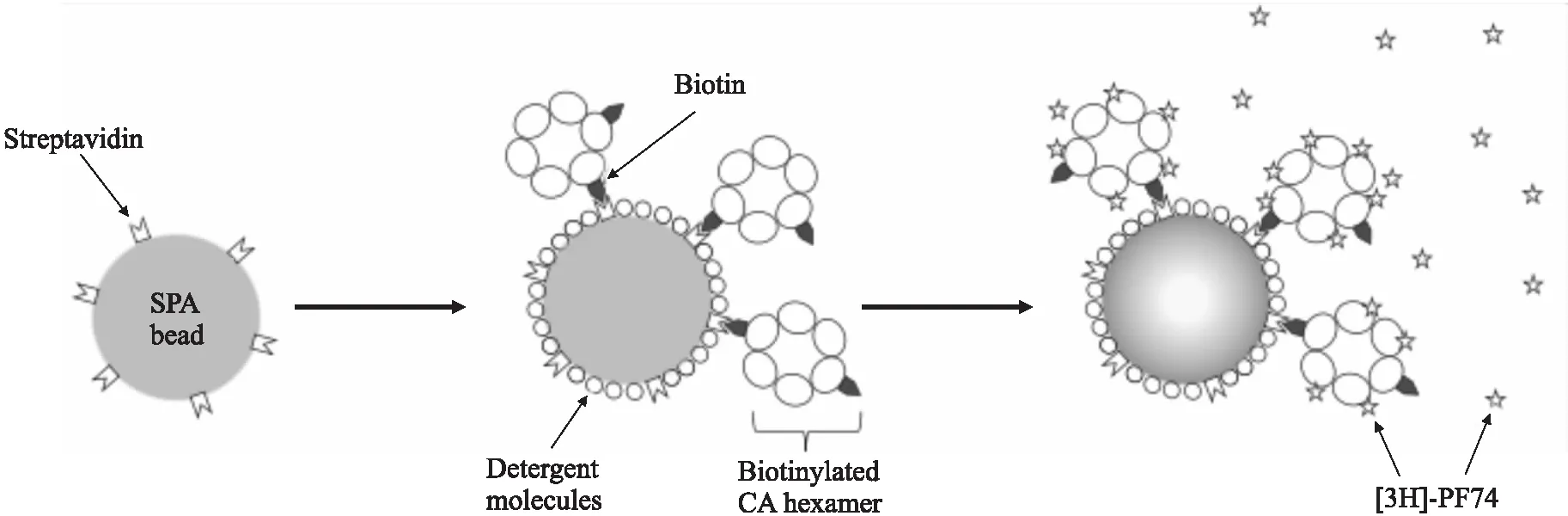
Fig 2 Diagram of SPA-based assay strategy[12]
3.3非同位素标记均相筛选法
3.3.1均相时间分辨荧光法(homogeneous time-resolved fluorescence, HTRF) HTRF技术是研究蛋白-蛋白相互作用的常用技术。研究人员基于HTRF设计了一种高通量的CA抑制剂筛选方法(Fig 3):将GST-CA CTD、CA CTD-Flag、待测化合物、Anti-6His-XL665荧光受体和Anti-GST Cryptate荧光供体一起孵育,在320 nm激光照射下,荧光供体吸收部分能量,产生波长为620 nm的荧光;当 GST-CA 和 CA-Flag形成二聚体时,拉近荧光供体和受体的距离,荧光受体受到转移过来的能量激发,发射出波长为665 nm的荧光;当有抑制剂存在时,GST-CA 和 CA-Flag不能形成二聚体,荧光受体不被激发,在665 nm处没有荧光信号产生,只有620 nm处的荧光信号[13]。该高通量筛选的Z因子为0.89,是一个非常理想的抑制剂筛选方法。应用该方法,他们从1 280个化合物中筛选到了1个活性分子依布硒啉(ebselen)。该筛选方法的优点是高通量、无需固相检测方法中的包被和洗板步骤,因此耗时短、灵敏度高,实时分辨荧光的引入,避免了化合物的自发荧光对实验的干扰。不足之处是受检测距离(8~10 nm,相当于60~80 ku的蛋白复合物)限制,无法检测分子量过大的蛋白-蛋白相互作用复合物。
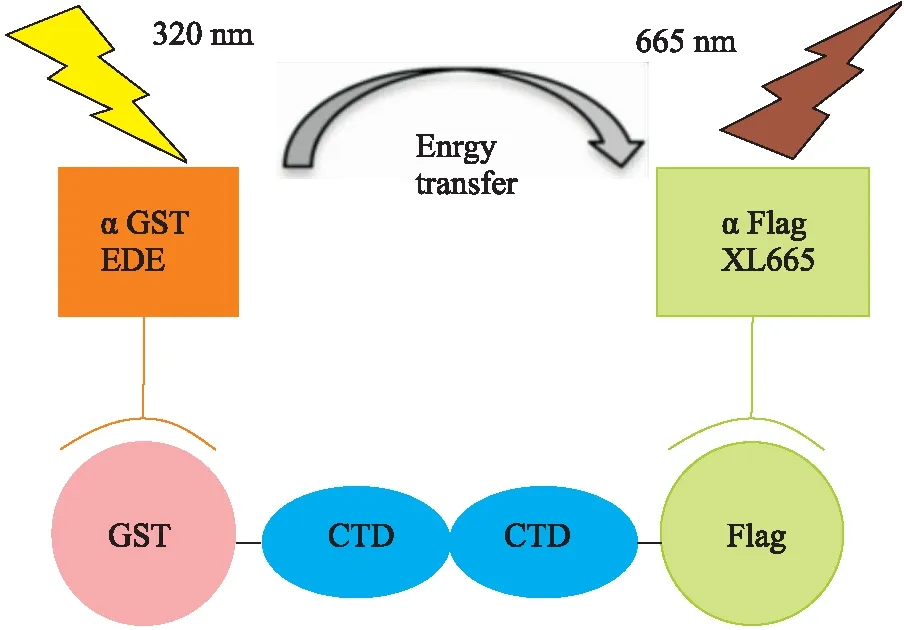
Fig 3 Schematic representation of HTRF assay [13]
3.3.2放大化学发光接近均相检测(amplified luminescent proximity homogeneous assay, ALPHA) ALPHA技术主要依赖于经过特殊处理的供体微珠(含光敏剂苯二甲蓝)和受体微(含二甲基噻吩、蒽、红荧烯)。当荧光供体和受体因蛋白-蛋白相互作用,彼此距离小于200 nm时,会引发级联反应,产生放大的信号,实现对蛋白质-蛋白质相互作用的检测。研究者利用ALPHA技术建立了一种高通量的CA抑制剂筛选方法(Fig 4):将GST-CA、CAI-biotin、Streptavidin-微珠(供体)、化合物以及GSH-微珠(受体)加入微孔板孵育,供体在激发光(680 nm激光)照射下产生单线态氧。当GST-CA/AI-biotin形成异二聚体时,会拉近荧光供/受体的距离,使得单线态氧能够有效的激发荧光受体产生荧光(波长为520~620 nm),反之,当抑制剂干扰GST-CA和CAI-biotin形成异二聚体,单线态氧因距离原因无法扩散至受体微珠,不能激发后者产生荧光信号[14]。应用该方法,他们从70 000多个小分子中筛选出了具有抑制CA蛋白活性的2-芳基喹唑啉类化合物。该方法的优点是高通量、无需固相检测方法中的包被和洗板步骤、耗时短、灵敏度高,筛选得到的化合物结合位点相对明确,能克服HTRF对于蛋白复合物尺寸的限制(相互作用复合物在200 nm范围内均可)。不足之处是设备和试剂成本高,不利于方法的推广使用。反应体系对于强光或者长时间室内光比较敏感。
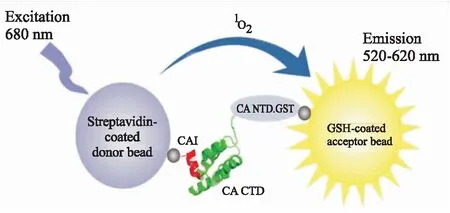
Fig 4 Principle of AlphaScreen high-throughput assay based on CAI binding to CA CTD [14]
3.4细胞水平的筛选方法
3.4.1噬菌体展示 噬菌体展示是一项用于筛选多肽或抗体药物的实验技术。Sticht等[15]利用噬菌体展示技术建立了一种高通量的CA抑制剂筛选方法:分别将CA蛋白和C-CANC蛋白作为筛选靶蛋白,固定于甲苯磺酰基修饰的磁珠表面,采用十二肽噬菌体展示库筛选。结果筛选到一个能够抑制CA组装的12肽CAI (ITFEDLLDYYGP)。该方法的优点价格低廉,不需要特殊仪器设备就能够实现,不足的地方是操作繁琐,只能筛选到多肽抑制剂。尽管无法直接筛选到小分子抑制剂,但是从噬菌体多肽库中筛选到的多肽抑制剂却为后续设计小分子CA抑制剂提供了良好的理论基础。
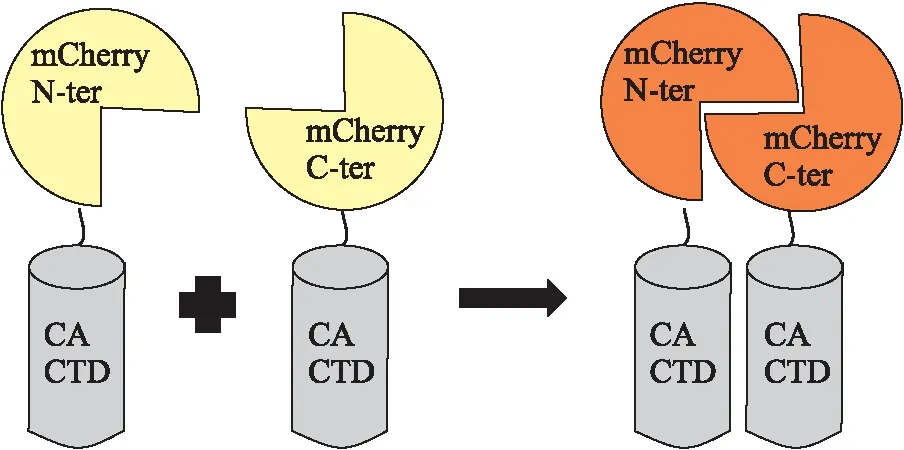
Fig 5 Principle of detection of CA CTD intermolecular interactions using BiFC assay [17]
3.4.3假病毒筛选 HIV-1假病毒筛选体系是一种基于单一复制周期HIV-1假病毒的药物筛选方法,因安全性高,已被广泛用于HIV-1的研究中[19]。Lamorte等[20]利用假病毒筛选体系,从600 000个结构类型丰富和复杂的化合物中,筛选到2个结构新颖的化合物BI-1和BI-2。Cao等[21]利用HIV-1假病毒筛选系统,从大于106个化合物中,筛选到1种具有新结构的CA抑制剂PF-1385801,经过结构改造得到了活性较好的候选化合物PF-3450074(PF74)。假病毒筛选方法的优点显而易见:免于接触活病毒,无需BSL-3实验室,安全性高;适合高通量药物筛选;宿主范围广,感染效率高。该技术的局限是:只能用于病毒复制早期阶段的抑制剂筛选,无法用于病毒复制晚期的抑制剂筛选;无法全面体现病毒特性,因此在药物筛选过程中可能更易出现假阳性。
3.5虚拟筛选分子生物学技术、X射线晶体学以及计算方法领域的不断进步,使得借助计算机技术和专业软件进行药物筛选得以实现,这门技术被称作虚拟筛选。Tang等[22]利用虚拟筛选,以CA的NTD的β-发卡裂口为筛选界面,得到了1个靶向CA CTD的小分子化合物CAP-1,这也是首个CA的小分子抑制剂。Curreli等[23]针对CA CTD中的1个疏水凹槽(由第169~191位氨基酸残基形成,是CAI 肽结合的 CTD 口袋),对ZINC化合物库中100 000个类药的分子进行了虚拟筛选,从中得到了2个靶向CA CTD的小分子compound 6和compound 50。Kortagere等[24]使用基于药效团的虚拟筛选方法,结合PDB数据库中的晶体数据(Protein Databank entry 3H4E),筛选到了1个靶向CA蛋白N末端(CA NTD)的小分子抑制剂I-XW-053。与传统实验筛选相比,虚拟筛选优势在于高效、快速、经济,但该方法只能针对具有晶体结构的药物靶点进行筛选,限制了其在药物筛选中的应用。
4总结和展望药物筛选的方法一般可归为3类:基于表型的药物筛选、基于靶点的药物筛选和基于结构的药物筛选[25]。目前发表的CA抑制剂筛选方法均属于这3类方法的范畴。在这些方法里面,除了虚拟的筛选方法外,其余方法全部是基于生物化学实验的筛选体系,未见基于生物物理方法建立的筛选体系。CA蛋白的组装过程是蛋白-蛋白相互作用不断发生和稳定的过程,因此,CA蛋白抑制剂实际上就是一类蛋白-蛋白相互作用抑制剂。蛋白-蛋白相互作用作用的界面面积较大(一般在1 000~6 000 Å2之间,传统的药物结合口袋面积一般小于1 000 Å2),通常被认为是无成药性的靶点。因而,与HIV-1的3个酶(整合酶、蛋白酶和逆转录酶)相比,针对CA的小分子抑制剂研究进展相对缓慢。生物物理的方法(比如SPR、ITC、MST、NMR、BLI等)主要被用于分析生物分子之间的相互作用,尤其适用于蛋白-蛋白相互作用的药物筛选,在未来应该将生物物理的方法用于CA蛋白抑制剂的筛选中,以加快CA蛋白抑制剂的筛选进程。另外,目前药物筛选库中的化合物大多符合类药五规则(rule of five),这些分子的分子质量一般小于500 u,难以实现阻断蛋白-蛋白相互作用的任务。因此,在寻找CA抑制剂的过程中,必须打破类药五规则,突破常规,才能更快地寻找到相应的抑制剂 。综上所述,药物筛选是一项系统工程,选择具有蛋白-蛋白抑制剂特点的小分子,将实验筛选(包括生物化学和生物物理的方法)和虚拟筛选相结合,将是今后CA抑制剂筛选的方向,有望筛选出用于临床的CA抑制剂。

