消退素D1抑制NLRP3信号通路对DSS结肠炎小鼠的影响
方 晨,梅咏玉,王 晶,杨 彬,刘晓昌,许建明,梅 俏
(安徽医科大学第一附属医院消化内科,安徽省消化病重点实验室,安徽 合肥 230022)
炎症性肠病(inflammatory bowel disease, IBD)是一种病因尚不完全明确的慢性肠道炎症性疾病。IBD的发病机制可能与遗传、感染、环境、免疫等因素有关,其中,黏膜免疫异常在IBD的持续肠道炎症过程中具有重要作用[1]。
IBD治疗的主要方向是恢复促炎因子与抗炎因子之间的平衡[1],调节肠道黏膜免疫异常。在肠道免疫功能的调节过程中,炎症小体的活化发挥重要影响,其中NOD样受体家族3(NOD-like receptor protein 3, NLRP3)炎症小体是目前研究最广泛的炎症小体,参与了炎症性疾病的发生、发展。Zhang等[2]研究发现,NLRP3基因多态性与IBD风险增加有关。NLRP3炎症小体是一种多蛋白复合物,负责IL-1β和IL-18的蛋白水解成熟和分泌。NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白[apoptosis associated speck-like protein containing a caspase activation and recruitment domain(CARD),ASC]和胱天蛋白酶 1(caspase-1)组成,被激活时,NLRP3受体通过ASC聚合并募集和活化pro-caspase-1,活化的caspase-1切割无活性的pro-IL-1β和pro-IL-18,并以成熟形式分泌,加重IBD中肠道炎症过程[3]。
炎症消退是炎症过程的重要调控机制,由一系列抗炎介质控制,其中消退素 D1(resolvin D1,RvD1)是体内重要的促炎症消退因子。RvD1最早由小鼠腹腔炎性渗出物中分离,是由ω3- 二十二碳六烯酸(DHA)衍生的内源性抗炎和促进炎症消退的脂质分子。RvD1发挥限制中性粒细胞黏附与浸润、限制炎症损伤等作用[4]。Bento等[5]、Norling等[6]在结肠炎、关节炎等方面研究均证明RvD1可以改善组织炎症,保护相关器官功能,但RvD1抗结肠炎的具体机制尚不十分清楚。因此,本研究通过探讨RvD1对结肠炎小鼠肠道炎症过程中NLRP3信号通路的影响,为RvD1抗结肠炎作用提供实验依据。
1 材料
1.1实验动物C57BL/6小鼠32只,♂,6~8周龄,体质量(18~22) g,购自安徽省动物中心,No.34000200001280。实验前适应性饲养1周,温度(20~26) ℃,相对湿度40%~70%。
1.2试剂葡聚糖硫酸钠(dextran sodium sulfate, DSS),美国Sigma公司;RvD1,美国Cayman公司;髓过氧化物酶(myeloperoxidase,MPO)试剂盒,南京建成生物工程研究所;IL-1、IL-6、IL-10、TNF-α试剂盒,均购自武汉新启迪生物科技有限公司;抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、NLRP3、ASC、caspase-1 p20、IL-1β、pro-IL-1β抗体,均购自Bioss生物科技有限公司;抗β-actin抗体,北京中杉生物科技有限公司;DNA合成试剂盒,美国Thermo Scientific公司;QuantiNova SYBR Green PCR试剂盒,德国Qiagen公司。
1.3仪器EPS 300型电泳仪(上海天能科技有限公司);TS-1000水平摇床(海门市其林贝尔仪器制造有限公司);K960型PCR仪(杭州晶格科学仪器有限公司);PikoReal 96型荧光定量PCR仪(Thermo Scientific公司);高速台式冷冻离心机(安徽嘉文仪器装备有限公司);Elx800型酶标仪(美国 Bio-Tek公司);752N型可见紫外分光光度计(上海精密科学仪器有限公司)。
2 方法
2.1模型的制备与实验分组按Chu等[7]方法,使用DSS建立小鼠实验性结肠炎模型。实验分为4组:A组为正常组,小鼠自由饮水,并腹腔注射生理盐水;B组为RvD1对照组,小鼠自由饮水并腹腔注射RvD1;C组为DSS模型组,小鼠给予5% DSS溶液自由饮用,并腹腔注射生理盐水;D组为RvD1给药组,小鼠给予5% DSS溶液自由饮用,并腹腔注射RvD1。将RvD1溶于生理盐水,分别于d 2、4、6进行小鼠腹腔注射(50 μg·kg-1)。实验d 8处死所有小鼠,分离血清于-80 ℃保存,同时收集小鼠小肠和结肠组织,待测样品液氮储存。
2.2结肠炎程度评估实验期间每天观察小鼠体质量、大便性状和便血情况,进行疾病活动指数(disease activity index,DAI)评分[8]。大便隐血检测采用潜血检测试纸进行。将取出的结肠组织用福尔马林固定并石蜡包埋,切片厚4 μm,HE染色,进行组织学指数(histological index,HI)评分[9]。用生理盐水制备10%结肠组织匀浆。按ELISA试剂盒说明,检测结肠组织匀浆中MPO活性。
2.3小肠黏膜通透性检测按文献方法[10]制备小肠肠囊,注入伊文思蓝0.2 mL,置于20 mL Krebs液烧杯中,95% O237 ℃水浴,30 min后取出肠囊组织,生理盐水冲洗肠腔,37 ℃干燥,加入1 mL甲酰胺溶液,50 ℃孵育24 h,取出肠组织,溶液离心沉淀,取上清液进行紫外分光光度计检测,检测波长为655 nm。
2.4透射电镜观察将小肠组织于2.5%戊二醛中4 ℃固定6 h,1%锇酸固定,梯度浓度乙醇脱水,环氧树脂包埋,70 nm切片,JEM-1230F电子显微镜观察小鼠小肠黏膜上皮细胞连接情况。
2.5结肠组织中IL-1、IL-6、IL-10和TNF-α水平测定按ELISA试剂盒说明书,检测小鼠结肠组织中IL-1、IL-6、IL-10和TNF-α水平。
2.6Westernblot检测结肠组织中相关蛋白的表达从结肠组织中提取蛋白质,使用SDS-PAGE分离,并转移至PVDF膜。在室温下用封闭液(5%脱脂乳)封闭2 h。将膜与一抗在4 ℃孵育过夜,一抗包括ASC、NLRP3、caspase-1、IL-1β、pro-IL-1β、iNOS(1 ∶300)及β-actin(1 ∶1 000)。TBST洗涤,将HRP连接的二抗在室温下与膜孵育2 h。再次洗涤,使用ECL蛋白质印迹检测系统和ImageJ软件检测分析结果。
2.7qPCR检测小鼠结肠组织IL-1β、iNOSmRNA表达使用TRIzol试剂从巨噬细胞和结肠组织中提取总RNA。用RevertAidTMM-MuLV逆转录酶进行逆转录,合成DNA第一链,并按DNA合成试剂盒的说明,将RNA逆转录成cDNA。使用QuantiNova SYBR Green PCR试剂盒扩增获得的cDNA用于定量PCR。以β-actin作为内参,测量目的基因相对表达。引物序列(正向和反向)为:β-actin:5′-AGTGTG ACGTTGACATCCGT-3′和5′-TGCTAGGAGCCAGAG CAGTA-3′; iNOS:5′-CCTTGTTCAGCTACGCCTTC-3′和5′-CTTCAGAGTCTGCCCATTGC-3′; IL-1β:5′-GA AGAAGAGCCCATCCTCTG-3′和5′-TCATCTCGGAGC CTGTAGTG-3′。
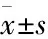
3 结果
3.1RvD1对结肠炎小鼠肠道炎症的影响与正常组小鼠相比,模型组小鼠DAI评分、HI评分、MPO水平明显升高(Fig 1A、1B、1C),病理可见结肠中大量中性粒细胞浸润,隐窝明显减少,并累及部分上皮细胞(Fig 1D);RvD1组小鼠DAI评分、HI评分及MPO水平明显降低,病理可见结肠中性粒细胞浸润减少,隐窝数量基本正常,表明RvD1可以改善DSS结肠炎小鼠中结肠炎症损伤程度。
3.2RvD1对结肠炎小鼠肠黏膜屏障功能的影响如Fig 2所示,与正常组小鼠相比,模型组小鼠小肠肠囊中伊文思蓝浓度明显上升,电镜可见小肠上皮细胞绒毛杂乱,密度不均,细胞间连接增宽;RvD1组小鼠小肠肠囊中伊文思蓝浓度降低,电镜可见上皮绒毛稍稀疏,但排列规整,细胞间隙基本正常,表明RvD1可改善DSS引起的小鼠小肠结构和功能破坏。
3.3RvD1对结肠炎小鼠结肠组织匀浆IL-1、IL-6、IL-10、TNF-α水平的影响Tab 1结果显示,与正常组小鼠相比,模型组小鼠结肠组织中IL-1、IL-6、TNF-α水平增高,IL-10水平降低;与模型组小鼠相比,RvD1组小鼠结肠组织中IL-1、IL-6、TNF-α水平降低,IL-10水平增加。提示RvD1可调节DSS结肠炎小鼠肠黏膜中细胞因子水平,发挥抗结肠损伤作用。
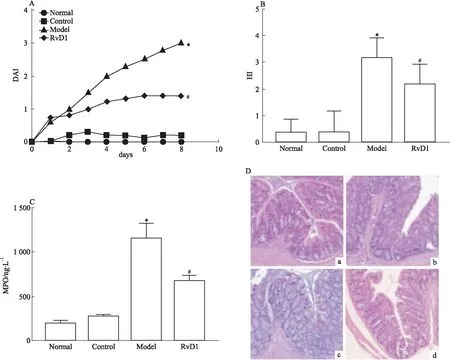
Fig 1 Effect of RvD1 on colonic inflammation in DSS-induced colitis
A:DAI scoring; B: HI scoring; C: MPO activity; D: Histopathologic features of the colon. a: Normal group; b: RvD1 control group; c: Model group;d: RvD1 group.*P<0.05vsnormal group;#P<0.05vsmodel group.
3.4RvD1对DSS结肠炎小鼠结肠组织中NLRP3炎症小体表达的影响通过Western blot及qPCR检测结肠炎小鼠结肠NLRP3炎症小体相关标志物,包括ASC、NLRP3、IL-1β、pro-IL-1β、iNOS、caspase-1 p20。如Fig 3所示,与正常组小鼠比较,模型组小鼠结肠中ASC、NLRP3、IL-1β、pro-IL-1β、iNOS、caspase-1p20水平升高;与模型组小鼠比较,RvD1组小鼠结肠中ASC、NLRP3、IL-1β、pro-IL-1β、iNOS、caspase-1 p20水平降低。表明RvD1可降低NLRP3炎症小体信号通路中主要标志物的表达水平,改善结肠炎小鼠肠道炎症程度。
Fig 2 Effect of RvD1 on intestinal barrier function and structure in DSS-induced colitis mice
*P<0.05vsnormal group,#P<0.05vsmodel group
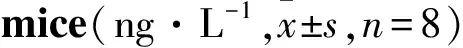
Tab 1 Effect of RvD1 on contents of IL-1, IL-6, IL-10 and TNF-α in DSS-induced colitis
*P<0.05vsnormal;#P<0.05vsmodel
4 讨论
IBD治疗药物包括氨基水杨酸制剂、糖皮质类激素、免疫抑制剂和各种生物制剂(如TNF-α单抗等),这些药物长期使用会引起明显的副作用,如激素依赖、骨髓抑制和严重感染。因此,探讨更为安全有效的抗结肠炎药物是目前IBD研究的热点之一。
RvD1作为消退素家族中的一员,在体内起到重要的抗炎作用,其机制与限制中性粒细胞黏附与浸润有关[4]。相关研究证实RvD1具有改善组织炎症,保护器官功能的作用[5-6],但RvD1抗结肠炎的具体机制尚不十分清楚。本研究结果显示,腹腔注射RvD1可明显降低实验性结肠炎小鼠的DAI和HI评分,降低结肠组织中MPO水平。同时发现RvD1具有维持肠上皮完整性和通透性的作用。表明RvD1可以有效改善实验性小鼠结肠炎的炎症损伤。另外,RvD1可以降低结肠组织中IL-1、IL-6、TNF-α水平,升高IL-10水平,发挥调节细胞因子水平的作用。
IL-1β在结肠炎症的促炎因子释放中起重要作用,可以上调IL-6、TNF-α等促炎因子的表达,扩大和加重结肠炎症损伤。NLRP3炎症小体作为IL-1β成熟释放的关键信号通路[11],在肠道内稳态和炎症中起重要作用,有研究显示DSS可以激活巨噬细胞NLRP3炎症小体,用DSS或TNBS处理的NLRP3-/-小鼠结肠炎症减轻,结肠组织中促炎细胞因子水平较低[12-13]。本研究发现,DSS模型组中NLRP3、ASC、caspase-1 p20表达量均明显增加, IL-1β、iNOS水平增加;RvD1可以降低结肠炎小鼠结肠组织中NLRP3、ASC、caspase-1 p20、IL-1β、iNOS表达,表明RvD1具有通过抑制NLRP3炎症小体的活化,抑制促炎因子合成,改善小鼠结肠炎症的作用。目前,有关NLRP3炎症小体在实验性结肠炎中的作用存在一定争论。有研究显示,NLRP3-/-小鼠对实验性结肠炎更敏感[14-15],原因可能为NLRP3作为先天性免疫的的重要组成部分,起到维持肠内稳态的关键作用,当NLRP3功能缺失,造成肠道微生物紊乱引起的黏膜损伤,是IBD可能的致病机制之一,经过抗生素处理的NLRP3-/-小鼠结肠炎症减轻[15]。
综上所述,本研究发现RvD1可以减轻DSS结肠炎小鼠结肠炎症的严重程度,保护肠道屏障功能,其机制可能与抑制NLRP3炎症小体活化,调控促炎细胞因子表达有关,提示RvD1可作为治疗IBD治疗的潜在候选药物。

