利福平和异烟肼致小鼠肝损伤模型的特征研究
向晓雪,艾佳晨,赵 科,刘志寿,向菊芳,华晓萍,谭正怀
(1. 四川中医药高等专科学校药学院,四川 绵阳 621000;2. 昆明科灵生物科技有限公司,云南 昆明 650000;3. 四川省中医药科学院,四川 成都 610041;4. 大竹县人民医院药剂科,四川 达州 625100;5. 成都中医药大学药学院,四川 成都 610072;6. 四川大学药学院,四川 成都 610014)
WHO发布的《2017年全球结核病报告》指出:据估算,2016年全球新发结核病患者约1 040万例,与2015年一致[1]。目前,我国仍然是全球30个结核病高负担国家之一,每年新发结核病患者约90万例,位居全球第3位[2]。治疗结核病需要多种抗结核药物联合使用半年以上,而这些药物所致的主要毒性或不良反应是肝毒性,轻者为血清氨基转移酶一过性升高,在疗程中可自行恢复。重者则表现为食欲不佳、异常乏力或软弱、恶心或呕吐、深色尿、眼或皮肤黄染,严重者出现肝衰竭[3]。异烟肼(isoniazid, INH)、利福平(rifampicin, RIF)、吡嗪酰胺、乙胺丁醇均可引起肝脏损害[4]。许多患者由于发生严重的肝脏毒性而不得不终止治疗,反复多次终止治疗常诱发结核杆菌的耐药性,最终导致患者无药可治而死亡[5]。
研发针对抗结核药物所致肝损伤的治疗药物,是全球医药工作者所追求的主要目标。研究药物的主要工具是动物模型,目前已经建立了RIF联合INH致动物肝损伤模型[6-7],但单独使用RIF或INH复制肝损伤模型,以及INH和RIF联合使用所致肝损伤3种动物模型的异同,INH与RIF合用对肝损伤的相互作用本质等问题,均未得到相关实验佐证。为此,本文拟通过析因设计,探讨INH、RIF单独使用致肝损伤的特点,RIF、INH二药在RIF联合INH致肝损伤中的地位及相互作用。
1 材料
1.1药物与试剂利福平胶囊(每粒0.15 g,批号:171102)、异烟肼片(每片0.1 g,批号:150901),均为成都锦华药业有限公司生产。临用前,用0.5% CMC配成所需浓度的混悬液备用。直接胆红素(direct bilirubin,DBIL,货号:CH0105004)、丙氨酸氨基转移酶(alanine aminotransferase,ALT,货号:CH0105201)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST,货号:CH0105202)、总胆红素(total bilirubin, TBIL,货号:CH0105003) 测定试剂盒,均购自四川迈克生物科技股份有限公司。
1.2实验动物昆明种(KM)小鼠,SPF级,♂,体质量(18~22) g,由四川省中医药科学院实验动物中心提供,合格证号:SCXK(川)-2013-19。小鼠饲养于四川省中医药科学院实验动物中心屏障系统,合格证号:SYXK(川)-2013-100,室温(22~25) ℃,湿度(50±5)%,明暗各12 h。
1.3仪器7020型全自动生化分析仪(日本株式会日立高新技术)。
2 方法
2.1分组与指标检测
2.1.1单独灌胃RIF 1次后不同时间对小鼠的影响 90只小鼠适应性喂养1 d后,按照体质量随机分成对照组、RIF 100 mg·kg-14个时间点组、 RIF 300 mg·kg-14个时间点组,每组10只。分别灌胃RIF 100、300 mg·kg-1或等体积0.5% CMC-Na溶液。给药后禁食不禁水,分别在给药后2、4、8、12 h处理小鼠,称体重,断头取血,用全自动生化仪测ALT、AST、TBIL、DBIL,取肝脏,计算肝指数。
2.1.2连续灌胃RIF、INH或RIF+INH对小鼠的影响 小鼠适应性喂养1 d后,采用析因设计,按照体质量随机分成对照组、INH 150 mg·kg-1组、RIF 300 mg·kg-1组、RIF 150 mg·kg-1+INH 300 mg·kg-14个大组,每个大组又随机再分为3个小组,即给药1周、给药2周、给药3周组。每天灌胃给药,连续给药至预定时间点,禁食不禁水16 h后,取血清,测定其ALT、AST、TBIL, 取肝脏称湿重,计算其脏器指数;取部分肝脏置于10%福尔马林中固定后进行切片,HE染色。由病理学专家在显微镜下根据Tab 1的标准进行盲法评分。
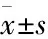
3 结果
3.1灌胃RIF1次后小鼠血清转氨酶活性不随时间发生明显变化由Tab 2可见,灌胃RIF 100 mg·kg-1或RIF 300 mg·kg-1后8 h内,小鼠血清ALT和AST活性均无明显改变,于给药后12 h血清转氨酶活性有所降低,与对照组比较差异具有统计学意义,可能与给药组禁食时间较长有关,无任何生物学意义。灌胃RIF 100 mg·kg-1或RIF 300 mg·kg-1后12 h内,小鼠总胆红素和直接胆红素均明显升高,一直升高到给药后12 h,与对照组比较差异具有统计学意义。随着给药后禁食时间的延长,其肝脏指数逐渐减小,并在给药后12 h与对照组比较有统计学差异,提示肝脏指数的改变可能与禁食时间密切相关,而与血中胆红素水平的变化无明显相关性。
3.2连续灌胃RIF、INH、INH+RIF1周对小鼠肝损伤相关指标的影响由Tab 3可见,连续灌胃INH 150 mg·kg-11周,可明显增加小鼠肝脏指数,与对照组比较差异具有统计学意义,但对其他指标无明显影响,同时病理学检查结果显示(Fig 1),小鼠肝脏无明显损伤;连续灌胃RIF 300 mg·kg-1或INH 150 mg·kg-1+RIF 300 mg·kg-11周,可明显增加小鼠肝脏指数,升高ALT、AST及TBIL水平,与对照组比较差异具有统计学意义,同时病理学结果显示(Fig 1),小鼠肝细胞空泡形成明显,且INH+RIF组病变更为严重,两组差异有统计学意义(P<0.05)。
3.3连续灌胃RIF、INH、INH+RIF2周对小鼠肝损伤相关指标的影响Tab 4、Fig 1结果显示,连续灌胃INH 150 mg·kg-12周,对小鼠肝脏组织有轻度损伤,与对照组比较差异有统计学意义。连续灌胃RIF 300 mg·kg-1或INH 150 mg·kg-1+RIF 300 mg·kg-12周,对小鼠肝组织造成较重的损伤,与对照组比较差异具有统计学意义,与INH组比较差异亦有统计学意义(P<0.05),RIF组与INH+RIF组之间病变程度差异无统计学意义(P>0.05)。
由Tab 4可见,连续灌胃INH 150 mg·kg-1、RIF 300 mg·kg-1、INH 150 mg·kg-1+RIF 300 mg·kg-12周,均可明显增加小鼠肝脏指数,升高小鼠血清AST、TBIL水平,与对照组比较差异具有统计学意义;连续灌胃RIF 300 mg·kg-1或INH 150 mg·kg-1+RIF 300 mg·kg-12周,均可明显增加小鼠ALT血清水平,与对照组比较差异具有统计学意义。Tab 5的析因方差分析结果显示,在增加小鼠肝脏指数,升高小鼠血清ALT方面, INH和RIF均有明显作用,在增加小鼠血清AST、TBIL水平方面,RIF发挥了主要作用;同时,除了在TBIL方面,INH和RIF无相互作用,其他方面均显现出一定的相互拮抗作用,尤其是对肝脏指数及ALT的影响,INH和RIF联用拮抗作用较为明显。
3.4连续灌胃RIF、INH、INH+RIF3周对小鼠肝损伤相关指标的影响Tab 6、Fig 1结果显示,连续灌胃INH 150 mg·kg-1、RIF 300 mg·kg-1或INH 150 mg·kg-1+RIF 300 mg·kg-13周,对小鼠肝组织均可造成损伤,与对照组比较差异具有统计学意义,且连续灌胃RIF 300 mg·kg-1或INH150 mg·kg-1+RIF 300 mg·kg-13周较连续灌胃INH 150 mg·kg-13周引起的肝损伤更为严重,差异有统计学意义,但RIF组与RIF+INH组之间无明显差异。
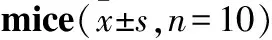
Tab 2 Effects on liver function index at different time after once-daily treatment of RIF in
*P<0.05,**P<0.01vscontrol group
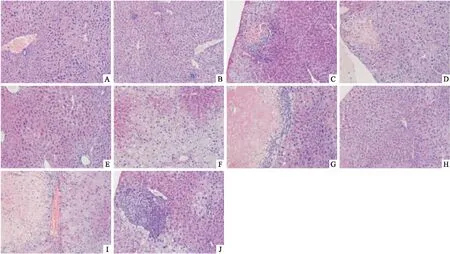
Fig1EffectsofINH,RIForINH+RIFonliverhistopathologyinmiceatdifferenttime(HE×200) A: Control group; B: Administered INH for one week; C: Administered RIF for one week; D: Administered RIF+INH for one week; E: Administered INH for two weeks; F: Administered RIF for two weeks; G: Administered INH+RIF for two weeks; H: Administered INH for three weeks; I: Administered RIF for three weeks; J: Administered INH+RIF for three weeks.
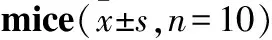
Tab 3 Effects on liver function index after successive medication of RIF/INH for one week in
*P<0.05,**P<0.01vscontrol group;##P<0.01vsRIF group
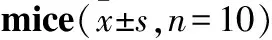
Tab 4 Effects on liver function index after successive medication of RIF/INH for two weeks in
*P<0.05,**P<0.01vscontrol group
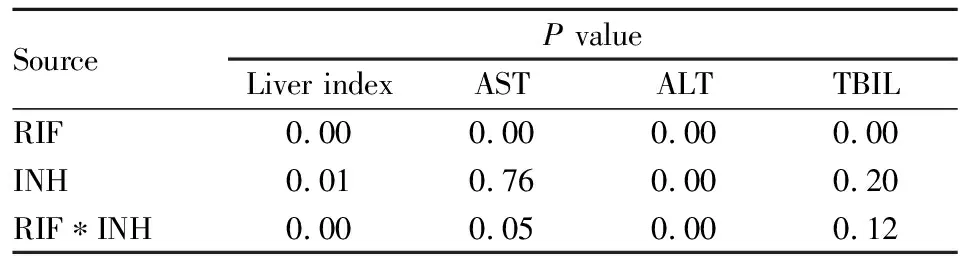
Tab 5 Liver index and hepatic biochemical index of factorial design AONVA in mice after successive medication for two weeks
由Tab 6可见,连续灌胃INH 150 mg·kg-1、RIF 300 mg·kg-1或INH 150 mg·kg-1+RIF 300 mg·kg-13周,均可明显增加小鼠肝脏指数;连续灌胃RIF 300 mg·kg-1或INH 150 mg·kg-1+RIF 300 mg·kg-13周,均可明显升高小鼠血清ALT、TBIL水平;连续灌胃RIF 300 mg·kg-13周,可明显增加小鼠AST水平,与对照组比较差异具有统计学意义。Tab 7的析因方差分析结果显示,RIF与INH联用,RIF、INH在小鼠血清ALT水平升高中均发挥了作用;RIF对肝脏指数增加,AST、TBIL水平升高有明显作用,而INH的作用不明显;同时,结果显示INH与RIF联用过程中,对小鼠的肝指数,ALT、TBIL水平的影响均表现出明显的相互拮抗作用。
4 讨论
长期以来,人们普遍认同RIF对肝脏引起的损伤主要是胆汁淤积所致,但其是否对肝细胞有直接损伤未见报道。本研究发现,单次灌胃RIF即可引起直接胆红素和总胆红素明显升高,而对肝损伤相关指标如ALT、AST以及肝脏指数,均无明显影响,证实了RIF对肝的损伤作用主要因为胆汁的间接作用,而对肝组织无明显的直接损伤作用。同时,也有文献认为RIF单独使用对肝脏的毒性作用较小[8],也有报道大鼠、小鼠单独使用RIF均可表现明显的肝脏毒性[9]。本研究发现,RIF在给药1周后即出现明显的肝脏毒性,随着给药时间的延长,其毒性作用逐渐增加,尤其以胆红素和肝脏指数表现突出。
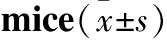
Tab 6 Effects on liver function index after successive medication of RIF/INH for three weeks in
*P<0.05,**P<0.01vscontrol group;##P<0.01vsINH group
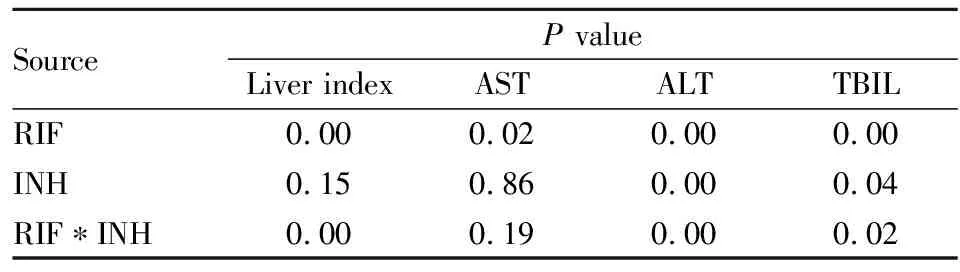
Tab 7 Liver index and hepatic biochemical index of factorial design AONVA in mice after successive medication for three weeks
临床上发现INH单独使用对肝脏具有明显的毒性作用,症状为黄疸,伴恶心、呕吐、厌食等临床表现[10]。有文献报道[11],大鼠单独使用INH可引起明显的肝损伤;但也有学者将介导异烟肼肝毒性的代谢产物肼和乙酰肼对小鼠进行染毒,染毒剂量设置为100 mg·kg-1,结果并未发现明显的药物性肝损伤[12]。本研究发现,单独使用INH 150 mg·kg-1(相当于临床人用量的60倍)对小鼠仅有轻度肝损伤,这种损伤主要发生在连续给药后2~3周,且仅表现在组织上,其转氨酶及总胆红素的变化并不大。
INH、RIF的联合干预通常作为针对结核杆菌的一线治疗方式,其常见的不良反应为药物性肝损伤[13]。亦有资料显示,无论大鼠或小鼠联合应用INH和RIF,均可引起明显的肝脏毒性作用[6-7]。INH、RIF联用毒性增强的机制目前并未完全阐明,有人认为是肝药酶之间的相互作用所致[14],也有人认为是RIF通过细胞色素P450和孕烷X受体(pregnane X receptor, PXR)增加INH的代谢[15]。
目前,RIF是否能增加INH的肝毒性尚有争议。有文献指出,INH的肼类代谢产物为联合化疗时产生肝毒性的主要因素,RIF的肝微粒体酶诱导作用可增强INH的肝毒性,对胆红素代谢产生竞争性抑制[14]。但也有研究以大鼠为实验对象,发现RIF不会增加由INH诱导的DNA加合物的形成,不会增加INH诱导的肝脏CYP2E1的氧化作用[16]。本文研究发现,无论在肝脏指数、转氨酶活性以及肝脏病理评分方面,INH均有明显拮抗RIF肝脏毒性的作用,其机制可能与降低血液总胆红素水平有关,详细机制有待进一步探讨。
由此可见,建立INH和RIF所致的小鼠肝损伤模型,若单独采用INH灌胃给药的方式建模,小鼠肝损伤程度较小,使用意义不大;单独采用RIF或联合INH对小鼠灌胃给药,均可建立较成功的小鼠肝损伤模型。同时,本研究结果还提示,对于小鼠,在RIF与INH联合使用时,其肝毒性主要来源于RIF,后者对肝脏毒性则主要因为胆汁淤积。因此有效解决胆汁淤积,可能是防治RIF联合INH所致肝毒性的有效途径之一。
(致谢:本实验在四川省中医药科学院中药药理毒理研究所完成,在此对实验过程给予指导和帮助的老师和同学们表示感谢!)

