电离辐照损伤对小鼠睾丸组织氧化磷酸化信号通路的影响
罗芳芳,李 敏,易辉燕,,吴莎莎,唐 莉,王继生
[1. 西南医科大学药学院,四川 泸州 646000;2. 绵阳市第三人民医院(四川省精神卫生中心),四川 绵阳 621000]
电离辐射主要由X、γ射线电磁波或α、β粒子组成[1]。电离辐射致机体损伤主要是通过细胞凋亡、微循环障碍、DNA突变、癌变等途径,对人体的免疫系统、生殖系统、造血功能及代谢系统造成影响[2-3]。随着社会发展,人们在生活中常接触到电离辐射,如医疗辐射、电器辐射等,辐射损伤受到人们广泛关注,它已成为威胁人类健康的重要因素,尤其是近年来男性生殖功能下降和不育症发病率逐步增多,辐射对男性生殖系统的影响日益被重视。
睾丸作为男性重要的生殖器官,主要产生精子和分泌雄激素,它在男性生育功能的研究中至关重要[4]。睾丸对电磁辐射具有高度敏感性,可引起生精细胞超微结构损伤[5]。抗氧化酶活性下降,脂质过氧化增加,炎性因子的过度表达和基因转录异常可能是睾丸组织受损的重要原因[6]。辐射诱导的雄性生殖细胞毒性,可造成机体出现生育力下降,甚至不育[7]。研究辐射损伤机制有重要的意义,既研究发现电离辐射影响线粒体生理学多方面的报道,包括线粒体呼吸、ATP产生和线粒体动力学[8-9]。线粒体也被认为参与辐射诱导的细胞内和细胞间信号传导[10]。这些发现表明线粒体可能是电离辐射的重要靶标,在细胞放射应答中发挥重要作用。近年来,随着研究技术发展,人们开始利用蛋白质组学、相对和绝对定量(iTRAQ)、LC-MS/MS等技术手段,来研究辐射组织的差异表达蛋白、生殖细胞DNA损伤、信号通路等数据,从而寻找有价值的研究方向。本实验采取iTRAQ联合LC-MS/MS检测技术及生物信息学数据分析,提取出辐照组(ioning radiation,IR)与正常组小鼠睾丸组织比较后的差异表达蛋白质。运用David 6.8对差异蛋白进行KEGG富集分析,鉴定出生物信号通路,进一步筛选出氧化磷酸化这一信号通路进行详细分析。本实验为研究小鼠睾丸组织电离辐照后能量代谢损伤机制提供理论基础和备选分子靶标。
1 材料
1.1实验动物清洁级昆明种♂小鼠20只,体质量(20±2)g,购自第三军医大学实验动物中心,生产许可证号:SCXK(军)2012-0011。将实验小鼠在昼夜比为1 ∶1的环境下循环饲养,实验室保持室内温度(22~26) ℃,湿度44%~65%。给予所有小鼠正常饮食、饮水,饲养1周以适应环境。该实验已经通过绵阳市第三人民医院伦理会审核通过,均遵守实验动物照料和使用原则。
1.2试剂与仪器iTRAQ标记试剂盒(美国ABSCIEX公司);胰酶(美国Promega公司)。LC-6AD型高效液相色谱仪(日本岛津);TRIPLE TOF5600质谱仪配套软件(美国ABSCIEX公司);RVC 2-33 IR型真空离心浓缩仪(德国Christ);SPD2010型SpeedVac真空离心器(美国Thermo Savant)。
2 方法
2.1动物分组将实验小鼠随机分为空白组和IR组,每组10只。辐照前,每天给予所有小鼠正常饮水、饮食。
2.2建立电离辐照损伤模型IR组小鼠常规饲养7 d后,将小鼠置于自制的纸盒内,给予1次60Co γ射线全身辐照。辐照条件为[11]:5 Gy,辐照率为1.73 Gy· min-1。照射后,继续给予IR组和空白组小鼠正常饮水、饮食。
2.3标本收集在辐照完成7 d后,用3.5%水合氯醛麻醉小鼠,在无菌条件下解剖,切开小鼠阴囊暴露双侧睾丸,取出睾丸组织,经苏木精-伊红染色,确认模型成功后,将其余小鼠睾丸组织用0.9%灭菌生理盐水反复清洗后,放置于液氮速冻,-80 ℃冰箱保存。
2.4睾丸组织蛋白质的提取在裂解缓冲液中加入1 μL蛋白酶抑制剂、5 μL磷酸酶抑制剂和10 μL PMSF至混合均匀后,分装于2支冰上预冷玻璃匀浆器中。取冻存的小鼠睾丸组织,每组3只,PBS清洗,按组别放入玻璃匀浆器中,加预冷的裂解缓冲液裂解,手动充分研磨,至均质匀浆。冰上超声破碎,功率为80 W,超声0.8 s,关闭0.8 s,共3 min。加入5倍体积预冷丙酮混匀,静置于-20 ℃环境沉淀4 h,8000 r·min-1、4 ℃离心5 min,弃上清液,取沉淀,反复操作,至沉淀变为白色。
2.5蛋白定量、还原烷基化及酶切、标记、强阳离子交换器(strongcationexchanger,SCX)分级采用Bradford法测定实验样品的蛋白质浓度,利用二硫苏糖醇打开二硫键及碘代乙酰胺烷基化二硫键,使蛋白质充分变性。iTRAQ试剂平衡到室温后,紧接着离心至管底,再取150 μL异丙醇至iTRAQ试剂中溶解,取上述的酶解产物50 μL至新的离心管中,再加入iTRAQ试剂,在室温反应2 h,加入水,使有机相降低至50%以下终止反应,混合、涡旋振荡、离心后真空冷冻干燥。各组蛋白进行标记。将标记多肽混合物用流动相A(150 μL)经复溶、涡旋振荡处理后,12 000 r·min-1离心20 min,吸取上清液上样,流速0.8 mL·min-1,按不同的参数梯度洗脱,根据峰形和时间收集共收50个梯度,冷冻抽干后保存待用。
2.6质谱鉴定各组样品用Q-TOF(质谱TOF MS参数m/z:350~1500;积累时间:0.25 s)进行iTRAQ 标记样品的质谱信息的检测,获得iTRAQ 标记肽段的序列,再根据肽指纹图谱鉴定出相应蛋白质。两iTRAQ离子的峰面积比值可以反映样品中多肽和蛋白质的相对含量。
2.7统计学处理所有实验数据结果采用SPSS 22.0软件进行分析,数据方差齐性采用参数检验和非参数检验,方差齐则采用One-way ANOVA分析,两两比较用LSD检验;方差不齐则采用秩和检验。
3 结果
3.1HE染色Fig 1的HE染色结果可见,正常组睾丸组织曲细精管结构完整,生殖上皮基膜完整,曲细精管管腔内可见各级细胞精母细胞发育正常,由外到内排列紧密整齐,层次清晰分明。精子数量多,无炎细胞,凋亡罕见。辐射组与正常组相比较,可见生精小管排列有紊乱疏松,管腔内精子量减少,凋亡细胞数量增加。
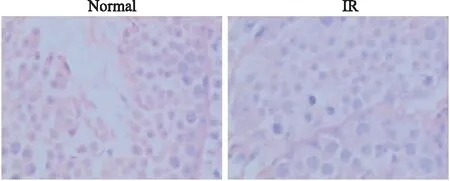
Fig 1 Testicular Tissues in normal group and IR group (HE×400)
3.2蛋白质鉴定经重庆医科大学生命科学院iTRAQ技术平台进行蛋白质组学测定,3次技术重复所鉴定到蛋白质的维恩分析结果见Fig 2。本实验共鉴定出蛋白质1 633个,包含差异蛋白128个,其中28个表达上调,100个表达下调。

Fig 2 Differential protein Venn diagram between ionzing radiation group and normal group
A: Represents 2 768 proteins identified in the first assay; B: Represents 2 957 proteins identified in the second assay; C: Represents 3 306 proteins identified in the third assay.
3.3KEGG通路注释结果将IR组和空白组小鼠睾丸组织鉴定到的差异蛋白,运用David 6.8进行KEGG富集分析,发现共有57个差异表达蛋白质,参与了21条生物信号通路(P<0.05),其中表达上调的蛋白质有13个,表达下调的有44个。差异蛋白富集明显的10条信号通路结果见Fig 3。从图中可以看出,差异蛋白主要富集在与帕金森病、亨廷顿氏病、氧化磷酸化、阿尔茨海默病、抗生素生物合成、代谢途径等相关的信号通路中。
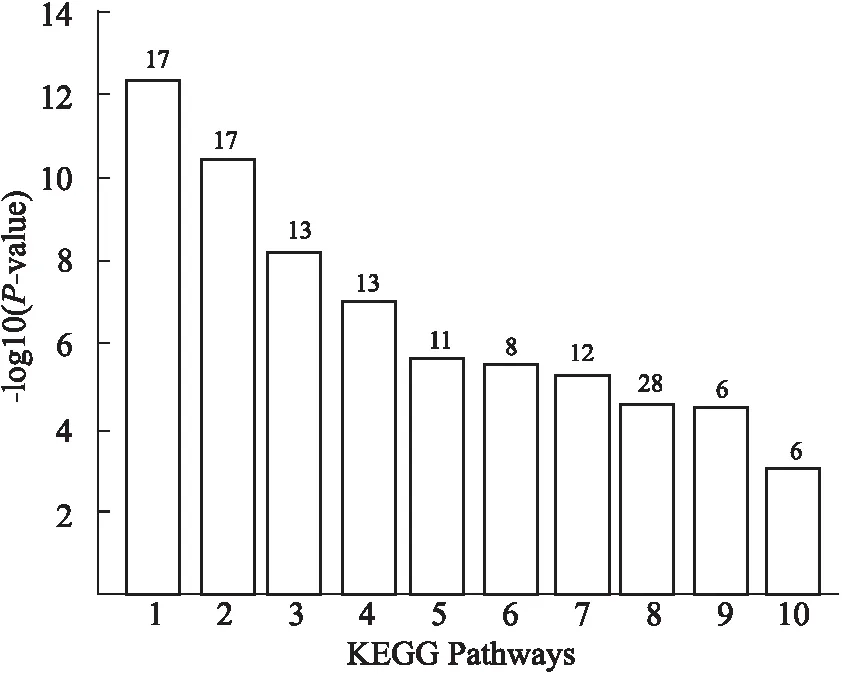
Fig 3 Differential protein KEGG pathway analysis of testis tissues between IR group and blank group (top 10)
1:Parkinson’s disease; 2:Huntington’s disease; 3:Oxidative phosphorylation; 4:Alzheimer’s disease; 5:Non-alcoholic fatty liver disease(NAFLD); 6:Glycolysis ;7:Biosynthesis of antibiotics;8:Metabolic pathways;9:Pyruvate metabolism;10:Cardiac muscle contraction
本实验发现富集于氧化磷酸化信号通路中的差异蛋白有13个,分别是线粒体ATP合成酶α亚基(mitochondrial ATP synthase subunit alpha,Atp5a1)、线粒体ATP合成酶β亚基(Atp5b)、线粒体细胞色素b-c1复合物6亚基(mitochondrial cytochrome b-c1 complex subunit 6,Uqcrh6)、细胞色素b-c1复合物8亚基(Uqcrq8)、细胞色素C氧化酶亚基(cytochrome C oxidase subunit,Cox6b2)、线粒体细胞色素C氧化酶5a亚基(Cox5a,)、细胞色素C氧化酶6c亚基(Cox6c)、细胞色素C氧化酶IV亚基1亚型(cytochrome C oxidase subunit IV isoform 1,Cox4i1)、NADH脱氢酶[辅酶Q]1α亚基8(Ndufa8)、线粒体NADH脱氢酶[辅酶Q]1α亚基9(Ndufa9)、线粒体NADH脱氢酶[辅酶Q]铁硫蛋白2(mitochondrial NADH dehydrogenase [ubiquinone] iron-sulfur protein 2,Ndufs2)、线粒体NADH脱氢酶[辅酶Q]铁硫蛋白3(Ndufs3)、NADH脱氢酶[辅酶Q]铁硫蛋白5(Ndufs5),它们均为表达下调,信号通路图见Fig 4,其中表达明显下调的蛋白Ndufs5的肽段鉴定的质谱图见Fig 5。通过查询Uniport数据库的蛋白质信息,对13个差异蛋白的生物学过程、分子功能、细胞成分进行整理分析,发现它们参与了线粒体电子传递、线粒体呼吸链复合物I装配、ATP生物合成等过程,其中Cox4i1主要分布于膜,Cox6b2和Ndufa9主要分布于线粒体,其余10个差异蛋白主要分布于膜、线粒体、线粒体内膜。进一步利用String10.5和Cytoscape 3.6.1制作差异蛋白相互作用网络图见Fig 6,发现这些蛋白之间是相互联系的。其中,Cox4i1、Cox5a分别与其它12个蛋白质之间都有紧密联系,它们在该信号通路中发挥着重要作用。
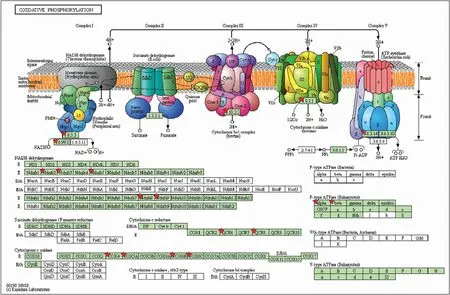
Fig 4 Difference between IR group and blank group in oxidative phosphorylation signaling pathway The red asterisk indicates the location of the enriched differential proteins in this pathway.

Fig 6 Interaction network diagrams of 13 differential proteins’ oxidative phosphorylation signaling pathway between IR group and blank group
4 讨论
新陈代谢是动物生命活动的基本特征,生物体内物质代谢过程中所伴随的能量释放、转移和利用等,称为能量代谢。它受到肌肉活动、精神活动、食物和环境温度等因素影响。以往的研究数据显示,辐射对于动物脑部、心脏和生精细胞具有明显的损伤作用,能够引起能量代谢异常,诱发心肌细胞凋亡[12]、神经细胞信号转导通路异常和生精细胞损伤[13],这些对于现在研究电离辐射对机体损伤的作用机制有重要意义。
氧化磷酸化是指在生物氧化过程中,伴随着ATP生成的作用。分为代谢物连接的磷酸化和呼吸链连接的磷酸化两种类型:另一种是底物水平磷酸化;一种是在呼吸链电子传递过程中偶联ATP的生成,生物体内95%的ATP来源于这种方式。线粒体为细胞的生命活动提供能量。1961年,英国学者提出的化学渗透假说,说明电子传递释放出的能量可用于形成一种跨线粒体内膜的质子梯度(H+梯度),驱动ATP合成。这一过程主要由线粒体内膜上的NADPH-泛醌、泛醌-Cytc还原酶、琥珀酸-泛醌还原酶、细胞色素C氧化酶和ATP合成酶组成的呼吸链酶完成[14]。
NADH脱氢酶(又称为NADH脱氢酶复合物、NADH:辅酶Q还原酶或复合体Ⅰ)是一种位于线粒体内膜,催化电子从NADH传递给辅酶Q的酶,它是线粒体中氧化磷酸化的“入口酶”,是线粒体电子传递链中的第1个酶(复合体I)。该实验氧化磷酸化信号通路所涉及的差异蛋白中,有5个都属于NADH脱氢酶[泛醌]类,其中Ndufa8、Ndufs2、Ndufs3、Ndufs5主要分布于膜、线粒体、线粒体内膜,Ndufa9主要分布于线粒体中。Ndufa8、Ndufa9、Ndufs5参与线粒体呼吸链复合物I装配,但不参与催化作用。Ndufs2、Ndufs3是参与线粒体膜呼吸链的核心亚单位,被认为属于催化所需的最小组装体。在被辐射的小鼠睾丸组织中,这些蛋白表达下调,将影响电子在线粒体呼吸链中的正常传递,从而影响睾丸组织生理功能。
细胞色素是一类以血红素作为辅基的电子传递蛋白,主要参与动物体内的氧化还原反应。根据不同的辅基结构,可分为a、b、c和d类,它们在细胞能量转移中起着极为重要的作用。哺乳动物细胞色素C氧化酶是线粒体呼吸链的末端酶,催化电子从细胞色素C向氧的转移。它是一种复合酶,包含3个执行催化功能的线粒体DNA编码亚基和10个调节催化活性的核编码亚基。细胞色素C氧化酶活性控制线粒体呼吸链的电子传递能力,从而控制线粒体偶联的效率,进而控制活性氧的产生。本实验氧化磷酸化信号通路所涉及的差异蛋白属于细胞色素C氧化酶亚基和细胞色素bc1复合物亚基,其中Uqcrh和Uqcrq是泛醌细胞色素C还原酶复合体的组成成分,是线粒体呼吸链的组成部分。Cox5a、Cox6c是线粒体电子传递链中的末端氧化酶。它们的表达下调,导致细胞中能量转移不能正常进行,从而影响辐射后小鼠睾丸组织中的能量代谢。
动物中,ATP合成酶广泛分布于线粒体内膜的质膜上,在跨膜质子动力势的推动下,参与呼吸链氧化磷酸化。ATP合成酶分子结构由F1和Fo部组成[15]。F1在膜的外侧,由5个不同的亚基组成,F0是由3个亚基构成。ATP合成过程中,F1F0-型ATP合成酶是细胞能量交换的一个关键酶。这个大分子蛋白复合体利用电子梯度和相关的膜电势来合成ATP,它也可以逆过程并且水解ATP产生电子梯度,他们必须相互联系,并且互换能量。本实验氧化磷酸化信号通路所涉及的差异蛋白为Atp5a1和Atp5b,属于F1部分,F1在膜的外侧,它的表达下调,导致关键酶ATP合成酶不能正常发挥应有的功能,细胞不能正常交换能量,这是小鼠睾丸组织在核辐射后组织损伤的重要机制。
本实验氧化磷酸化信号通路中所涉及的NADH脱氢酶、细胞色素bc1复合体、细胞色素氧化酶、ATP合成酶这几种酶的亚基,共同参与了ATP的合成过程。该信号通路中的13个差异蛋白在小鼠接受电离辐照后的睾丸组织中均出现低表达,使线粒体呼吸链受损,影响ATP的合成和能量供应,继而影响睾丸组织的正常生理功能。以上结果揭示氧化磷酸化对机体ATP的合成至关重要,因此,通过对氧化磷酸化通路的深入研究,将有助于进一步了解电离辐照后睾丸组织能量代谢障碍的机制,也为电离辐照损伤的临床研究寻找新靶点提供理论依据。
(致谢:感谢中国工程物理研究院核物理与化学研究所对动物造模提供帮助,感谢绵阳市第三人民医院病理科的宋大萍老师给予病理技术支持与指导,感谢王蕾、徐敬文、王小红、唐文诚、吴思霖在动物实验中给予支持与帮助。)

