迷迭香酸类似物-11通过EGFR-JNK通路抑制人胃癌MGC-803细胞增殖和迁移
李婉婷,韦立群,李 清,黄道航,潘晓杭,黄俊力,甘嘉亮,唐双意
(广西医科大学1. 第一附属医院药学部、2. 药学院、3. 第一附属医院结直肠肛门外科、4. 广西生物医药协同创新中心,广西 南宁 530021)
恶性肿瘤作为仅次于心血管疾病的第二大“隐形杀手”,现今已有取而代之的趋势。据估计,到2025年,全球新增肿瘤数量将达到2 000万,严重威胁人类健康和社会经济的可持续发展[1]。有数据显示,以胃癌、肝癌、食道癌为主的消化道肿瘤依然是位居中国前五的恶性肿瘤, 因此,胃癌仍是发病率和死亡率较高的恶性肿瘤之一,其5年生存率低于30%[2],寻求新的途径来治疗胃癌尤为重要。迷迭香酸(rosmarinic acid,RA)是一种天然的水溶性苯酚羧酸,化学成分主要有酚类、萜类、黄酮类等。RA的药理作用也非常广泛,包括抗癌、抗菌、抗抑郁、保护神经等[3]。房祥杰等[4]报道,RA可通过MAPK/ERK信号通路,抑制结肠癌LS174T细胞增殖,诱导细胞凋亡。杨沛霖[5]报道,迷迭香酸类似物RA-C1能剂量依赖性地抑制人鼻咽癌CNE-1细胞增殖,并诱导其凋亡。从RA多种生物学效应的理论基础出发,本研究小组合成了十几个迷迭香酸类似物(rosmarinic acid analogue,RAA)。通过前期的药效学研究发现,迷迭香酸类似物-11(rosmarinic acid analogue-11,RAA-11)在抗肿瘤方面有明显优势,其化学结构式见Fig 1。因此,本课题进一步用RAA-11作用于人胃癌MGC-803细胞,基于表皮生长因子受体(epidermal growth factor receptor,EGFR)-JNK通路,探讨其对细胞增殖、迁移及凋亡的影响,为进一步开发RAA-11提供基础。
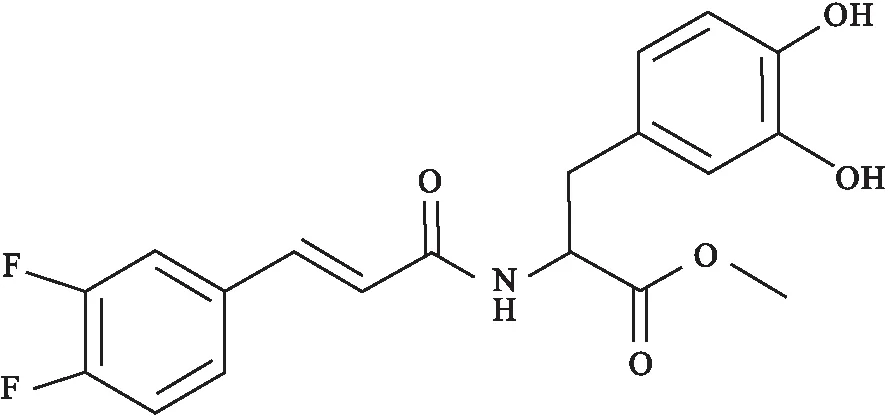
Fig 1 The chemical structure of RAA-11
1 材料
1.1主要试剂及配制RAA-11由广西医科大学药学院李清老师合成并鉴定(纯度≥98%),用DMSO配制成50 mmol·L-1储存液,于-20 ℃避光保存,实验时用DMEM高糖培养基或RPMI 1640培养基稀释成低、中、高浓度(10、20、40 μmol·L-1);RPMI 1640培养基、DMEM高糖培养基,购自美国Gibco公司;南美胎牛血清,购自依科赛生物科技(太仓)有限公司;0.25%胰蛋白酶-EDTA消化液(含酚红)、MTT、DMSO,购自北京索莱宝科技有限公司;AxyPrepTMMultisource Total RNA Miniprep Kit购自康宁生命科学(吴江)有限公司;RevertAid First Strand cDNA Synthesis Kit购自赛默飞世尔科技(中国)有限公司;SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)购自日本TaKaRa公司;EGFR mRNA、GAPDH mRNA引物,购自南京金斯瑞生物科技有限公司;EGFR、JNK、p-JNK、caspase-3、Bax、Bcl-2、GAPDH兔抗人单克隆抗体,购自沈阳万类生物科技有限公司。
1.2仪器全自动酶标仪(美国伯腾仪器有限公司);荧光倒置相差显微镜(日本尼康公司);NanoDrop 2000分光光度计、StepOnePlusTMReal-Time PCR仪(赛默飞世尔科技有限公司);电泳系统(美国Bio-Rad公司);LI-COR Odyssey红外荧光扫描成像系统(美国LI-COR公司)。
2 方法
2.1细胞培养人胃黏膜上皮细胞株GES-1和人胃癌细胞株MGC-803,购于中国科学院上海细胞库。GES-1细胞用含10%胎牛血清和1%青链霉素的DMEM高糖培养基常规培养,MGC-803细胞用含10%胎牛血清和1%青链霉素的RPMI 1640培养基常规培养,在含有5% CO2饱和湿度的37 ℃恒温箱中培养,长满后用0.25%胰酶消化用于后续实验。
2.2MTT法常规培养人胃黏膜上皮GES-1细胞和人胃癌MGC-803细胞,收集处于对数生长期的细胞,将其密度调整为5×107·L-1,接种于96孔板,每孔100 μL。贴壁后,GES-1细胞加入200 μL用DMEM高糖培养基稀释的RAA-11(终浓度0、10、20、40、80、160 μmol·L-1),MGC-803细胞加入200 μL用RPMI 1640培养基稀释的RAA-11(终浓度0、10、20、40、80、160 μmol·L-1),每个浓度设置6个复孔。分别培养24、36、48 h后,每孔加入20 μL MTT,置孵箱中孵育4 h后,加100 μL DMSO并剧烈震荡10 min,用酶标仪测570 nm波长处各孔的OD值。细胞存活率=OD加药组/OD对照组×100%。
2.3划痕实验消化对数生长期的人胃癌 MGC-803细胞,用RPMI 1640完全培养基将其密度调整为1.5×108·L-1,接种到6孔板,每孔2 mL。贴壁后弃培养基,用马克笔在6孔板背面划横线,小枪头在细胞上垂直于马克笔迹划竖线。用PBS洗下划掉的细胞,每孔分别加入2 mL用RPMI 1640培养基稀释的RAA-11(终浓度0、10、20、40 μmol·L-1),拍照0、24、36、48 h划痕宽度(L),计算细胞迁移情况。细胞迁移率=(L0 h-Ln h)/L0 h×100%,n=24、36、48。
2.4荧光实时定量PCR(qRT-PCR) 消化对数生长期的MGC-803细胞,接种于25 cm2培养瓶中,待其长到80%~90%左右,每瓶分别加入3 mL用RPMI 1640培养基稀释的RAA-11(终浓度0、10、20、40 μmol·L-1)。药物作用48 h后,收集细胞上清液,并消化贴壁细胞,按照试剂盒说明书提取MGC-803细胞总RNA,检测RNA浓度后置于-80 ℃保存。按照说明书进行逆转录,扩增。EGFR引物序列:Forward 5′-CCTGGTCTGGAAGTACGCAG-3′,Reverse 5′-CGATGGACGGGATCTTAGGC-3′;内参GAPDH引物序列:Forward 5′-GTCTTCACCACCATGGAGAAG-3′,Reverse 5′-GTTGTCATGGATGACCTTGGC-3′。实验结果通过相对定量方法分析,计算2-ΔΔCt值,比较组间基因表达水平是否具有统计学意义。
2.5Westernblot检测消化对数生长期的人胃癌MGC-803细胞,接种于25 cm2培养瓶中,待其长到80%~90%左右,每瓶分别加入用RPMI 1640培养基稀释的RAA-11(终浓度0、10、20、40 μmol·L-1)3 mL。药物作用48 h后,收集细胞上清液,并消化下贴壁细胞,加细胞裂解液(RIPA ∶PMSF ∶Cocktail=100 ∶1 ∶1)于冰上裂解10 min,4 ℃、12 000 r·min-1离心30 min。上清液用BCA法测定蛋白浓度后,加上样缓存液煮沸变性10 min。取30 μg蛋白样品进行SDS-PAGE电泳,蛋白转移至PVDF膜上,TBST洗膜3次,5% BSA室温封闭30 min,一抗4 ℃孵育36 h。二抗室温避光孵育1 h,TBST避光洗膜3次后,于Odyssey红外荧光扫描成像系统上机扫膜,计算灰度值后分析数据。
3 结果
3.1RAA-11对GES-1细胞和MGC-803细胞增殖的抑制作用如Fig 2所示,与GES-1细胞相比,RAA-11能明显抑制MGC-803细胞的增殖,且呈时间浓度依赖性,提示RAA-11对MGC-803细胞有选择作用。线性回归得到RAA-11作用GES-1细胞24、36、48 h的IC50分别是289.425、220.430、189.521 μmol·L-1;作用MGC-803细胞24、36、48 h的IC50分别是72.781、59.979、40.625 μmol·L-1。
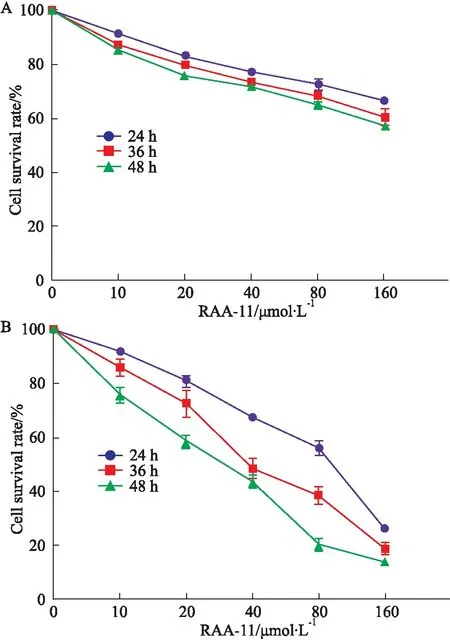
Fig 2 Effect of RAA-11 on survival rate at different concentrations at different
A:Human gastric mucosa cells GES-1; B:Human gastric cancer cells MGC-803.
3.2RAA-11对MGC-803细胞迁移的抑制作用如Fig 3所示,实验各组在0 h时,划痕宽度基本接近(P>0.05)。随着时间的推移(24、36、48 h),与对照组相比,MGC-803细胞的迁移率随着RAA-11浓度增加明显降低(P<0.01),且呈时间浓度依赖性。提示RAA-11可抑制人胃癌MGC-803细胞的迁移能力。
3.3RAA-11对MGC-803细胞EGFRmRNA表达的影响如Fig 4所示,RAA-11作用于MGC-803细胞48 h后,与对照组相比,EGFR mRNA表达明显下调(P<0.01)。结果提示RAA-11抑制MGC-803细胞的增殖和迁移可能与EGFR基因有关。
3.4RAA-11对MGC-803细胞凋亡相关蛋白表达的影响如Fig 5所示,与对照组比较,RAA-11作用于MGC-803细胞48 h后,促凋亡蛋白caspase-3和Bax表达增加,同时抑凋亡蛋白Bcl-2表达明显降低,表明RAA-11可诱导MGC-803细胞的凋亡。
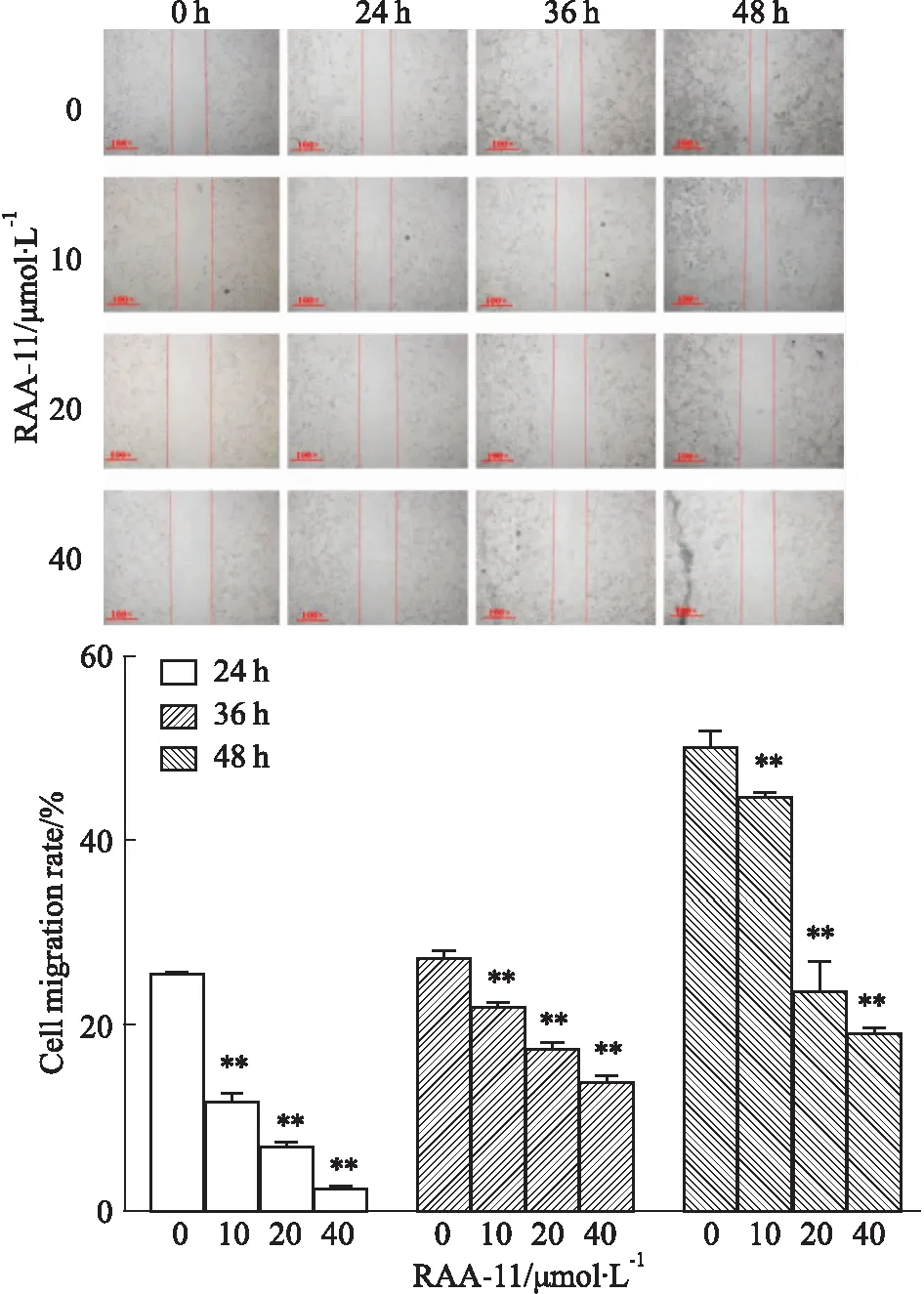
Fig 3 Effect of RAA-11 on migration rate of human gastric cancer MGC-803 cells at different concentrations at different
**P<0.01vs0 μmol·L-1group
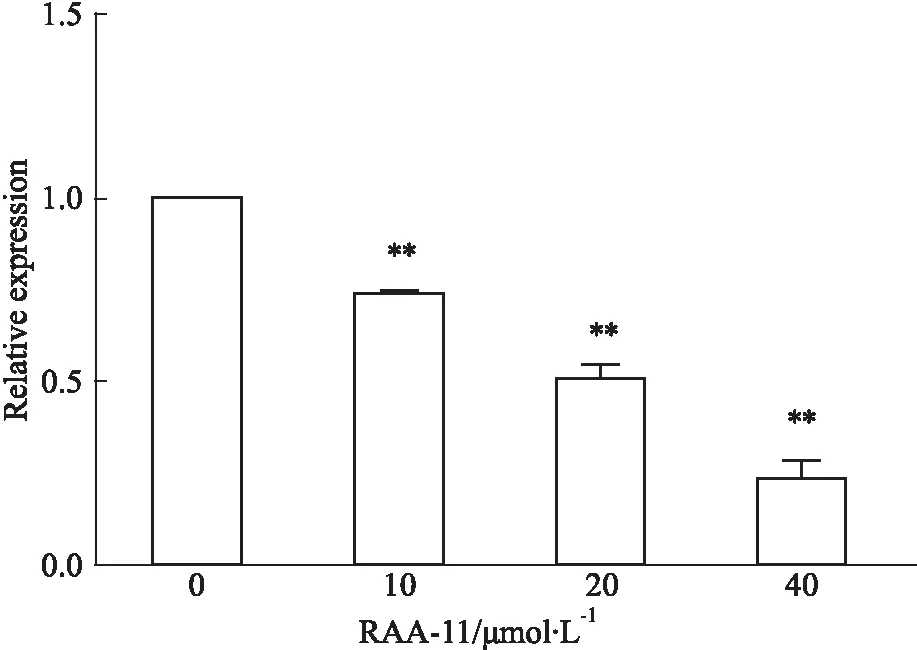
Fig 4 Effect of different concentrations of RAA-11 on expression level of EGFR mRNA in human gastric
**P<0.01vs0 μmol·L-1group
3.5RAA-11对MGC-803细胞EGFR-JNK通路蛋白表达的影响如Fig 6所示,与对照组比较,RAA-11作用于MGC-803细胞48 h后,通路蛋白EGFR明显下调,JNK、p-JNK表达明显上升。提示RAA-11可能通过作用EGFR-JNK通路,抑制MGC-803细胞增殖和迁移,并诱导其凋亡。
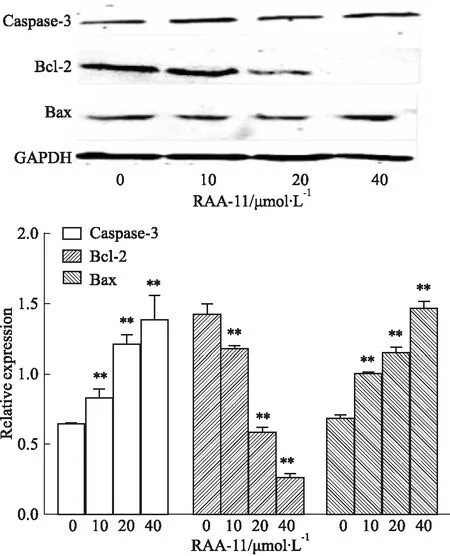
Fig 5 Effect of different concentrations of RAA-11 on expression of apoptosis related proteins in human
**P<0.01vs0 μmol·L-1group
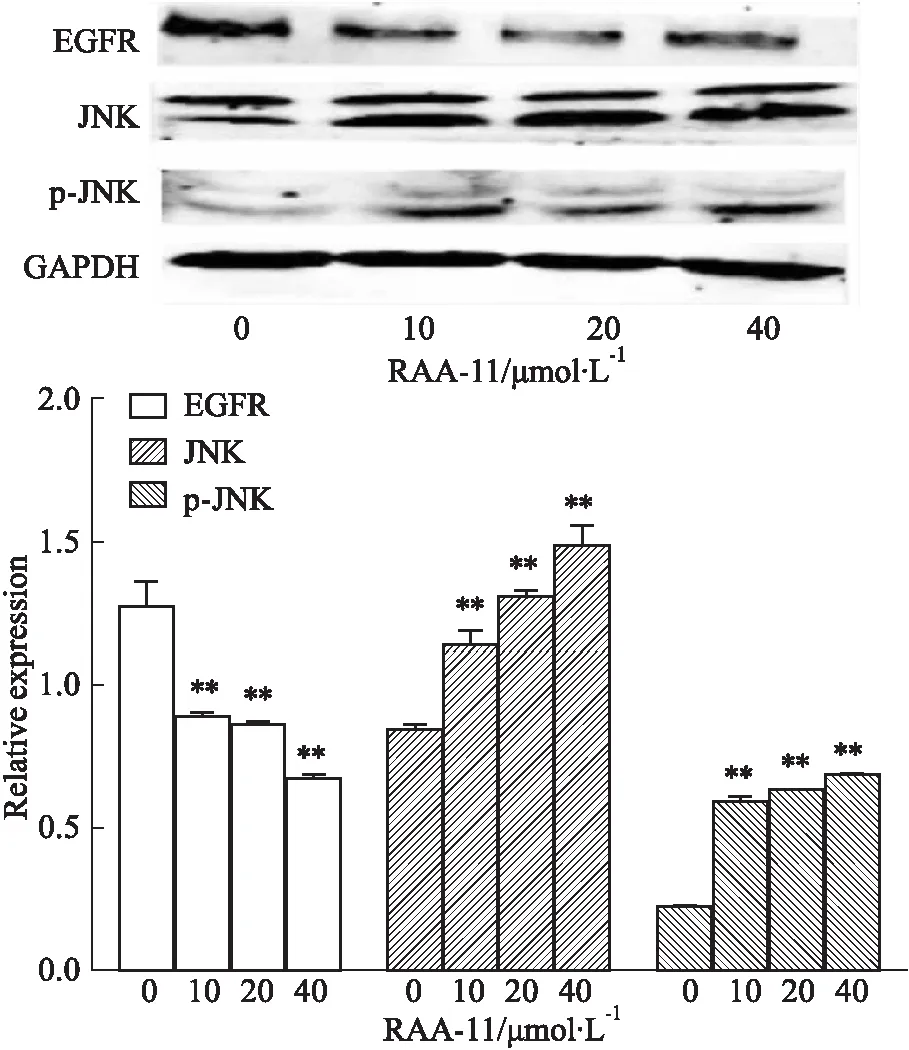
Fig 6 Effect of different concentrations of RAA-11 on expression of EGFR-JNK pathway proteins in human
**P<0.01vs0 μmol·L-1group
4 讨论
与坏死不同,细胞凋亡(或称程序性细胞死亡)是细胞与生俱来的一种机制,借此机体可去除不需要的细胞[6]。caspases是细胞凋亡的重要介导因子,caspase-3作为caspases家族执行阶段的关键因子,在细胞凋亡过程中起着至关重要的作用,有研究证实,caspase-3在人肿瘤组织和细胞系中存在突变[7]。其下游因子Bcl-2是一种癌基因,可分为抗凋亡蛋白和促凋亡蛋白。在各种凋亡刺激下,促凋亡蛋白Bax通过诱导线粒体外膜通透性和释放凋亡所需的可溶性因子,触发内在凋亡通路[8]。本实验结果显示,RAA-11能够抑制抗凋亡蛋白Bcl-2的表达,同时促进凋亡启动因子caspase-3以及促凋亡蛋白Bax的表达,所以我们认为RAA-11可以诱导人胃癌MGC-803细胞凋亡。
EGFR又称ERBB1和HER1,是一种跨膜酪氨酸激酶受体。EGFR是人类表皮受体(HER)家族的一员,是细胞信号通路的重要组成部分[9]。研究表明,抑制EGFR信号通路可诱导癌细胞增殖、迁移和细胞衰老[10],EGFR在肿瘤生长中起着至关重要的作用[11]。EGFR通常位于细胞膜表面,当受到某些刺激时,可以激活它位于细胞内的激酶通路,诱导其下游通路的磷酸化,包括MAPK、Akt、STAT3通路,促进细胞生长、增殖。本实验结果显示,RAA-11从基因和蛋白水平均下调了EGFR的表达,表明RAA-11抑制MGC-803细胞的增殖和迁移,并诱导其凋亡与EGFR通路有关。
JNK是丝裂原活化蛋白激酶(MAPKs)家族的成员之一,其中JNK家族包括10个由3个基因编码的亚型:JNK1(4个亚型)、JNK2(4个亚型)和JNK3(2个亚型)。JNK1和JNK2存在于身体的所有细胞和组织中,而JNK3主要在心脏、大脑和睾丸中表达。众多研究表明,JNK在炎症、凋亡、坏死信号通路的调控中发挥重要作用[12]。JNK诱导MGC-803细胞凋亡可能是通过线粒体途径发挥作用,诱导细胞色素释放入细胞质内,既可促进多种凋亡蛋白的表达,又可作用于Bcl-2家族中促凋亡蛋白Bax、Bak等,从而启动细胞凋亡的途径[13]。本实验结果显示,RAA-11明显下调了通路蛋白EGFR的表达水平,并上调了通路蛋白JNK、p-JNK的表达量,我们猜想RAA-11可能通过EGFR-JNK通路来抑制人胃癌MGC-803细胞增殖和迁移,并诱导其凋亡。
综上所述,本实验表明RAA-11对人胃癌MGC-803细胞的增殖、迁移有明显的抑制作用,并能够诱导其凋亡,机制可能与EGFR-JNK通路有关。结合前期研究,我们认为RAA-11通过多条通路对人胃癌MGC-803细胞发挥抗肿瘤效应。
(致谢:本文实验在广西医科大学科技楼基础实验室完成,由衷感谢各位老师和同学的帮助!)

