白藜芦醇通过下调MnSOD诱导类风湿性关节炎成纤维样滑膜细胞凋亡
汪陶荣,张 晔,曹 威,张俊强,殷曈昕,朱皓晨,苏逸明,陈思娴,瞿子庭,王高远,张丽霞,陈晓宇,2
(安徽医科大学1. 组织胚胎学教研室、2. 形态学实验中心、3. 临床医学院、4. 药学院,安徽 合肥 230032;5. 第一附属医院骨科,安徽 合肥 230022)
类风湿性关节炎(rheumatoid arthritis,RA)属于自身免疫性疾病,病情反复发作,导致关节损伤,甚至致残[1]。RA的特殊病因是成纤维细胞样滑膜细胞(fibroblast-like synoviocytes, FLSs)异常增殖,FLSs在关节损伤中起关键作用[2]。RA的发病与氧自由基生成有关[3],活性氧(reactive oxygen species, ROS)在生理状态下主要是由线粒体生成,即线粒体活性氧(mitochondrial reactive oxygen species, mtROS),研究表明,mtROS与RA等疾病的病理生理学有关[4]。白藜芦醇(resveratrol,Res)是一种天然的多酚类化合物,它广泛存在于葡萄、虎杖等植物中[5]。低浓度的Res能降低mtROS,减少ROS引起的脂质过氧化和DNA损伤,高浓度Res可引起细胞凋亡[6]。Res可活化线粒体去乙酰化家族的去乙酰化酶3(sirtuin 3, SIRT3),SIRT3通过调节锰超氧化物歧化酶(manganese superoxide dismutase, MnSOD)的去乙酰化作用,调节mtROS平衡和能量代谢[7]。该文主要研究Res通过MnSOD-mtROS途径影响RA的FLSs增殖和凋亡,为RA的治疗提供依据。
1 材料与方法
1.1材料
1.1.1细胞与试剂 RA-FLSs细胞系(编号C0495),购自上海冠导生物有限公司。Res(批号R5010,分子量228.24),购自美国Sigma公司;DMEM(10569-010),购自美国Gibco公司;胎牛血清(fetal bovine serum, FBS)(04-001-1ACS),购自美国BI公司;兔抗人MnSOD(ab13533)、GAPDH(ab9485),购自美国Abcam公司;Annexin V-PE/7-AAD细胞凋亡检测试剂盒(BB-41012-3),购自上海贝博生物公司;CCK-8试剂盒(C0037),购自碧云天生物有限公司;Mito SOX红色探针(40778ES50),购自上海翊圣生物科技有限公司。
1.1.2仪器 MultikanFC型酶标仪(美国赛默飞世尔公司);激光八色流式细胞仪(美国BD公司);Thermo Forma4111CO2恒温培养箱(美国热电公司);LEICA.SP5-DMI6000-DIC共聚焦显微镜(德国Leica公司);蛋白电泳仪、蛋白转膜仪、凝胶成像系统(北京六一仪器厂);TS2R-FL荧光倒置显微镜(日本尼康公司)。
1.2方法
1.2.1细胞培养 RA-FLSs用含10% FBS和1%双抗的DMEM培养基,培养于37 ℃、5% CO2的培养箱中。待细胞长到80%左右密度时,用5 μmol·L-1H2O2处理12 h后,再用Res处理24 h。
1.2.2慢病毒感染细胞 预实验确定复感染指数(multiplicity of infection,MOI)为50。用完全培养基制备密度为3×107·L-1的细胞悬液,种到6孔板中,每孔2 mL。培养24 h,加入50 μL 1×108TU病毒、40 μL 25×HitransG慢病毒感染试剂、910 μL完全培养基。感染12 h后,应用常规培养基。感染48 h后,加入嘌呤霉素筛选,通过杀死曲线确定浓度为8 mg·L-1。感染72 h后,荧光倒置显微镜观察感染效果。
1.2.3mtROS水平测定 mtROS水平检测应用Mito SOX Red探针。在50 μg Mito SOX Red中加入13 μL DMSO,混匀配制成5 mmol·L-1的Mito SOX Red工作液。取对数生长期细胞,按照2×105/孔细胞接种于激光共聚焦培养皿中,待细胞生长密度至80%左右时,H2O2作用12 h后, Res作用24 h,PBS洗涤2次,加入用无血清培养液稀释的Mito SOX Red工作液,终浓度为5 μmol·L-1的探针工作液2 mL,37 ℃细胞培养箱内避光孵育15 min,用无血清细胞培养液洗涤细胞3次,立即行激光共聚焦扫描显微镜观察摄片。
1.2.4CCK-8法检测细胞增殖 将对数生长期的RA-FLSs接种于96孔板中,每孔加入100 μL(2 000个细胞),设置3个复孔,次日细胞贴壁后,5 μmol·L-1H2O2预处理细胞12 h,Res处理24 h后,细胞培养液作为对照组。每孔加入10 μL CCK-8工作液,继续培养4 h。酶标仪在450 nm处测定吸光度A值。
1.2.5流式细胞仪检测细胞凋亡 采用流式细胞仪结合AnnexinV-PE/AAD试剂盒双标记染色,测定细胞凋亡率。取对数生长期细胞,按照2×105/孔细胞接种于6孔板,依照上述H2O2浓度和Res浓度分组,胰酶消化收集细胞。按照试剂盒说明操作:冷PBS洗涤细胞2次,用400 μL Annexin V结合液,调整密度约1×109·L-1,加入5 μL AnnexinV-PE染色液,轻轻混匀,(2~8) ℃避光孵育15 min,然后加入10 μL AAD染色液,轻轻混匀,(2~8) ℃避光孵育5 min,行流式细胞仪分析。
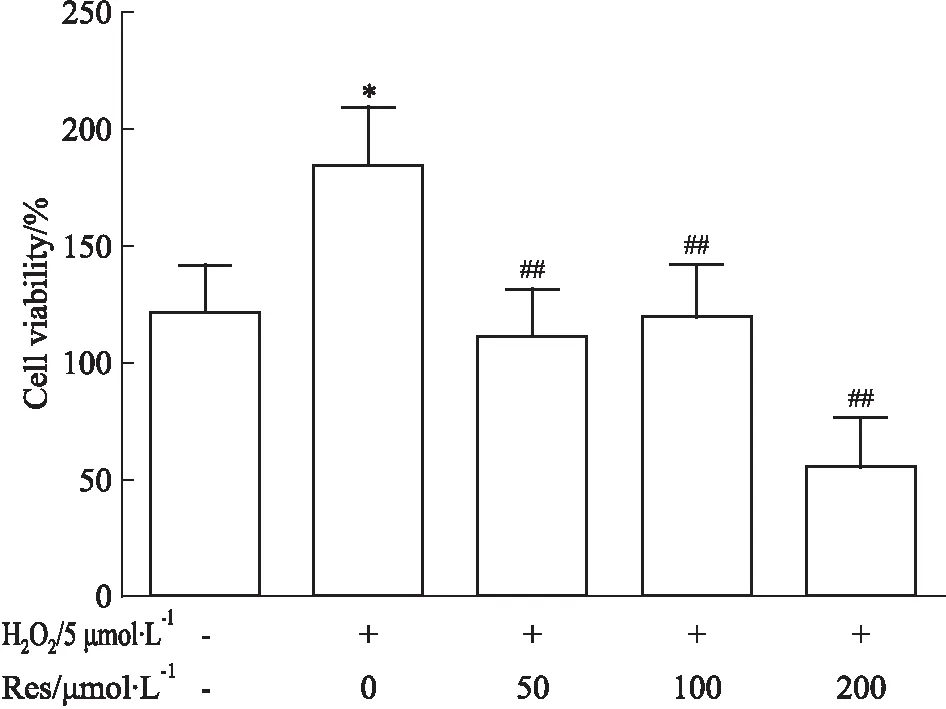
Fig 1 Effects of resveratrol on RA-FLSs
*P<0.05vscontrol group;##P<0.01vsH2O2group
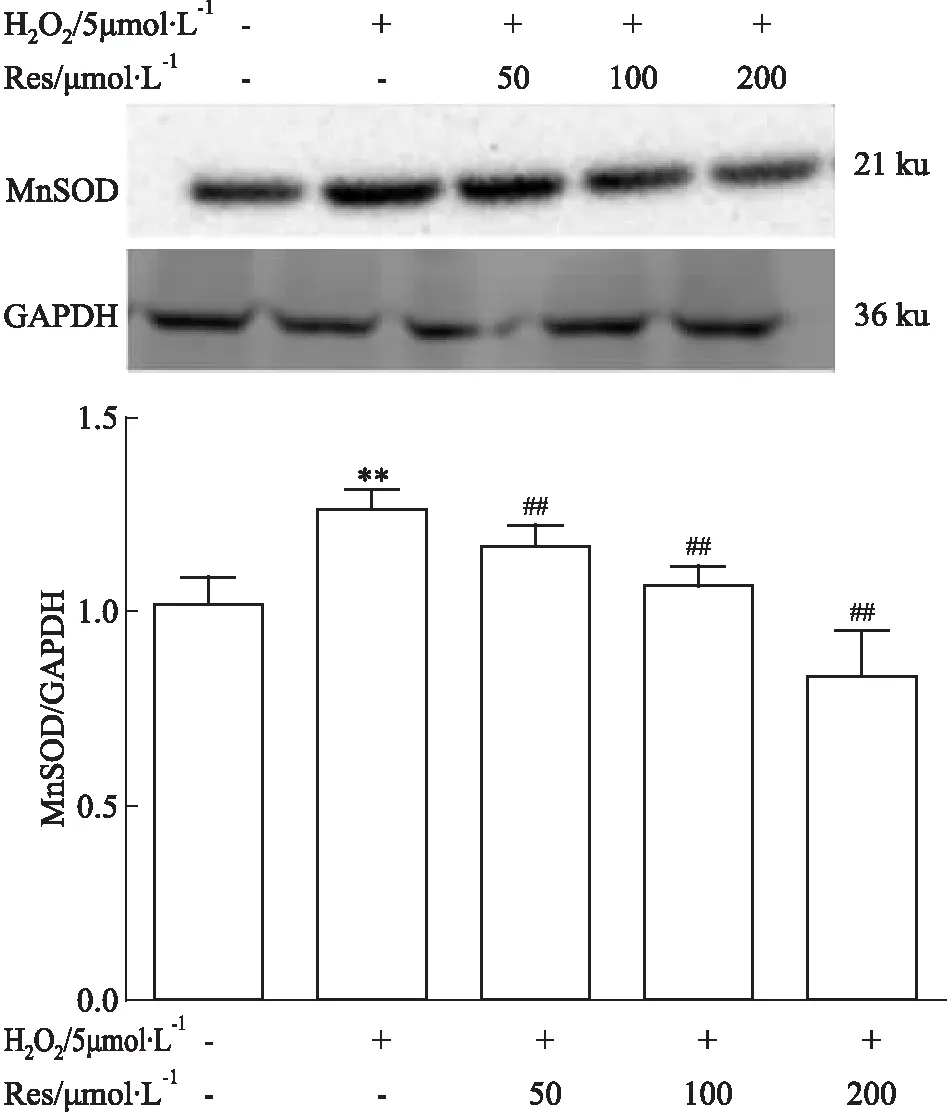
Fig 2 Effect of resveratrol on expression
**P<0.01vscontrol group;##P<0.01vsH2O2group
1.2.6免疫印迹分析 取对数生长期细胞, 按照2×105/孔细胞接种于6孔板,待细胞生长密度至80%左右时。同上加药处理后,将6孔板置于冰上,每孔加入增强型RIPA裂解液(含1 mmol·L-1蛋白酶抑制剂、PMSF)150 μL作用1 min,提取总蛋白,4 ℃、12 000 r·min-1离心15 min,取上清液,BCA蛋白试剂盒蛋白定量后,再进行SDS-PAGE电泳,转膜,5%脱脂奶粉室温封闭1 h,4 ℃孵育MnSOD(1 ∶5 000)、GAPDH(1 ∶2 500)抗体;过夜后,TBST洗膜3次,每次10 min,二抗室温孵育1 h,TBST洗膜3次,每次10 min,ECL化学发光曝光3~5 min,显影。
2 结果
2.1Res抑制RA-FLSs增殖不同浓度的Res作用于RA-FLSs,CCK-8法检测其增殖情况,5 μmol·L-1H2O2刺激FLSs模拟体外氧化应激环境。如Fig 1所示,5 μmol·L-1H2O2细胞活力明显高于对照组(t=3.385,P=0.0277),然后加入不同浓度的Res,发现随着Res浓度的增加,RA-FLSs的细胞活力降低越来越明显(F=16.99,P=0.008)。
2.2Res降低RA-FLSs内MnSOD的表达如Fig 2所示,与对照组比较,5 μmol·L-1H2O2组MnSOD蛋白表达升高(t=4.750,P=0.009),给予不同浓度的Res处理之后,MnSOD蛋白表达逐渐降低,并且呈现浓度依赖性(F=17.54,P=0.0007)。
2.3慢病毒载体成功感染了RA-FLSs用MnSOD过表达和MnSOD干扰慢病毒载体同时感染RA-FLSs,72 h后用荧光倒置显微镜观察慢病毒载体携带的绿色荧光标记,发现感染效率均在60%以上。因为载体携带嘌呤霉素抗性基因,用8 mg·L-1(浓度由死亡曲线确定)的嘌呤霉素进行筛选后,感染效率达到90%(Fig 3)。为了检测MnSOD过表达慢病毒和MnSOD干扰慢病毒是否增加或降低RA-FLSs中MnSOD蛋白表达,Western blot检测结果显示,与对照组相比,MnSOD干扰慢病毒感染的RA-FLSs中MnSOD的蛋白水平表达下调(t=4.651,P=0.0097),MnSOD过表达病毒感染的RA-FLSs中MnSOD的蛋白表达水平均上调(t=4.242,P=0.0132)。证实慢病毒成功感染了目的细胞,并上调或下调了MnSOD的表达。
2.4MnSOD调节mtROS水平H2O2处理对照组、MnSOD过表达慢病毒感染组、MnSOD干扰慢病毒感染组的RA-FLSs用相关因素处理12 h后,再用200 μmol·L-1的Res分别孵育24 h,MitoSOX红色探针检测各组细胞mtROS水平。Fig 4结果表明,与模型组相比,在相同浓度Res处理下,MnSOD过表达组mtROS的水平降低(t=5.117,P=0.0069),而MnSOD干扰组结果相反(t=4.852,P=0.0083)。
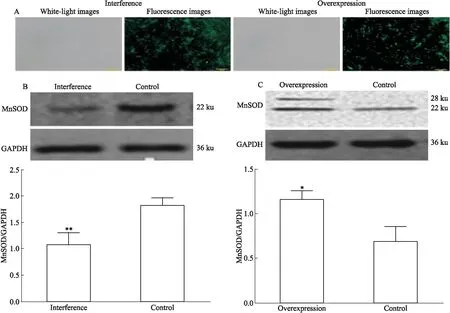
Fig 3 RA-FLSs infected by lentiviral vector
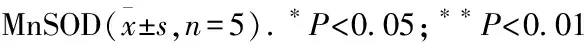
Fig4mtROSlevelsmediatedbyMnSODregulation(×400) A:Control group; B: Model group; C: Model+200 μmol·L-1Res group; D: MnSOD overexpression+200 μmol·L-1Res group; E: MnSOD interference+200 μmol·L-1Res group.**P<0.01vsmodel group;##P<0.01vsmodel+200 μmol·L-1Res group.
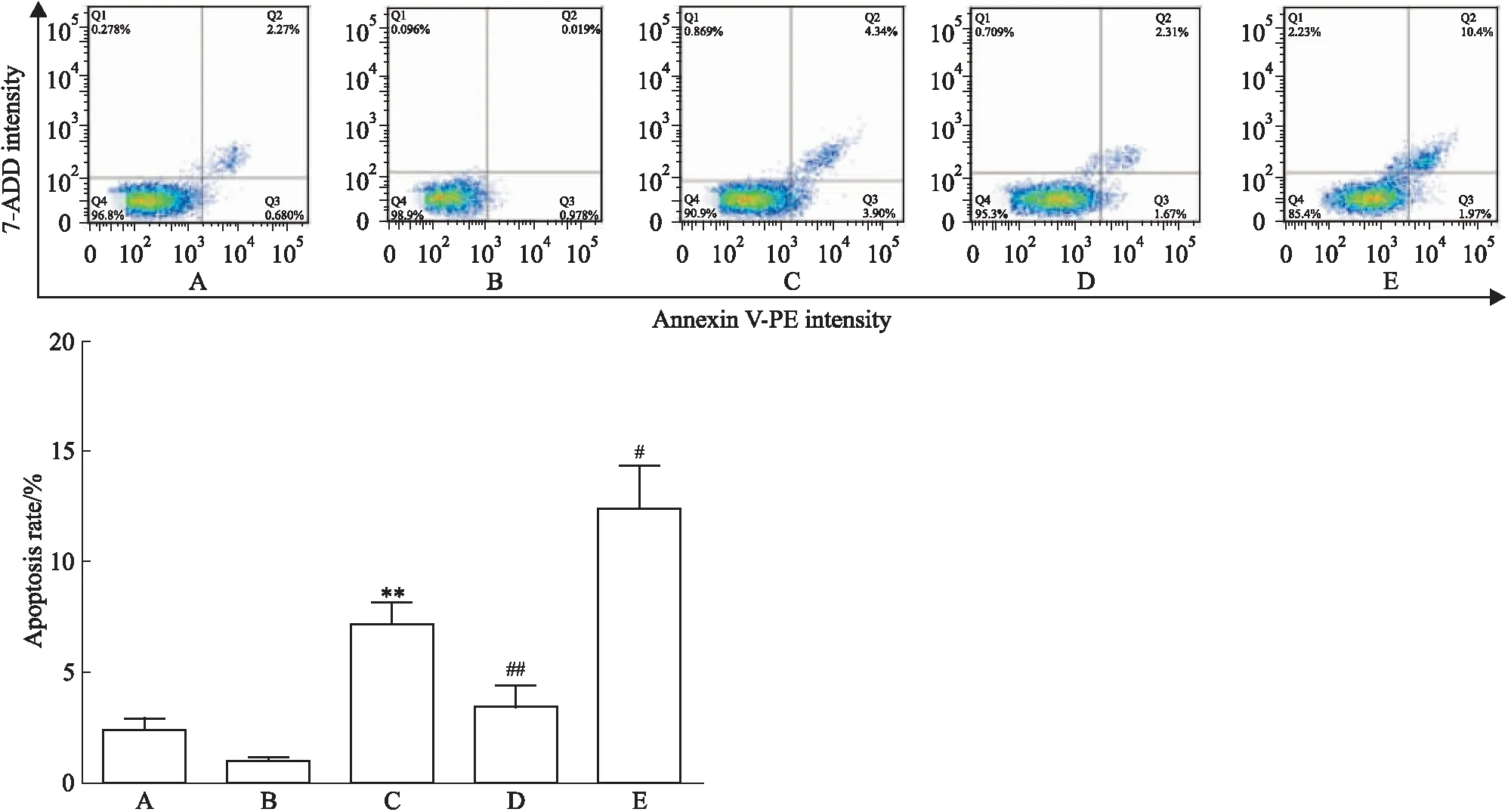
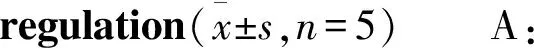
2.5MnSOD抑制RA-FLSs凋亡采用AnnexinV-PE/AAD试剂盒,流式细胞仪检测Res对5 μmol·L-1H2O2处理的不同组RA-FLSs凋亡的影响。如Fig 5所示,Res促进RA-FLSs凋亡,而MnSOD过表达组则在同种浓度的Res处理下,凋亡率减少(t=4.691,P=0.0094);MnSOD干扰组凋亡率增加(t=4.100,P=0.0149)。
3 讨论
本课题组前期实验发现[7],Res可以抑制RA-FLSs增殖,采用5 μmol·L-1H2O2刺激FLSs模拟体外氧化应激环境,在加入不同浓度的Res后,发现随着Res浓度的增加,FLSs的细胞活力明显降低。采用流式细胞技术检测Res对RA-FLSs凋亡的影响,发现随着Res浓度增加,FLSs的凋亡逐渐增高。同时,线粒体超氧化物检测试剂盒结果显示,加入不同浓度的Res之后,RA-FLSs中mtROS的红色荧光逐渐增强,且具有统计学意义。结合上述mtROS在Res处理的RA-FLSs含量和凋亡数据,提示Res很可能通过改变RA-FLSs的mtROS含量,产生过多的mtROS,导致异常增殖RA-FLSs的凋亡。前期实验结果表明[7],Res降低线粒体氧化应激相关蛋白SIRT3和MnSOD的表达,Res处理后,SIRT3和MnSOD蛋白表达呈现剂量依赖性降低。结合Res增高mtROS水平的结果,提示Res可能通过作用于线粒体中的SIRT3和MnSOD蛋白,升高mtROS水平,最终引起细胞凋亡。为了验证Res是否可以通过SIRT3-MnSOD信号途径调节mtROS水平,促进H2O2处理的RA-FLSs凋亡,本研究构建MnSOD过表达和干扰的慢病毒载体,使RA-FLSs的MnSOD表达活化和抑制,结果证实,Res可以通过SIRT3-MnSOD信号途径调节mtROS水平。
RA患者的FLSs失去控制的增长和死亡失衡是RA的特殊病征,促进RA的FLSs凋亡将是RA治疗的主要干预措施[8-9]。线粒体凋亡途径是主要的凋亡途径,在线粒体凋亡途径中,线粒体主要是增加了ROS的生成[10]。本研究结果证明,活化或抑制MnSOD表达后,200 μmol·L-1Res处理RA-FLSs后,ROS发生明显变化,从而对凋亡产生影响。在此实验中,我们猜想Res介导mtROS生成增多可能是RA-FLSs的特殊特征。
综上,本研究证实Res可能通过MnSOD-mtROS信号通路,抑制RA-FLSs增殖。围绕mtROS,明确mtROS在H2O2诱导的FLSs增殖中作用,通过体外实验探明Res对FLSs增殖的影响,探明MnSOD-mtROS信号途径在Res抑制RA-FLSs增殖中的作用及机制,为RA的形成机制和药物设计提供新靶点,是针对RA的一种潜在的治疗方法。
(致谢:本实验主要在安徽医科大学基础医学院形态实验中心、组胚实验室完成,在此对实验室各位老师及同学的帮助致以衷心的感谢!)

