六步法腹腔镜脾脏切除联合贲门周围血管离断术治疗门静脉高压症的应用体会
梁马可,李学民,段希斌,梁占强,杨鹏生,杨国威
(郑州大学附属郑州中心医院,河南 郑州,450007)
脾脏切除联合贲门周围血管离断术是治疗门静脉高压症出现上消化道出血、脾功能亢进的主要外科治疗方法。传统开放脾切除联合贲门周围血管离断术手术创伤大、疼痛重、康复慢、住院时间长。自1991年Delaitre等[1]首次报道腹腔镜脾切除术以来,经过国内、外的发展,腹腔镜脾切除术也从最初只能治疗血液病脾脏到目前大量应用于治疗门脉高压症的脾脏。近10年,随着腹腔镜技术的提高及腔镜器械的发展、更新,逐步从手助腹腔镜过渡至完全腹腔镜脾切除联合贲门周围血管离断术(laparoscopic splenectomy and pericardial devascularization,LSPD)[2],而后者也被更多的临床外科医师证明安全、可行,并具有解剖清晰、创伤小、疼痛轻、康复快等优点。笔者回顾分析我院施行LSPD的临床疗效,结合自身经验及查阅相关文献,将之总结为六步法LSPD,现将体会报道如下。
1 资料与方法
1.1 临床资料 收集2016年1月至2019年3月郑州大学附属郑州中心医院肝胆胰外科收治的46例肝硬化门静脉高压症、脾亢脾大、食管-胃底静脉重度曲张、红色征阳性或有上消化道出血史患者的临床资料,患者均行六步法LSPD。其中男32例,女14例;36~72岁,平均(50±10)岁;肝炎后肝硬化39例,酒精性肝硬化3例,不明原因肝硬化4例;术前评估肝功能Child A级38例,B级8例;另合并胃间质瘤1例,肝癌4例。排除标准:肝功能Child C级;合并晚期肝癌;存在严重的心、肺、脑疾病,不能耐受腹部手术。
1.2 术前准备 术前准备在加速康复外科(enhanced recovery after surgery,ERAS)理念指导下进行,术前禁食6~8 h,术前禁饮2 h,术前30 min使用抗生素预防感染,术前 1 d口服聚乙二醇电解质散剂行肠道准备,麻醉后留置胃管、尿管。张兴元等[3]通过对ERAS组与传统围手术期处理组进行比较,认为在ERAS理念指导下行LSPD治疗门静脉高压症具有较好的安全性,可加快术后康复。
1.3 手术方法
1.3.1 患者体位、术者站位及Trocar布孔 患者平卧于手术台,取头高脚低、左高右低分腿位。监视器置于患者头部两侧,主刀立于患者右侧,第一助手立于患者左侧,扶镜手立于患者两腿之间。采用4孔法施术:(1)取脐部10 mm观察孔;(2)于左侧锁骨中线、脐水平上2~5 cm(小于贲门距离)处穿刺12 mm Trocar为主刀主操作孔;(3)前正中线右侧、脐水平线上5 cm处穿刺5 mm Trocar为主刀副操作孔;(4)于左侧腋前线脾脏下缘穿刺10 mm Trocar为助手操作孔。操作困难时,另于左侧锁骨中线左肋缘下2.0 cm处穿刺5 mm Trocar作为助手辅助操作孔。术中气腹压力维持在12~15 mmHg。
1.3.2 六步法LSPD的步骤 第一步:离断胃网膜左静脉、胃短静脉。用LigaSure或超声刀自胃大弯中部开始,沿血管弓内侧向贲门方向离断,至贲门左侧(图1)。如果胃短血管过短,可暂留。第二步:悬吊胃。打开肝胃韧带,自网膜孔穿入一根乳胶管,剑突左侧皮肤戳孔悬吊胃(图2)。第三步:结扎脾动脉。于胰腺上缘解剖游离脾动脉,丝线结扎,不切断。如果脾动脉隐藏或变异,可不结扎脾动脉(图3)。第四步:离断脾门动静脉。在胰尾部下缘游离进入胰尾后方,适度游离胰腺上方的脾肾韧带,于胰尾后方穿入1号丝线,用直线切割缝合器离断脾门动静脉。进一步离断脾肾韧带及脾膈韧带,完成脾脏切除(图4)。第五步:离断胃左静脉及其分支。此时,胃左静脉及其小弯侧呈垂直位,用直线切割缝合器一次性离断(图5)。第六步:离断食管支、高位食管支、左膈下静脉。用超声刀离断含有3支血管(食管支、高位食管支、左膈下静脉)的食管周围组织,裸化食管下段6~8 cm(图6)。最后在下腹部做横口取出脾脏。
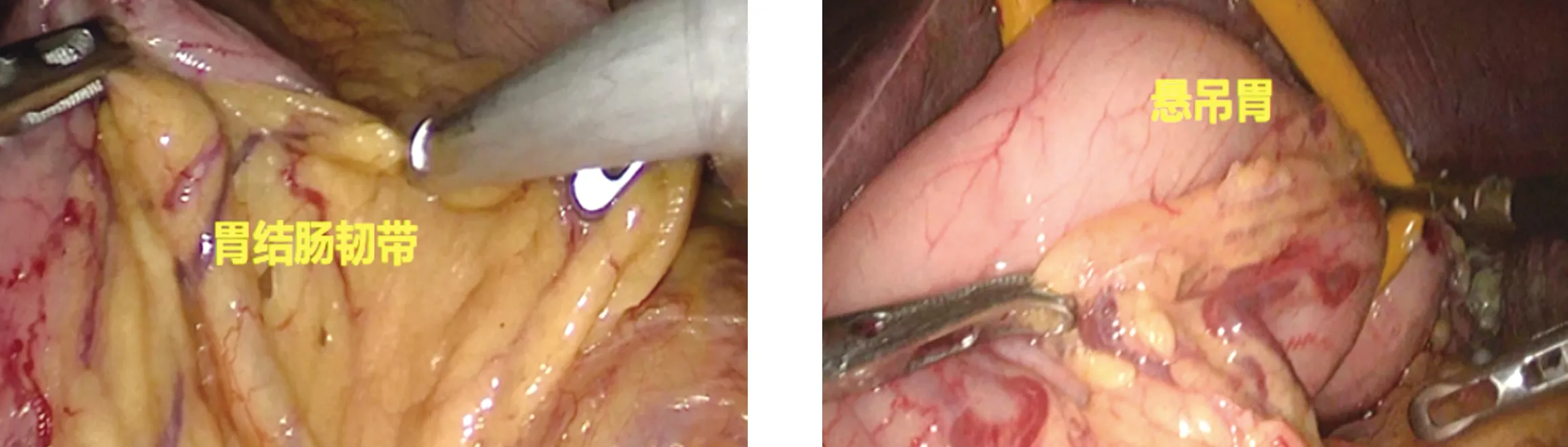
图1 离断胃网膜左静脉、胃短静脉 图2 悬吊胃
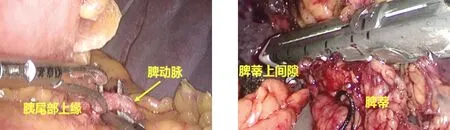
图3 分离、结扎脾动脉 图4 离断脾门动静脉
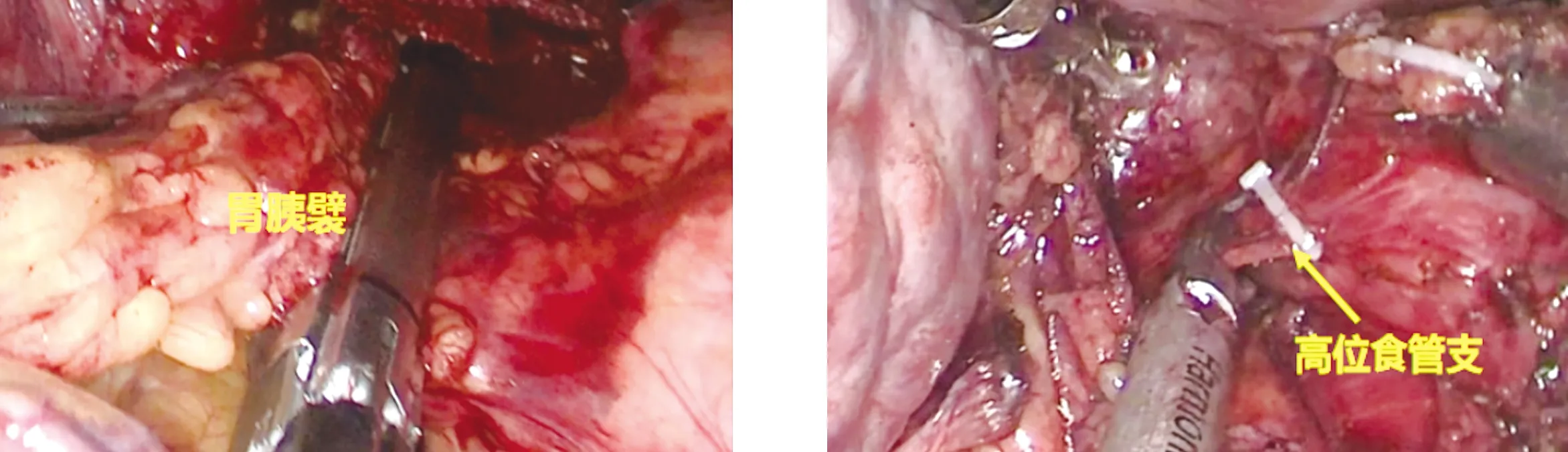
图5 离断胃左静脉及其分支 图6 离断食管支、高位食管支、左膈下静脉
1.4 术后治疗 一般术后第2天拔除胃管,嘱患者适量饮水,第3天开始进食;术后第1天拔除尿管;常规予以抑酸护胃、保肝、抗感染、营养支持、补充水电解质治疗,适量补充人血白蛋白及血浆等,根据患者中心静脉压、尿量及腹腔积液等具体情况,严格控制液体入量。监测腹腔积液淀粉酶及门静脉血栓形成情况。减少术后门脉系统血栓形成的方法很多,除了术中操作尽量减少对脾静脉的刺激、缩短残留脾动静脉长度外,术后在排除出血风险后应早期应用抗凝、祛聚药物,并及时纠正贫血,减少刺激血小板增生,避免血栓形成。我们的方法是于术后48 h确认无消化道及腹腔出血,常规使用依诺肝素4 000 IU ih qd预防门静脉系统血栓,3 d后逐步过渡到华法林,控制INR 2~3,疗程约为3个月。
1.5 观察指标及随访 观察分析手术时间、术中出血量、术后拔除腹腔引流管时间、并发症发生情况、住院时间。术后1个月、3个月、6个月,复查血常规、肝功能、门静脉超声。此后每半年复查一次,共随访24个月。嘱患者术后每年复查胃镜1次。
2 结 果
2.1 治疗结果 46例患者中44例顺利完成腹腔镜手术,2例中转开腹,其中1例因寻找脾动脉造成严重出血,1例为术后脾窝有活动性出血,镜下无法满意止血而中转开腹。合并肝癌的4例患者术中同时行超声引导下经皮肝癌射频消融术。合并胃间质瘤1例,一并切除。手术时间平均(160.6±42.8)min,术中出血量平均(320.9±150.2)mL。腹腔引流管拔除时间平均(5.6±1.2)d,术后平均住院(9.7±3.2)d。术后发生脾静脉血栓12例,门静脉血栓4例,无胰瘘、腹腔感染、肝功能衰竭、胃瘫等严重并发症发生。住院期间无死亡病例,患者均痊愈出院。10例患者于术后6 d拔除腹腔引流管时仍有400~500 mL/d淡黄色腹腔积液,腹腔积液检验确认无感染后拔除腹腔引流管,缝合关闭引流管,补充人血白蛋白的同时,口服呋塞米、螺内酯利尿治疗,效果满意。
2.2 随访 术后2个月死亡1例,因出院后停用抗凝药物出现门静脉、肠系膜上静脉、肠系膜下静脉广泛血栓形成,再次住院治疗无效导致死亡。4例术前肝功能Child B级患者恢复至A级。随访期间均无上消化道出血发生。
3 讨 论
3.1 LSPD的适应证及可行性 肝硬化门静脉高压症常常出现胃小弯侧冠状静脉、脾门附近的脾静脉及侧支循环血管迂曲扩张,且血管壁薄,术中易损伤且出血凶险,镜下难以止血,是导致中转开腹的重要原因之一,加之凝血功能障碍及血小板低等问题,使LSPD风险高,难度大。由于合并脾脏增大,手术操作空间减小,欧洲内镜外科学会相关指南曾将其作为腹腔镜脾切除术的禁忌证[4]。随着腹腔镜技术的提高、经验的积累及腔镜器械的发展、更新,腹腔镜技术在肝硬化门静脉高压症中的应用逐渐得到外科医师的认可。Al-raimi等[5]分析2000~2015年关于腹腔镜与开腹脾切除术治疗肝硬化门脉高压症的文献结果显示,肝硬化门脉高压患者不应作为LS的禁忌证。黄洁等[6]通过分析64例LSPD患者的资料认为,LSPD是治疗门静脉高压症安全、有效的方法。李坚等[7]认为,虽然完全腹腔镜下巨脾切除术出血风险高,技术难度大,但具有创伤小、术后出血少、康复快等优点,是安全、可行的,值得推广应用。在手术适应证方面,笔者同大部分学者一样,认为LSPD的适应证同传统开放手术,主要用于肝硬化门静脉高压症合并脾功能亢进、食管胃底静脉曲张破裂出血,且肝功能为Child-Pugh A、B级患者[8]。
3.2 优化手术流程及技术要点后复杂手术简单化,确保手术顺利实施 随着LSPD的广泛开展,手术效果逐步得到认可,与手术技巧、经验相关的文献报道也比比皆是。唐勇等[9]总结189例LSPD认为,术中通过建立“脾蒂上缘间隙”与“胃蒂上缘间隙”,采用“两间隙两隧道法”整体离断“脾蒂”与“胃蒂”,可降低手术难度与出血风险,是安全、简便的术式,可作为巨脾、严重食管胃底静脉曲张的常规治疗手段。洪德飞等[10]对105例患者采用改良四步法行LSPD,其中仅2例中转开腹,中转率为1.9%,手术成功率较高,术后并发症发生率低,值得临床推广应用。
近年,笔者团队经过临床实践,认为优化手术流程及技术要点的掌握保证了手术的顺利施行,并在学习国内专家技巧及经验上总结出自己的手术流程,即六步法LSPD,将繁琐、复杂的手术步骤简化,从而减少术中出血,良好暴露手术视野,提高了手术成功率,缩短术后住院时间。第一步,离断胃网膜左静脉、胃短静脉。通常使用超声刀或Ligasure处理,我们体会,Ligasure使用得当,<5.0 mm的曲张静脉闭合效果确实、可靠,术末及术后局部渗血明显减少。第二步,悬吊胃。一是充分暴露胃后区域,使手术视野更加开阔、清晰,利于后续操作(尤其脾动脉的处理);二是使胃胰襞呈垂直状显露,利于切闭胃冠状血管并防止周围组织损伤。第三步,结扎脾动脉。首先,阻断脾脏动脉可使脾脏缩小,使表面张力及周围曲张静脉张力降低,减少托举脾脏及操作过程中的出血几率;其次,脾脏缩小后,可增加手术操作空间,利于对出血的把控。游离出脾动脉后可用丝线结扎或Hem-o-lok组织夹夹闭,可不予切断。当然对于脾蒂周围存在严重曲张静脉团而不利于寻找脾动脉主干的患者,强行处理可能造成严重出血,可考虑放弃结扎脾动脉,直接行下一步操作。第四步,一级脾蒂法离断脾门动静脉。离断脾结肠韧带,由胰尾部下后方游离脾蒂背侧,此处多为疏松的结缔组织,可用Ligasure或超声刀顺势处理。充分建立脾蒂后隧道后用腔镜下切割闭合器插入将脾蒂整束离断。这一步尤应注意检查组织夹是否嵌入切割闭合器中造成脾蒂离断失败从而引发大出血。同时,笔者不建议使用二级脾蒂法处理脾门血管,理由是患者有肝硬化,二级脾蒂处理时间长,不利于患者恢复;即使经验丰富的术者,由于脾门曲张静脉呈“血管瘤”样改变,极易导致出血;二级脾蒂的处理保留了更多的曲张静脉,可能增加术后脾静脉血栓的风险。第五步,离断胃左静脉及其分支。可先用超声刀或Ligasure将该区域表面腹膜及胃后血管部分去除,充分认清与食管、胃壁的界线后,用腔镜下切割闭合器将胃冠状血管整束离断,但应注意避免损伤食管。当然此方法不适于选择性断流。第六步,离断食管支、高位食管支,左膈下静脉。用超声刀按常规逐步处理贲门至食管下段6~8 cm,注意食管支、高位食管支等血管应妥善处理,避免术后再次出血。最后于下腹部做横口取出脾脏。
3.3 把控出血,安全实施六步法LSPD 肝硬化门静脉高压时侧支循环形成且静脉迂曲扩张、壁薄,脾脏淤血肿大、被膜紧张,术中易发生出血,而出血作为此术式最严重的并发症,也往往是中转开腹的主要原因。开展初期由于尚在学习曲线阶段,缺乏对手术全局的把控,出血量偏多;随着技术的成熟、团队的协调,出血量较初期明显减少。我们认为,不论脾脏大小,明确易出血的步骤,做到心中有数,往往是制胜法宝:(1)重点在切脾过程:早期处理脾蒂时,曾尝试二级脾蒂处理法逐步分离脾血管分支,易造成出血;即使一级脾蒂处理,遇脾门血管曲张较重时,游离脾蒂上下极时,也易致出血;因此找准位置,建立脾蒂后隧道,用腔镜下切割闭合器对脾蒂整束离断可避免出血。(2)胃短血管出血:很多时候,胃短血管距胃壁很近,位置较高,显露较困难,易致撕裂出血,用Ligasure基本能避免出血,实在困难,可留作后续处理。(3)胃冠状静脉出血:开放或腹腔镜手术时此处是易出血部位,六步法强调将胃悬吊使胃胰皱襞充分暴露呈垂直位,用切割闭合器整束离断胃冠状血管,避免此处出血。(4)偶遇粗大胃后静脉,也可考虑用切割闭合器离断。总之,有了对出血的把控,才能安全实施六步法LSPD,保证患者的安全。
综上,六步法LSPD通过优化手术流程,使手术步骤清晰、流畅、程序化,降低了操作难度。我们认为,只要具有开放脾切除联合断流的基础、腹腔镜手术的基本功,完全可开展LSPD,治疗肝硬化门静脉高压症安全、有效,值得进一步推广应用。

