后腹腔镜手术治疗感染坏死性胰腺炎的临床疗效分析
李舒凡,徐继威,李 嘉,张彩云,曾华东,温苑章
(梅州市人民医院,广东 梅州,514031)
重症急性胰腺炎(serious acute pancreatitis,SAP)病情凶险,病死率高,不仅表现为胰腺的局部炎症,往往涉及全身多个脏器;其中胰腺坏死并感染是SAP患者死亡的重要原因[1-2]。急性胰腺炎开始通常为无菌性坏死,然而一旦并发感染,患者全身状态可迅速恶化,对于感染坏死性胰腺炎,目前公认的治疗原则是清除感染灶,术后充分、持续的引流。但开腹行坏死组织清除术创伤大,术后并发症及死亡率均较高[3]。近年,微创外科技术蓬勃发展,应用腔镜技术沿腹膜后入路对胰周感染坏死组织进行清除、引流开始在临床上得到应用。自2016年1月以来我院采用此技术治疗6例SAP患者,效果较满意。现将体会报道如下。
1 资料与方法
1.1 临床资料 2016年1月至2019年2月梅州市人民医院肝胆外一科共为6例SAP患者行后腹腔镜手术治疗,其中男4例,女2例,中位年龄49(37~63)岁。病因高脂血症4例,酒精性2例。5例无特殊病史,1例有糖尿病病史;4例入院后空腹血糖>11.1 mmol/L。患者发病后10 d~4周出现呼吸困难、高热不退等严重的全身中毒症状,最高APACHE中位评分12(9~21)分,术前行CT检查,提示坏死性胰腺炎并腹膜后大量积液,其中4例术前先予以彩超定位下行胰周积液穿刺引流术,全身中毒症状可缓解,但1~2周后再次出现反复高热、心率增快、呼吸困难等感染中毒症状。患者入院至首次手术中位时间38.5(11~63)d,首次手术时间75~100 min,平均(84.0±6.7)min。术前24 h对患者进行Marshall评分及Balthazar CT评级。Marshall评分均≥2分,Balthazar CT评级D级4例,E级2例。
1.2 手术方法 术前予以奥曲肽抑制胰酶分泌、预防性应用抗生素、禁食、通便、保护各脏器功能等常规处理,入院后常规进行Marshall评分,以评估胰腺炎的严重程度,行全腹部CT增强扫描,并行Balthazar CT评级,以了解胰腺坏死及积液分布范围,尽早行肠内营养,3例留置鼻空肠管,加强营养支持治疗。术前根据患者病情并仔细阅CT片,了解胰腺坏死范围及胰周、腹膜后积液分布(图1、图2)。患者取右侧卧位,抬高腰桥,行三孔法后腹腔镜肾上腺手术,分别于左腋后线肋缘下、左腋中线髂前上棘上2 cm、左腋前线肋缘下(图3)穿刺Trocar[4]。腹腔镜探查,见腹膜后组织水肿,切除多余腹膜外脂肪,显露肾周筋膜,于腹膜返折外侧打开肾周筋膜,进入降结肠与左肾之间水肿的肾周间隙,小心分离此间隙,切开肾前腹膜,进入肾旁前间隙(图4),吸除脓性积液,吸取的脓液进行细菌培养及药敏试验,扩大切口,进入脓腔,用组织钳小心、反复、多次取出黑色坏死组织(图5、图6),冲洗脓腔,术区彻底止血,分别于胰腺前、下方置入带有冲洗及多个侧孔的引流管,由腹壁切孔引出并固定(图7)。
1.3 术后处理 急性坏死性胰腺炎手术均无法一次性清除所有坏死组织,且疾病本身特点导致术后必然有胰腺的继续坏死及胰周积液的蓄积,因此术后通畅引流与冲洗显得尤为重要。患者术后予以3 000~6 000 mL生理盐水持续灌洗,并予以低负压吸引,注意保持引流管通畅。
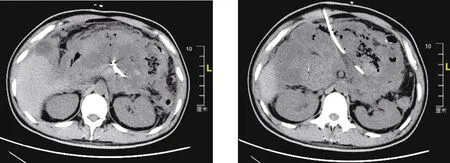
图1 术前胰周大量积液及坏死组织 图2 术前穿刺引流管
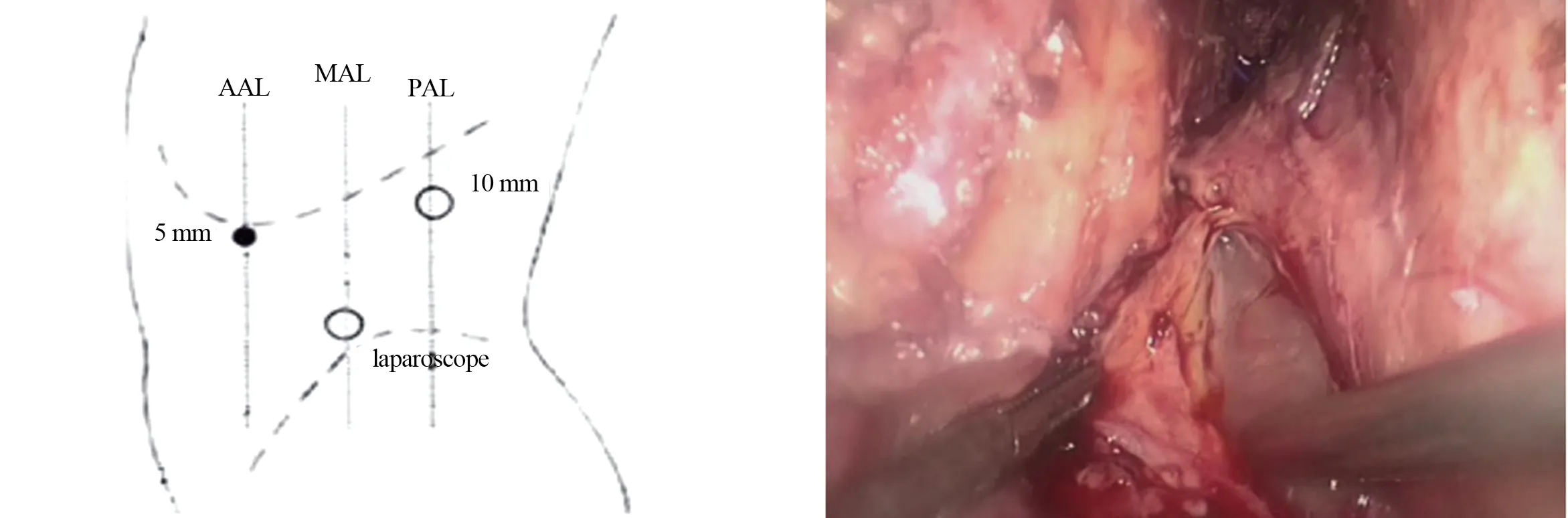
图3 术中Trocar分布图 图4 吸引器所示为刚进入肾旁前间隙,可见脓液
2 结 果
4例经过1次手术,2例经过2次手术;1例行双侧手术,5例经左侧入路、入院至首次手术时中位时间38.5(11~63)d。6例患者均顺利完成手术,首次手术时间75~100 min,平均(84.0±6.7)min。术中积液细菌培养分别为大肠埃希菌、粪肠球菌、铜绿假单胞菌、布氏柠檬酸杆菌及鲍曼不动杆菌,术后全身中毒症状迅速4例经过1次手术,2例经过2次手术;1例行双侧手术,5例经左侧入路、入院缓解,1周后复查CT,提示坏死组织及胰周积液明显减少(图8)。1例患者术后2周再次出现高热不退,复查CT提示胰周坏死及积液较一周前增多,再次行右侧后腹腔镜手术,患者取左侧卧位,方法同左侧后腹腔镜手术,术后症状迅速缓解。2例患者出现术后并发症,1例入院11 d施术,术后2周引流管见黄色带有少许粪渣样积液引出,考虑合并结肠瘘,先行保守治疗1周,引流管仍有粪渣样积液引出,10~50 mL/d,遂再次行回肠末段双腔造瘘术,术后继续引流管冲洗,引流液逐渐澄清;1例患者于术后1周引流管引出鲜红色血性液,复查血常规血红蛋白进行性下降,考虑腹腔出血,予以输注红细胞、新鲜冰冻血浆、冷沉淀,加强止血治疗后无再出血。4例患者术后无并发症发生,患者腹腔引流液澄清且<5 mL后,逐步(每次2 cm)退出引流管,直至完全拔除,患者腹膜后积液及坏死组织均完全消失。随访1个月~3年,均无复发。
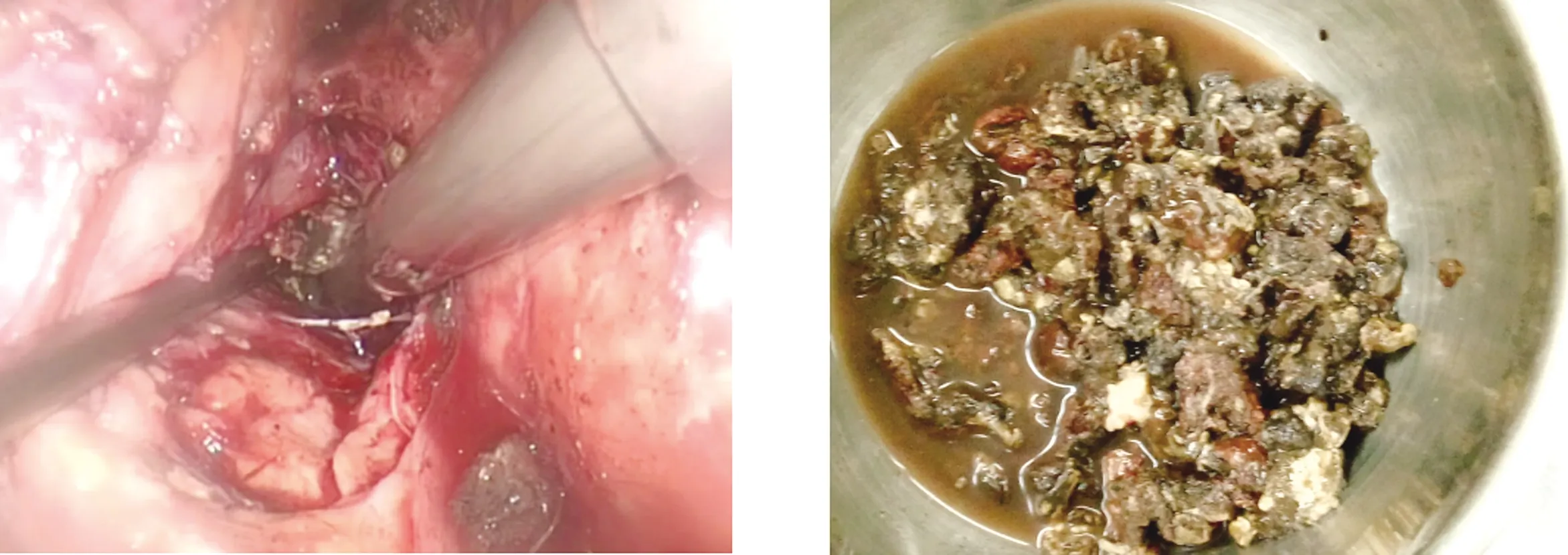
图5 用组织钳小心取出黑色坏死组织 图6 术中取出的坏死组织
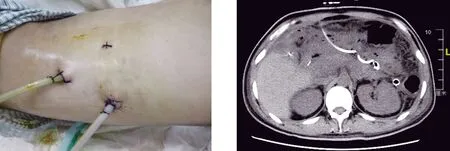
图7 术后留置引流管位置 图8 术后胰周积液及坏死组织明显减少
3 讨 论
SAP并发胰周感染坏死一直是急性胰腺炎的治疗难点,备受关注。胰腺感染坏死是SAP的严重并发症[5],减轻腹腔及腹膜后压力,尽可能清除坏死组织,减少毒性物质的吸收是成功救治SAP的主要外科手段[6]。本组6例患者,Marshall评分均≥2分,提示伴有器官衰竭,患者均有呼吸衰竭,其中4例合并肾功能衰竭,2例出现休克症状,如不及时外科干预,无法控制感染,从而危及生命。传统开腹手术及术后持续灌洗作为经典术式挽救了不少SAP患者的生命,但经腹腔入路需打开胃结肠韧带,进入小网膜囊,进而显露胰腺各段,这就不可避免地干扰了腹腔各脏器,并将腹膜后病菌带入腹腔,增加腹腔感染,且引流管由腹膜后经腹腔引流至腹壁外,容易引流不畅,压迫肠管还可能造成肠瘘及腹腔出血。2013年国际胰腺病学会与美国胰腺病学会发布的《急性胰腺炎治疗的循证指南》中指出,对于有症状的感染性坏死患者,坏死组织微创清创术优于开放清创术[7]。常用的微创方法包括经皮穿刺置管引流、腹腔镜胰腺坏死组织清除、肾镜经窦道坏死组织清除等。国内陈平等[8]采用腹腔镜经腹腔入路进入腹膜后,对胰腺坏死组织进行清除并置管引流,疗效满意,但理论上仍不可避免地面对腹腔与腹膜后相通所致细菌移位、腹腔感染等问题。Sileikis等[9]曾于2007~2009年采用三孔法腹腔镜经腹膜后行胰腺坏死组织清除、置管引流术,共治愈8例SAP患者。国内刘荣等[10]为1例感染坏死性胰腺炎患者行双侧胰腺坏死组织清除、置管引流术,疗效满意。
自2016年开始我们采用后腹腔镜技术,经腹膜后入路对胰腺坏死组织进行清除、引流。相较经皮肾镜术前需经腹膜后留置引流管,本方法更为直接,三孔法安全性高,可直接进入肾旁前间隙,直视下行坏死组织清除。经皮肾镜手术受限于视野及操作空间,本方法视野良好,可操作空间较大,出血易控制,且引流管可任意放置,引流更为充分。引流管不经过腹腔,对腹腔干扰小,不易造成腹膜后积液及病菌流入腹腔从而导致腹腔感染。6例患者术后感染中毒症状均迅速缓解,引流管留置6周~3个月,均保持通畅。大多数SAP合并胰腺感染坏死发生在胰腺体尾部,常有胰周脂肪组织坏死,有时渗入左侧结肠旁沟,本组患者均采用左侧入路,通常一次手术可将坏死组织清除干净,仅1例患者行双侧手术,降低了治疗过程中反复多次清创手术给患者带来的创伤,更加符合微创理念[11]。作者认为,对于胰腺体尾部靠背侧坏死合并大量积液的患者,适合行后腹腔镜手术,首次手术采用左侧入路。但胰腺炎患者腹膜后组织水肿,不利于辨认腹膜后间隙,我们的经验是术前穿刺置管引流,术中清除腹膜外脂肪组织,经引流管注入约1 000 mL的生理盐水,使肾旁前间隙更为肿胀,利于术中辨认及寻找。
SAP的外科干预时机一直是争论焦点,原则上出现胰腺感染坏死应外科干预,自2000年以来,越来越多的学者认为,SAP的外科干预时机应尽量延后[12-13]。无菌性胰周坏死可暂不处理,出现感染坏死后可考虑先行穿刺引流,缓解全身中毒症状,尽量将坏死组织清除术延迟至4~6周后[14]。本组患者中位时间38.5(11~63)d,4例入院1~3周在彩超定位下行胰周积液穿刺引流术,有效缓解了全身中毒症状,1~2周后再次出现反复高热、心率增快、呼吸困难等感染中毒症状,行后腹腔镜胰腺感染坏死组织清除、引流术,效果满意。早期手术的1例患者,入院10 d出现全身感染中毒症状,伴呼吸、肾功能衰竭,予以积极ICU治疗的同时,次日行后腹腔镜胰腺坏死组织清除、引流术,虽然迅速改善患者中毒症状,但术后出现结肠瘘,经保守治疗一周后仍有粪渣样引流,最终开腹行回肠末端双腔造瘘术。而且早期手术用组织钳清除坏死组织时,容易将包裹至坏死组织内未机化的小血管撕裂引起出血。笔者体会,对于绝大多数患者,手术时机应选择在4周后,此时患者已基本度过急性炎症及多器官衰竭期,病情较平稳,胰周坏死组织开始局限包裹,有助于术中减少损伤结肠及腹腔出血的几率。术前先行穿刺引流,一方面可缓解中毒症状,另一方面有助于术中寻找肾旁前间隙,减少术中副损伤所致的出血、肠瘘等并发症。此外,组织钳夹取坏死组织时应小口反复多次钳夹,尽量避免大块暴力撕扯坏死组织,出现渗血可予以双氧水冲洗、压迫止血。因此,后腹腔镜胰腺坏死组织清除、引流术同样适于Step-up原则,以减少手术并发症。
综上所述,SAP并发胰周感染坏死行后腹腔镜胰腺坏死组织清除、引流术安全、疗效确切,通常采用左侧入路,遵循Step-up原则,术中规范操作可减少手术并发症。

