腹腔镜脾切除联合贲门周围血管离断术治疗门静脉高压症的临床研究
车金辉,朱 硕,苏 展,江 涌
(徐州市肿瘤医院,江苏 徐州,221005)
脾切除联合贲门周围血管离断术是治疗肝硬化门静脉高压症的主要手术方式,由于门静脉高压症患者脾脏巨大,脾门血管曲张、增粗,压力增高,以及脾脏周围广泛的粘连,腹腔镜脾切除联合贲门周围血管离断术(laparoscopic splenectomy and pericardial devascularization,LSPD)难度极大,风险极高[1]。2016年1月至2018年5月我院共完成12例LSPD,现将结果报道如下。
1 资料与方法
1.1 临床资料 本组共12例,其中男8例,女4例;35~68岁,平均(47.3±10.4)岁。既往均有上消化道出血史,术前均诊断为肝硬化门静脉高压症,11例为乙型病毒性肝炎后肝硬化,1例为酒精性肝硬化。术前CT均提示脾大,长径13.5~24.5 cm,平均(17.5±3.2)cm,前后径4.2~7.0 cm,平均(5.4±0.9)cm,食管胃底重度静脉曲张(图1)。术前彩超测门静脉血流方向及流速,均为入肝血流,流速10.5~16.5 cm/s,平均(13.4±1.8)cm/s。肝功能Child A级8例,Child B级4例。血常规:血红蛋白65~106 g/L,平均(82.7±12.2)g/L,红细胞2.5×1012/L~4.7×1012/L,平均(3.2±0.7)×1012/L,白细胞1.5×109/L~3.6×109/L,平均(2.3±0.6)×109/L,血小板15×109/L~69×109/L,平均(40.9±15.5)×109/L。病例纳入标准:(1)确诊肝硬化门静脉高压症,实验室检查存在脾亢;(2)肝功能Child A级或B级;(3)有上消化道出血史;(4)临床资料完整。排除标准:(1)肝功能Child C级;(2)有无法耐受气腹的基础疾病;(3)急性上消化道大出血,生命体征不平稳。术前均告知患者及其家属手术方式,并签署手术知情同意书。本研究获得我院伦理委员会批准。
1.2 手术方法 患者平卧取“大”字位,脐部做10 mm切口,建立CO2气腹,压力维持在14 mmHg。腹腔镜引导下分别于左侧锁骨中线脐下2 cm水平线交点、左侧腋前线平脐水平、剑突下2 cm及右侧锁骨中线脐上2 cm水平线交点做10 mm、10 mm、5 mm、5 mm切口,穿刺Trocar(图2)。操作孔的分布可根据脾脏大小进行适当微调。将体位调为头高脚低右侧卧位30°,探查腹腔、肝脏、脾脏及胃周曲张的血管(图3、图4)。先行脾切除术,用超声刀打开胃结肠韧带,从胃网膜左、右动脉交汇处无血管区开始,沿胃大弯向上游离脾胃韧带(图5),离断胃短血管、脾门分支静脉,此时先不处理脾上极血管,在胰腺上方寻找脾动脉主干,并用Hem-o-lok夹夹闭脾动脉(图6),失去动脉血供后,脾内血液自脾蒂回输,脾脏体积变小、质地变软,增加了手术操作空间,减少术中出血,使手术易于进行。然后由脾脏下极开始逐步离断脾脏周围韧带,游离脾下极,显露胰尾,充分显露脾门,应用腔镜下切割闭合器离断脾蒂(图7、图8),此过程注意保护胰尾,避免伤及胰尾,继续用超声刀离断脾上极血管,切除脾脏。确认残端无出血后,将切除的脾脏推至盆腔。本组中1例患者,术中寻找脾动脉主干时,由于脾动脉位置深在,脾动脉分离困难,遂最后同脾蒂一并用腔镜下切割闭合器离断。再行贲门周围血管离断术,将胃体大弯侧向右上方翻开,用超声刀分离胃短血管,分别用Hem-o-lok夹闭、离断。处理小弯侧及贲门食管下段血管,从胃小弯幽门切迹开始,沿胃小弯向上逐步结扎切断,切断胃左动脉、胃冠状静脉通向胃壁的分支,置入宽纱布条,环绕食管下端贲门并打松结,牵拉食管,分离结扎至贲门上5~8 cm处血管支(图9)。所遇较粗的血管均用Hem-o-lok夹闭后切断。将切除的脾脏装入标本袋内,剪碎后取出,检查创面无活动性出血后,于脾窝及食管旁放置引流管一根,皮内缝合各切口。
1.3 术后处理 术后常规予以抗生素预防感染、保肝、补液支持等处理。术后第2天即可下床活动,观察腹腔引流管引流情况。术后24 h监测凝血功能及D-二聚体,如结果提示高凝状态,且无明显活动性出血,早期应用低分子肝素抗凝治疗(用法:4 100 IU,皮下注射,qd),待恢复经口饮食后改为阿司匹林或华法林口服(与低分子肝素重叠2~3 d),预防门静脉血栓形成。术后常规查门静脉系统彩超,可早期发现可能出现的门静脉血栓。术后查腹腔引流液淀粉酶,结果为血清淀粉酶正常值上限的3倍以内,则提示无胰瘘[2],复查腹部CT或腹腔彩超,确认无胰瘘、腹腔积液后,早期拔除腹腔引流管。根据加速康复外科理念,术后早期拔除胃管及尿管,早期恢复经口饮食,早期下床活动。
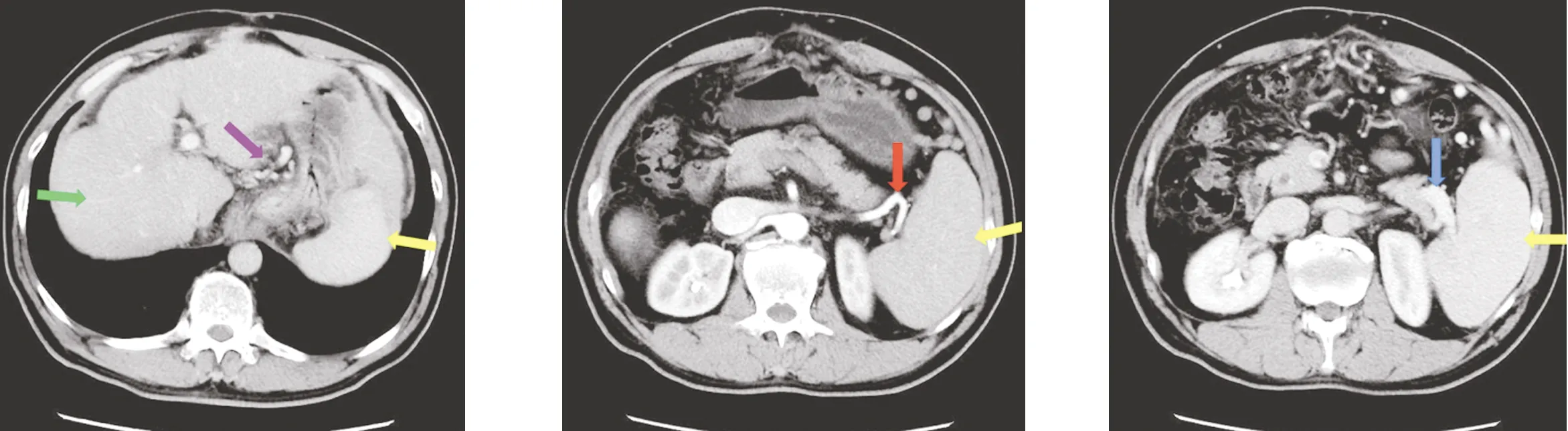
图1 紫色箭头为贲门周围迂曲扩张的血管,黄色箭头为增大的脾脏,红色箭头为脾动脉,蓝色箭头为脾静脉,绿色箭头为肝脏,呈肝硬化表现
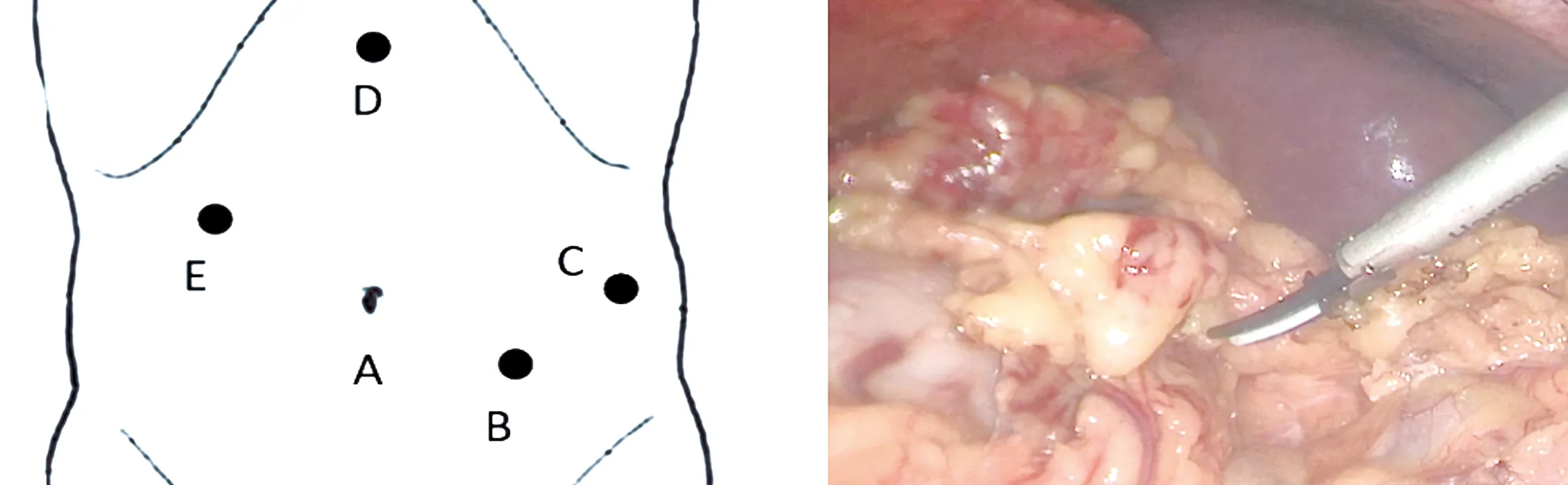
图2 腹部Trocar位置分布 图3 探查见肝脏呈肝硬化表现,脾脏增大
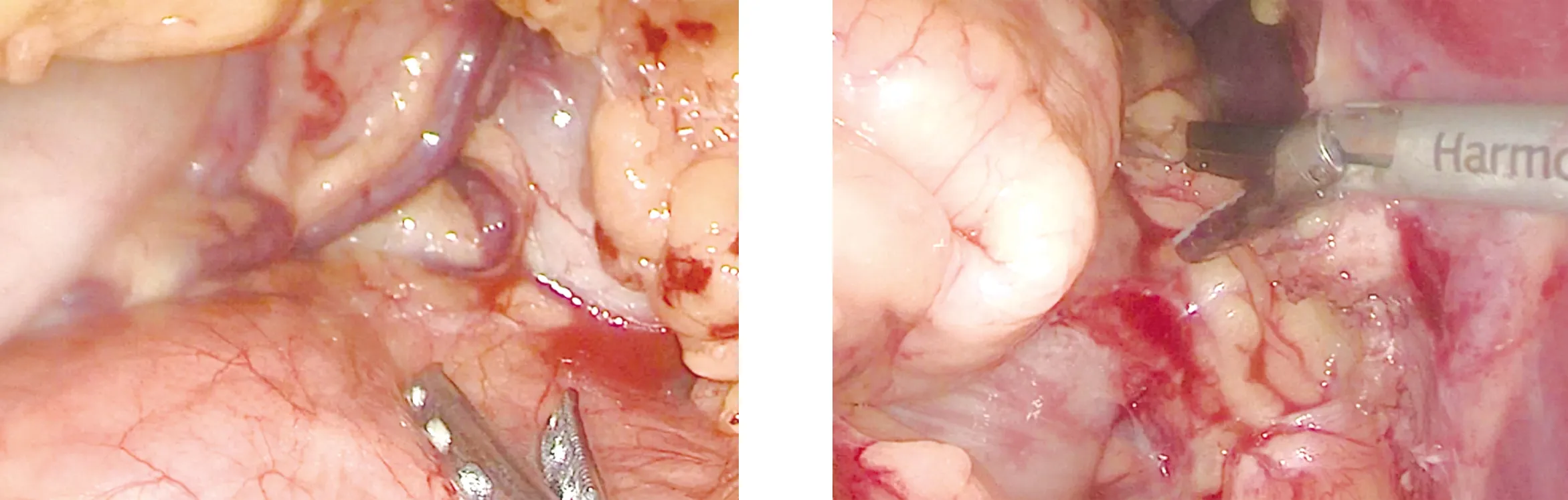
图4 探查胃周曲张的血管 图5 游离脾胃韧带

图6 结扎脾动脉 图7 用切割闭合器离断脾蒂
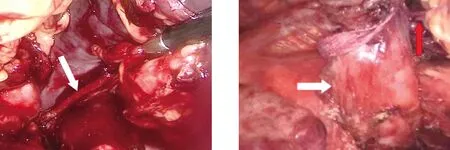
图8 切割闭合器离断脾蒂后(箭头为离断后的脾蒂) 图9 离断食管下段贲门周围血管(白色箭头为食管,红色箭头为食管周围血管)
2 结 果
12例均成功完成LSPD,手术时间190~320 min,平均(241.5±39.8)min;术中出血量300~550 mL,平均(407.5±73.0)mL;术后2~4 d恢复肛门排气并开始流质饮食,平均(2.6±0.6)d;术后住院7~21 d,平均(8.6±3.8)d。术后发生腹腔出血1例,经介入造影检查提示脾动脉残端分支出血,予以弹簧圈及自制明胶海绵条栓塞止血治疗后出血停止;腹水5例、胸腔积液3例,经补充白蛋白、利尿治疗后,腹水、胸水消失;肺部感染1例,门静脉血栓形成1例,均经保守治疗后好转,无围手术期死亡病例。术后随访10~30个月,脾功能亢进均得到纠正,3例钡餐示轻度食管胃底静脉曲张,9例钡餐未见异常,均未再出现呕血、黑便等上消化道出血症状。
3 讨 论
肝硬化门静脉高压症是我国常见病,其中约50%的患者会并发脾功能亢进及食管胃底静脉曲张[3]。据报道,首次消化道出血死亡率约为20%,1~2年内再出血率达60%~70%[4]。20世纪80年代裘法祖院士首创脾切除联合贲门周围血管离断术治疗肝硬化门静脉高压症,此术式不仅能有效控制上消化道出血,同时也能维持肝脏血流灌注,改善肝脏功能,提高机体免疫力。截至目前,此术式仍是主要术式[5]。传统开腹手术创伤大,术后康复慢,住院时间长。随着腹腔镜技术的发展,学者们开始尝试LSPD,其以微创优势得到快速发展[6-8]。2005年鲁发龙等[7]报道了LSPD的临床应用,2013年Zhe等[8]对比了LSPD组与开腹组的疗效,手术时间基本相同,LSPD组出血量更少,术后胃肠道功能恢复更快,是安全、可行的术式。
对于门静脉高压症行LSPD,我们不主张预防性行脾切除+贲门周围血管离断,我们选择的病例至少有一次以上消化道出血病史。由于我国门静脉高压症多为肝炎后肝硬化所致,因此术前肝功能的评估尤为重要,我们选择肝功能Child分级为A级或B级的患者进行手术,术前彩超检测门静脉血流方向及流速,患者门静脉血流方向均为入肝血流。研究表明,门静脉流速越慢,术后门静脉血栓发生率越高[9]。术前常规行保肝治疗,调整凝血功能。禁忌证包括:肝功能Child C级、合并无法耐受全麻插管及气腹的基础疾病、急性上消化道大出血、生命体征不平稳、需紧急抢救。
术中,根据我们的经验,游离脾胃韧带、离断胃短血管时可先不处理脾上极血管,因为此时脾上极的操作空间小,极易造成脾上极血管撕裂,导致大出血,被迫中转开腹;而离断脾蒂后再处理脾上极血管,由于可操作空间变大,使得处理此处血管更加容易,同时由于脾脏的绝大部分血管均已离断,即使损伤了脾上极血管,也不会出现大出血的情况。此外,我们先寻找脾动脉主干,并用Hem-o-lok结扎,此法结扎确切,避免了术后脾动脉残端出血,同时截断了经脾动脉入脾血流,脾内积存的血液经脾蒂回输,可减少术中出血,缩小脾脏体积,增加手术操作空间,使手术易于进行[10]。根据我们的经验,术前行上腹部增强CT检查,可初步判断脾动脉位置,便于术中快速寻找脾动脉。本组中1例患者因术中未先处理脾动脉主干,脾动脉结扎不确切,术后出现腹腔出血。回顾分析此例患者资料,术中寻找脾动脉主干时由于脾动脉位置深在、分离困难,遂放到最后与脾蒂一同用腔镜下切割闭合器离断,术后发现腹腔出血,先用止血药物保守治疗,效果差,遂行介入造影检查,提示残留的脾动脉末端见多个造影剂外溢,明确原因为术中脾动脉残端处理不确切,术后脾动脉残端分支出血,栓入弹簧圈及自制明胶海绵条,复查造影未见造影剂外溢征象,出血停止。
离断贲门周围血管时应注意分层游离,打开双侧膈肌角,充分游离食管下端,需离断至贲门上5~8 cm,避免遗漏少数位置隐蔽的异位高位食管支[11]。操作过程中注意动作轻柔,充分显露,我们选择置入宽纱布条,环绕食管下端贲门,并打一松结,夹住纱布条牵拉食管,避免了无损伤钳直接牵拉食管导致食管肌层意外撕裂;同时尽量减少对膈肌的刺激,以降低术后胸腔积液的发生率。本组术后发生3例胸腔积液,经保守治疗后消失。术后1例患者出现门静脉血栓形成。对于脾切除术后门静脉血栓形成的原因,郑波等[12]认为,年龄、门静脉直径、脾静脉直径、门静脉血流速度、血流状态的改变、手术操作对血管内膜的损伤及凝血状态(D-二聚体、血小板计数)的改变等均是其影响因素。术后我们常规检测凝血功能及D-二聚体,如血液呈高凝状态,在无活动性出血的情况下早期应用低分子肝素抗凝,再改为口服阿司匹林或华法林抗凝治疗半年(阿司匹林或华法林与低分子肝素重叠应用2~3 d),可有效预防LSPD术后门静脉血栓的形成[13]。
综上,LSPD具有手术创伤小、术后康复快、住院时间短等优点,治疗门静脉高压症是安全、可行的,短期随访效果确切。随着腹腔镜技术的发展及器械的改进,相信LSPD治疗门静脉高压症会被越来越多的术者与患者所接受。

