生长相关蛋白43通过抑制T细胞核因子1入核保护足细胞的机制
连智雯 张 丽 窦曹帅,3 张 鸿 柯贵宝 陈雪芹,3 李 卓马建超 廖如意 何朝生 梁馨苓 刘双信1,,3
足细胞损伤是多种肾脏病发生的重要原因,但其损伤机制尚未完全清楚。国内[1-4]和国外[5-7]研究结果表明T细胞核因子1(nuclear factor of activated T-cells,cytoplasmic 1,NFATc1) 活化是导致足细胞损伤、凋亡、肾小球硬化的重要原因。生长相关蛋白43(growth associated protein-43,GAP-43)是神经组织特异性表达的蛋白,是钙激活蛋白家庭的一员,可调节Ca2+流量及钙调蛋白的效力[8],在第二信使信号通路中参与信号传递[9]。研究表明钙调磷酸酶(CaN)-NFAT 信号轴活化参与足细胞损伤、凋亡和肾小球硬化[5-7]。GAP-43在神经系统[11-12]、心脏[13]等领域得到广泛研究,然而在肾脏中表达及效应尚无报道。本研究拟通过人类肾小球疾病及脂多糖(LPS)损伤细胞模型观察GAP-43在足细胞中的表达,并进一步探究GAP-43对足细胞效应机制。
材料与方法
仪器和试剂RMPI 1640培养基(CORNING);胎牛血清(Gibco)、0.05%胰酶;核浆蛋白提取试剂盒(凯基);γ干扰素(ProSpec); histone 抗体(CST);GAP-43 抗体、NFATc1、nephrin、CaN(Abcam);Synaptopodin 抗体(Santa);荧光二抗488、荧光二抗555(Thermo);腺病毒HBAD-m-Gap43-3xflag-GFP(汉恒生物);逆转录试剂盒、Trizol(Life Tech-nologies);LPS(Sigama);β-actin抗体(Affinity)。
足细胞的培养和实验分组条件永生化小鼠足细胞系由Rush University Medical Center 惠赠。足细胞复苏后用含(2~4)×104U/L 重组小鼠γ 干扰素及5%胎牛血清(FBS)的培养基先在33℃、5% CO2培养箱中增殖,细胞融合达70%~80%时转入5% CO2、37℃培养箱中分化。37℃培养9~11d 后,足细胞分化成熟。本实验所有足细胞实验均在分化成熟后进行。足细胞实验分组如下:(1)为明确LPS诱导GAP-43的时间效应,分组如下:LPS(100 μg /ml)培养刺激0h、24h、48h、72h;(2)为探讨过表达GAP-43对足细胞nephrin表达、活动性及NFATc1 核内表达的影响,分组如下:正常对照组;LPS组:无血清培养液培养24h后LPS刺激72h;过表达对照组(vector+LPS 组):无血清培养液及5 μl对照病毒(vector)干预24h后LPS刺激72h;过表达组(GAP-43+LPS组):无血清培养液及5 μl过表达GAP-43腺病毒(HBAD-m-Gap43-3xflag-GFP)干预24h后LPS干预72h。
免疫荧光正常肾组织标本取自于肾癌患者手术切除的邻近正常肾组织,微小病变型肾病(MCD)、局灶节段性肾小球硬化(FSGS)、膜性肾病(MN)肾组织标本取自广东省人民医院肾内科肾活检标本。将细胞或肾组织冰甲醇固定、0.5% Triton X-100透化10 min、5%FBS蛋白封闭30 min,然后滴加一抗过夜,避光加入相应的荧光二抗,封片,通过激光共聚焦显微镜观察。其中肾小球疾病患者足细胞,是在肾活检组织免疫荧光染色中通过足细胞标记蛋白Synaptopodin来标记足细胞。
Western印迹细胞成熟后加入蛋白裂解液(提取核蛋白加入核蛋白裂解液)刮取蛋白,测量蛋白浓度,加入变性液98℃ 10 min 变性蛋白。制备合适浓度Western胶后,蛋白上样,80V电泳,恒流200 mA、2h电转到PVDF膜上。5%牛奶封闭30 min,加入相应一抗二抗孵育,化学发光液曝光,Image J软件分析灰度值。
实时荧光定量PCR(RT-PCR)Trizol法提取细胞总RNA,测定浓度,反转录试剂盒将RNA反转录成cDNA。按照SYBR Green PCR试剂盒说明书操作检测目的基因表达。每个样本设3个复孔,定量结果取平均值。引物序列如下:GAP-43正义链5′-A-C-C-A-C-C-A-T-G-C-T-G-T-G-C-T-G-T-A-T-G-A-G -3′,反义链5′-T-C-C-G-G-C-T-T-G-A-C-A-C-C-A-T-C-T-T-G -3′;β-actin正义链5′-G-C-T-T-C-T-A-G-G-C-G-G-A-C-T-G-T-T-A-C -3′,反义链5′-C-C-A-T-G-C-C-A-A-T-G-T-T-G-T-C-T-C-T-T -3′。
病毒感染37℃ 5%CO2培养箱中二次分化的足细胞分化成熟之后,向含有5 ml无血清的培养液中加入5 μl的腺病毒液(HBAD-m-Gap43-3xflag-GFP),进行瞬时转染,感染24h后,吸去培养皿中的培养液,换成普通含有5%血清的培养液,再做其他干预。
划痕实验将已分化成熟的足细胞接种到六孔板,5% CO2、37℃孵育过夜。用1 ml无菌吸头末端刮除每孔盖玻片上的细胞,刮出“井”字,PBS 轻轻洗涤后换上新鲜的培养液,用腺病毒液(HBAD-m-Gap43-3xflag-GFP),进行瞬时转染,感染24h后,进行LPS处理72h。去上层培养液,PBS洗涤2次,-20℃冰甲醇固定15 min,PBS洗3 次,0.5% Triton X-100透化10 min,PBS洗3次。含DAPI染色封片剂封片,置于荧光显微镜下观察,所用图片均在40倍镜下拍摄。
统计学方法采用《SPSS 20.0》统计软件进行数据分析,符合正态分布计量资料用均数±标准差表示,组间比较用单因素方差分析,采用LSD检验进行两组间比较,P<0.05为差异有统计学意义。
结 果
GAP-43在肾小球疾病患者肾组织的足细胞中表达降低免疫荧光染色后,通过肾小球足细胞标记蛋白Synaptopodin来定位足细胞,激光共聚焦显微镜观察,结果显示正常肾组织肾小球足细胞表达GAP-43蛋白,而在MCD 、FSGS 、MN患者的肾小球足细胞内GAP-43的表达明显降低(图1) 。

图1 GAP-43在肾小球疾病患者肾组织的足细胞中表达减少MCD:微小病变肾病;FSGS:局灶节段性肾小球硬化;MN:膜性肾病;GAP-43:生长相关蛋白43;人类肾组织免疫荧光染色:绿色为GAP-43,红色为Synaptopodin(激光共聚焦显微镜,×400)
LPS刺激下足细胞GAP-43表达减少LPS体外刺激足细胞0h、24h、48h、72h后,通过足细胞标志蛋白Synaptopodin定位足细胞,DAPI标记细胞核,免疫荧光结果显示,与正常对照组比较,LPS组GAP-43表达明显降低(图2)。同样RT-PCR及Western印迹检测也发现足细胞GAP-43表达,与正常对照组相比,LPS组足细胞GAP-43蛋白表达量明显降低(P<0.05)(图3)。

图2 LPS体外处理后,足细胞GAP-43表达降低control:正常对照组;LPS:脂多糖;GAP-43:生长相关蛋白43;体外足细胞免疫荧光染色结果:蓝色为DAPI,绿色为GAP-43,红色为Synaptopodin,黄色为Merge 后共定位的足细胞(激光共聚焦,×40)
过表达足细胞中GAP-43效率的验证过表达水平与对照组的相比明显升高(P<0.05),本实验可明确GAP-43过表达有统计学意义,为下一步实验做准备(图4)。
过表达GAP-43后,LPS刺激所致的足细胞裂孔膜蛋白nephrin低表达有所恢复nephrin是足细胞裂孔膜上的一种跨膜蛋白,在维持足细胞足突的完整性及裂孔膜的正常功能有着重要作用。与正常组相比,体外培养的小鼠足细胞在LPS刺激72h后,特异性膜蛋白nephrin表达明显降低;与vector组比较,体外培养的小鼠足细胞用腺病毒感染过表达GAP-43后,LPS刺激72h,特异性膜蛋白nephrin低表达有所恢复(图5a、5b)。

图3 LPS处理后,足细胞GAP-43表达减少LPS:脂多糖;GAP-43:生长相关因子43;a、b:LPS干预足细胞不同时间对GAP-43表达的影响(a:实时定量PCR,b:Western 印迹及定量分析);与0h相比,*:P<0.05,n=3
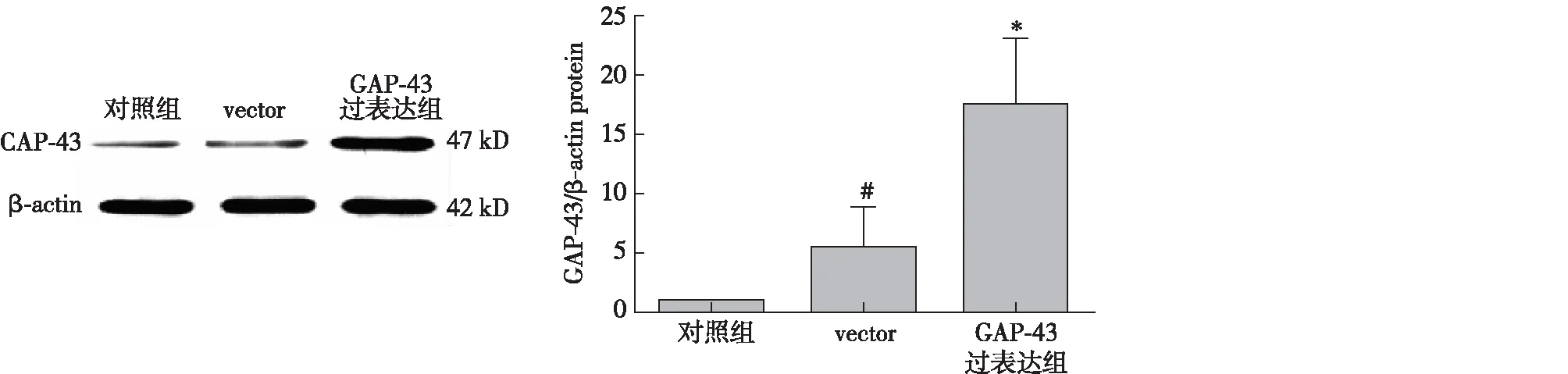
图4 GAP-43过表达效率验证vector:病毒对照组;GAP-43:生长相关蛋白43;与对照组比,#:P>0.05,*:P<0.05,n=3

图5 过表达GAP-43对足细胞的保护作用GAP-43:生长相关蛋白43;LPS:脂多糖;CaN:钙调磷酸酶;NFATc1:T细胞核因子1;control:对照组;a:过表达GAP-43验证Western印迹及定量分析;b:过表达GAP-43对nephrin影响,Western印迹及定量分析;c、d:过表达GAP-43对CaN及NFATc1影响Western 印迹及定量分析;#:与control组相比,P<0.05,n=3;*:与vector+LPS组比较,P<0.05,n=3
过表达GAP-43后,LPS刺激增加的CaN表达和核NFATc1表达降低与正常组相比,体外培养的小鼠足细胞在LPS刺激72h后,Western印迹显示CaN蛋白及细胞核内NFATc1表达明显增加;与vector组比较,体外培养的小鼠足细胞用腺病毒感染过表达GAP-43后,LPS刺激72h,升高的CaN蛋白及细胞核内NFATc1表达明显下调(P<0.05)(图5c、5d)。
过表达GAP-43足细胞的活动性降低足细胞活动性的变化与足细胞损伤有着直接的关系。本实验通过划痕实验来观察足细胞在不同条件下的活动性变化,通过计数足细胞偏离划痕边缘的数量进行统计分析。与正常组相比,体外培养的小鼠足细胞在LPS刺激72h后,可看足细胞迁移数目明显增多,足细胞活动性增高(P<0.05);与vector组比较,体外培养的小鼠足细胞用腺病毒感染过表达GAP-43后,LPS刺激72h,足细胞迁移数目明显减少,足细胞活动性降低(P<0.05)(图6)。
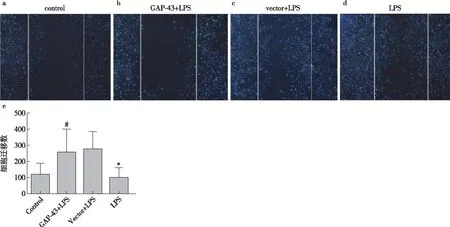
图6 GAP-43对足细胞活动性影响a~d:足细胞划痕实验结果(蓝色为DAPI);Control组相比,LPS刺激后,足细胞迁移数目明显增多,足细胞活动性增高,#:P<0.05,n=30;与vector+LPS组比较,过表达GAP-43后,足细胞迁移数目明显减少,足细胞活动性降低,*:P<0.05,n=30(荧光显微镜,×40)
讨 论
足细胞是肾小球滤过屏障的重要组成部分,几乎参与了所有肾小球疾病的病理改变,也是临床治疗的重要靶点[14]GAP-43在第二信使信号通路中参与信号传递的过程[8]。细胞在静息状态下,GAP-43基因正常表达,在既往神经系统研究中,一系列应激刺激下(缺血、缺氧) 可导致损伤部位周围正常组织表达上升[15-16]。GAP-43是钙激活蛋白家庭的一员,可调节Ca2+流量及钙调素的效力[9]。GAP与钙调素结合及被PKC磷酸化的区域为共同结合域(GAP-43第39~51位氨基酸构成的一个结构域)[9-10],同时GAP-43是通过磷酸化及去磷酸化来发挥作用。在足细胞中,GAP-43 的表达和效应尚未有报道。本研究首次发现在人类肾组织的肾小球足细胞及体外培养的分化成熟足细胞中均有GAP-43的表达,且在人类慢性肾脏病MCD、FSGS、MN患者肾小球足细胞中表达降低,体外培养的足细胞在LPS损伤刺激下表达也下降。提示GAP-43可能与足细胞损伤有关,研究表明当足细胞受损时,足细胞标记蛋白nephrin表达下降。为进一步探究GAP-43在足细胞中的效应,过表达GAP-43后,LPS刺激下,降低的足细胞标记蛋白nephrin表达明显上调。以上结果表明对于足细胞而言GAP-43是一个保护因子。
GAP-43是钙激活蛋白家庭的一员,GAP与钙调蛋白结合及被PKC磷酸化的区域为相同区域。即当Ca2+低水平时,GAP-43与钙调蛋白(CaM)紧密结合,在第二信使作用下Ca2+大量涌入细胞,GAP-43 被磷酸化, GAP-43 便释放CaM[10]。CaM 的释放,引起神经末端局部位点CaM 依赖的级联蛋白CaN激活。国内外研究者[5-7]报道,CaN-NFAT 信号轴活化参与足细胞损伤、凋亡和肾小球硬化。在绝大多数肾小球疾病,CaN 抑制剂(如环孢素A)都有显著降低尿蛋白和保护足细胞的作用,反映了经典通路CaN-NFAT在肾小球疾病发病机制中的至关重要。本研究发现,在LPS损伤刺激下,足细胞GAP-43表达降低。猜想其对足细胞的损伤保护机制是否与核转录因子NFATc1有关? 国内外研究均发现NFATc1是足细胞损伤的重要因子[17-19],转录因子NFAT 分子家族有五个亚型,分别为NFAT1、NFATC1、NFAT3、NFAT4、NFAT5,除NFAT5外其他成员都受Ca2+-CaN信号通路调节[20],当细胞受到刺激引起细胞内游离钙离子增加时,CaN活化,催化核转录因子NFAT 去磷酸化后进入细胞核,与其他转录因子结合调控细胞的增殖、分化、生长[20],过表达足细胞GAP-43表达后,LPS刺激导致的足细胞CaN活化抑制,核NFATc1 蛋白表达减少。这些结果表明GAP-43可能是通过抑制经典CaN-NFAT通路,减少NFATc1 的入核来保护足细胞。
本研究首次发现GAP-43在足细胞中有表达,且是一个足细胞保护因子,可能是通过CaN-NFAT信号轴介导足细胞的保护损伤机制。本研究丰富了CaN-NFAT 信号轴机制,可能为临床治疗慢性肾小球疾病提供新的干预可能。除本研究发现的GAP-43-CaN-NFATc1信号轴以外,可能还存在其他信号通路调控足细胞损伤。后续我们将继续探究相关问题,并构建转基因动物模型,进一步验证GAP-43对CaN和NFATc1信号轴的关系及对肾脏损害的影响,从而为GAP-43应用于临床提供更多的实验依据。

