调控核因子E2相关因子2信号干预足细胞损伤的体外研究
徐 成 徐孝东 翟修文 王 刚 侯 庆 陈朝红 刘志红
足细胞是维系肾小球滤过屏障结构和功能完整性的重要结构,足细胞损伤与蛋白尿和肾小球硬化的发生密切相关[1]。氧化应激和炎症反应参与多种疾病状态下足细胞损伤[2-3]。转录因子核因子E2相关因子2(Nrf2)是机体维持氧化还原稳态的重要调节因子,并在抗炎,抗凋亡和DNA损伤修复等病理生理过程中发挥作用。Nrf2激活剂甲基巴多索隆(CDDO-Me)用于治疗慢性肾病患者,包括糖尿病肾病的多项临床试验正在进行中(未发表资料)。初步临床实验结果显示CDDO-Me可有效增加估算的肾小球滤过率(eGFR),改善慢性肾脏病(CKD)患者肾功能[4]。但Nrf2活化剂CDDO-Me对肾脏固有细胞的影响报道较少。本研究借助嘌呤霉素氨基核苷(PAN)诱导足细胞损伤模型,体外观察Nrf2激活剂CDDO-Me是否对足细胞损伤有直接保护作用,并对其作用机制进行研究。
材料与方法
主要试剂与仪器CDDO-Me(APExBio公司),PAN(Sigma公司),RPMI1640培养液、胎牛血清(美国Gibco公司),γ干扰素(IFN-γ)(美国Sigma),Nrf2抗体(美国Santa Cruz),AnnexinV-FITC/PI凋亡检测试剂盒(南京诺唯赞生物技术有限公司),流式细胞仪(型号 FACS ARIA) 。
足细胞培养和分组永生化的人足细胞株(HPC) 由英国 Bristol 大学Moin.A.Saleem 教授惠赠。足细胞于33℃,在IFN-γ(150 U/ml)条件下诱导增殖,而在37℃不含IFN-γ的培养基中培养10~14d,足细胞停止增殖,获得分化表型。
实验分组 采用PAN 导致足细胞损伤的模型。方法为PAN以100 μg/ml浓度加入培养的足细胞,作用24h,在观察CDDO-Me对足细胞损伤的保护作用研究中,CDDO-Me(100 nmol/L) 单独或与PAN联合与足细胞预孵育24h,因此实验分为四组,分别为正常对照组,PAN损伤组(PAN 100 μg/ml),CDDO-Me对照组(CDDO-Me 100 nmol/L),CDDO-Me治疗组(PAN 100 μg/ml+CDDO-Me 100 nmol/L)。
免疫荧光染色检测足细胞Nrf2入核情况接种于chamber slides中的各组细胞,PBS洗三次。用4%多聚甲醛室温固定30 min,0.5%Triton-x室温破膜5 min和5% BSA室温封闭30 min;加一抗后室温孵育2h,然后加相应的二抗室温反应30 min,加入DAPI室温孵育10 min,PBS洗涤,吹干,甘油封片。
WesternBlot检测足细胞Nrf2的表达细胞处理完成后,以预冷PBS洗涤细胞5 min,加入适量含蛋白酶抑制剂的裂解液冰上充分裂解细胞,4℃下12 000 r/min离心5 min,收集上清液,即为总蛋白。细胞核蛋白提取试剂盒购自恩晶生物有限公司,实验操作按产品说明书进行:收集细胞后依次加入试剂盒中的裂解液A和B液,裂解液加入后均需剧烈震荡,冰上孵育以充分裂解细胞;离心收集沉淀,加入C液,剧烈震荡裂解后,离心收集上清,即为核蛋白。BCA法测定蛋白浓度,取上述测量浓度的提取蛋白20 μg,在经10% SDS-聚丙烯酰胺凝胶电泳分离后转移到PVDF膜上,以5%脱脂奶粉封闭1h,TBST洗膜3次,每次5 min;加入浓度1∶ 400 Nrf2一抗,4℃孵育过夜。TBST洗膜3次,每次5 min。加入浓度为1∶ 5 000的IgG-HRP的二抗室温孵育1h,TBST洗膜3次,每次5min。ECL检测样本免疫活性,凝胶成像系统分析,Image J软件得出灰度值。
qRT-PCR检测NQO1、HO-1、TNF-a、IL-1的表达水平收集足细胞,总RNA按TaKaRa试剂盒方法提取并用Nanodrop 测定纯度和浓度,再使用逆转录试剂盒(TaKaRa)进行cDNA 合成,PCR引物为人血红素氧化酶1(Heme Oxygenase 1,HO-1):5′-C-A-G-G-A-G-C-T-G-C-T-G-A-C-C-C-A-T-G-A-3′和5′-A-G-C-A-A-C-T-G-T-C-G-C-C-A-C-C-A-G-A-A-3′。醌氧化还原酶1(NAD(P)H Quinone Dehydrogenase 1,NOQ1):5′-G-G-A-T-T-G-G-A-C-C-G-A-G-C-T-G-G-A-A-3′和5′-A-A-T-T-G-C-A-G-T-G-A-A-G-A-T-G-A-A-G-G-C-A-A-C-3′。肿瘤坏死因子-α(Tumor Necrosis Factor,TNF-α):5′-C-C-G-T-G-A-C-A-A-T-T-A-C-C-T-G-G-C-C-T-T-C-3′和5′-C-A-G-G-G-C-C-T-T-C-A-G-C-T-G-G-T-T-T-C-3′。白细胞介素-1(Interleukin-1,IL-1):5′-T-C-A-C-T-T-A-A-A-G-C-C-C-G-C-C-T-G-A-3′和5′-C-C-C-C-T-T-T-G-A-A-T-A-A-A-T-T-A-G-A-C-C-A-3′。参照物 GADPH:5′-G-G-A-G-C-G-A-G-A-T-C-C-C-T-C-C-A-A-A-A-T-3′和5′-G-G-C-T-G-T-T-G-T-C-A-T-A-C-T-T-C-T-C-A-T-G-G-3′。qPCR使用SYBR Green法,PCR热循环条件:95℃ 30s 预变性后,进行 95℃ 5s、 60℃ 1 min的热循环,共 40次;使用仪器为 ABI 7900HT Fast Real time System。读取临界循环数(CT)进行记录分析。以正常对照细胞为矫正样本,用比较阈值法计算目的基因的相对含量(2-△△ct)。
流式细胞仪检测细胞足细胞凋亡足细胞以4×108/L的密度接种于六孔板,每孔2 ml,分化7~14d后,将细胞分组,各组给予相应药物刺激,继续培养24h。按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明步骤进行操作。以不含EDTA的0.5 g/L胰酶消化细胞,轻轻吹打收集细胞,室温下1 500 r/min离心4 min,弃上清,将细胞重悬于500 μL结合缓冲液,加入5 μl Annexin V-FITC和5 μl PI,避光室温反应10 min,1h内上流式细胞仪检测。
Nrf2干扰对足细胞损伤的影响使用LiPofectamine RNA iMax将 si-Nrf2 和对照siRNA-NC转染足细胞(密度约 80%),si-RNA转染按产品说明进行;转染24~48h 后加入PAN处理24h,收集细胞分别用于qRT-PCR,Western Blot 印迹,流式细胞分析。si-Nrf2的具体序列如下:si -Nrf2:5′-G-C-C-U-G-U-A-A-G-U-C-C-U-G-G-U-C-A-U-T-T-3′和5′-A-U-G-A-C-C-A-G-G-A-C-U-U-A-C-A-G-G-C-T-T-3′,si-NC:5′-U-U-C-U-C-C-G-A-A-C-G-U-G-U-C-A-C-G-U-T-T-3′和5′-A-C-G-U-G-A-C-A-C-G-U-U-C-G-G-A-G-A-A-T-T-3′。
统计学方法采用《SPSS 17.0》软件进行统计分析,计量资料结果以均数±标准差表示,两组之间比较采用t检验,P<0.05为差异有统计学意义。
结 果
CDDO-Me促进Nrf2的表达和入核免疫荧光结果显示,正常足细胞Nrf2大部分位于胞质当中,当给予Nrf2激活剂后,Nrf2移位进入细胞核中,100 nmol/L CDDO-Me 处理组Nrf2入核最为显著(图1A),故选用100 nmol/L浓度CDDO-Me进行后续实验。Western blot结果显示,给予PAN刺激足细胞24h,可显著降低总Nrf2和核内Nrf2表达。CCDO-Me显著促进Nrf2入核。与PAN 损伤组相比,CCDO-Me保护组可使总Nrf2和核内Nrf2水平基本恢复到正常水平(图1B)(P<0.0001)。
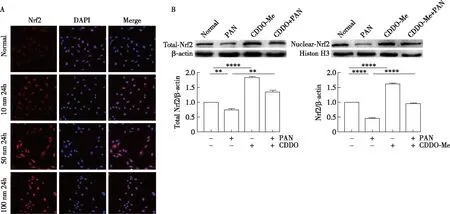
图1 CDDO-Me 促进Nrf2的表达和入核A:免疫荧光观察Nrf2 核转位;B:Western blot检测Nrf2总的表达和细胞核的表达;Nrf2:核因子E2相关因子2;CDDO-Me:甲基巴多索隆;PAN:嘌呤霉素氨基核苷;Normal:对照组;**:P<0.01,****:P<0.000 1
CDDO-Me促进Nrf2下游基因表达与正常组相比,CDDO-Me组明显激活Nrf2的下游靶基因HO-1和NOQ1的表达(P<0.001),而PAN组Nrf2的下游靶基因HO-1和NOQ1mRNA 表达均明显降低(P<0.05);PAN+CDDO组HO-1和NOQ1mRNA高于PAN组(P<0.01),进一步证实CDDO-Me促进Nrf2通路活化(图2)。
Nrf2激活抑制PAN诱导的炎症因子的表达与正常对照组比较,PAN处理足细胞24h,可显著诱导炎症因子TNF-α mRNA和IL-1 mRNA表达,分别上调6.4倍(6.40±0.242)和7.2倍(7.19±0.44),与正常组相比有统计学差异 (P<0.001)。相较于正常对照组,CDDO-Me单独处理对足细胞TNF-α mRNA和IL-1 mRNA表达无明显影响,但CDDO-Me可显著抑制PAN诱导的炎症因子,与单独 PAN 组相比有统计学差异(P<0.001)(图3)。
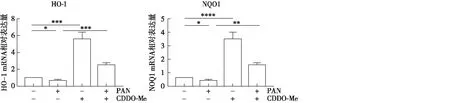
图2 CDDO-Me促进Nrf2下游基因HO-1和NOQ1表达Nrf2:核因子E2相关因子2;CDDO-Me:甲基巴多索隆;HO-1:人血红素氧化酶1;NQO1:醌氧化还原酶1;PAN:嘌呤霉素氨基核苷;*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1

图3 CDDO-Me 抑制PAN诱导的炎症因子TNF-α 和IL-1表达CDDO-Me:甲基巴多索隆;PAN:嘌呤霉素氨基核苷;TNF-α:肿瘤坏死因子-α; IL-1:白细胞介素1;**:P<0.01,***:P<0.001,****:P<0.000 1
Nrf2激活抑制PAN诱导的足细胞凋亡正常对照组足细胞凋亡率为(6.48±0.16),PAN作用足细胞24h可显著诱导细胞凋亡(22.6±0.77),两者有统计学差异(P<0.000 1),CDDD单独处理对细胞凋亡率无明显影响(P=0.92),但CDDD-Me可显著抑制PAN诱导的细胞凋亡(P<0.000 1),同时si-Nrf2抑制足细胞Nrf2,达能显著减弱CDDD-Me对PAN诱导的足细胞损伤的保护作用,和CDDD-Me+PAN组相比si-Nrf2+CDDD-Me+PAN足细胞凋亡率显著升高(图4)。

图4 CDDO-Me抑制PAN诱导的足细胞凋亡CDDO-Me:甲基巴多索隆,PAN:嘌呤霉素氨基核苷;*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1
Nrf2介导CDDO-Me对足细胞的保护作用为进一步明确Nrf2信号介导CDDO-Me对足细胞的保护作用,将足细胞转染Nrf2 siRNA(si-Nrf2),抑制足细胞Nrf2表达,无义siRNA作为阴性对照(si-NC),qRT-PCR和western blot结果显示,Nrf2 siRNA可显著抑制足细胞Nrf2 mRNA和蛋白表达水平(P<0.05,图5A,B),显著抑制Nrf2下游靶基因HO-1和NOQ1的mRNA表达(图5C)。si-Nrf2抑制足细胞Nrf2表达能显著减弱CDDO-Me对 PAN诱导的足细胞损伤的保护作用,与CDDO-Me+PAN组相比,si-Nrf2+CDDO-Me+PAN炎症因子表达(图5D)。
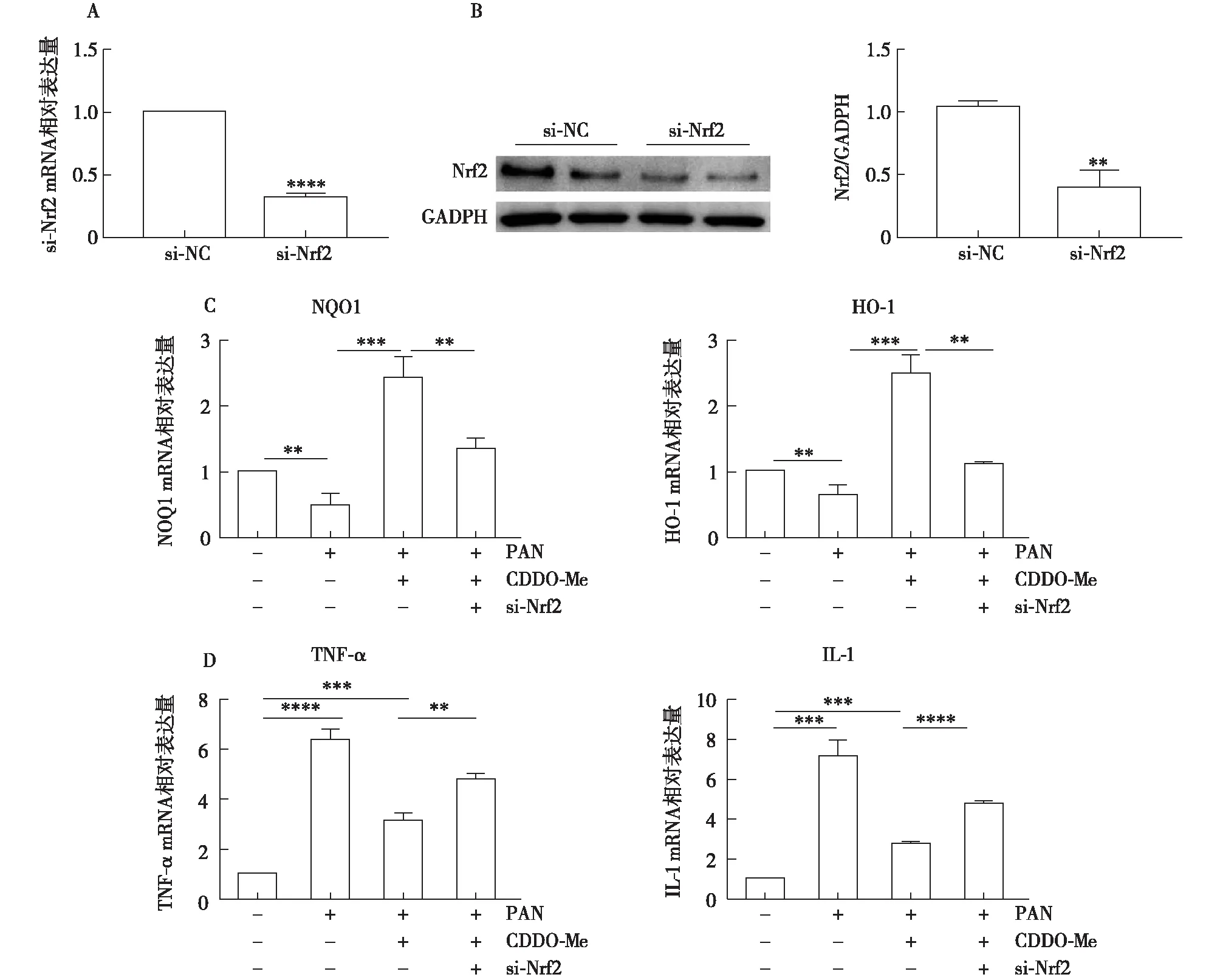
图5 Nrf2介导的CDDO-Me 对足细胞的保护作用A:qRT-PCR显示si-Nrf2转染细胞24h后Nrf2 mRNA的变化;B:Western印记显示si-Nrf2转染48h后Nrf2蛋白的变化;C:qRT-PCR显示si-Nrf2转染细胞24h后HO-1和NOQ1 mRNA的变化;D:qRT-PCR显示si-Nrf2转染细胞24h后TNF-α和IL-1mRNA的变化;CDDO-Me:甲基巴多索隆;Nrf2:核因子E2相关因子2;HO-1:人血红素氧化酶1;NQO1:醌氧化还原酶1;TNF-α:肿瘤坏死因子-α;IL-1:白细胞介素1;PAN:嘌呤霉素氨基核苷;**:P<0.01,***:P<0.001,****:P<0.000 1
讨 论
本研究发现足细胞Nrf2活化后,可抑制PAN诱导的细胞因子产生和凋亡,发挥足细胞保护作用。
足细胞是肾小球滤过膜的重要组成部分,肾小球足细胞病变是膜性肾病、局灶节段性肾小球硬化和糖尿病肾病等疾病共同的病理生理基础,足细胞损伤导致的大量蛋白尿也是上述肾病患者肾功能进行性恶化的重要因素。寻找保护足细胞的药物,实现足细胞靶向性治疗是临床的迫切需求[5-6]。
氧化应激可触发足细胞损伤,引起蛋白尿[7-8]。Tan等[9]发现,敲除细胞外超氧化物歧化酶(EC-SOD,一种在正常成年肾脏中高水平表达的抗氧化酶)小鼠对阿霉素,血管紧张素和蛋白超载等多种肾小球损伤因素更为敏感,蛋白尿,血清肌酐,组织学损伤和氧化应激较受到刺激的野生型小鼠更为严重[9]。
Nrf2是机体抗氧化应激反应的重要的转录因子[10]。生理状态下,Nrf2主要位于细胞浆中,与Kelch样环氧氯丙烷相关蛋白-1(Keap-1)紧密结合,Keap1含有泛素连接酶Cullin3(Cul3)结合位点,介导Nrf2泛素化降解[11-12]。当机体处于氧化应激状态时,Nrf2和Keap1解偶联,Nrf2转移入核,结合靶基因启动子区域氧化应激反应元件(ARE),激活多种抗氧化基因,如血红素氧化酶1(HO-1)、苯醌还原酶(NQO1)和谷胱甘肽S-转移酶(GST)等基因的表达,提高机体抗氧化能力。
大量研究表明Nrf2与肾脏疾病密切有关,在CKD动物中,氧化应激和炎症与Nrf2的表达降低有关[13-15]。Nrf2下游基因的激活可以提高机体的抗氧化能力,减少炎症,减缓肾脏疾病的发生发展。
五环三萜类化合物类化合物CDDO-Me是Nrf2信号通路激动剂,具有抗炎和抗氧化应激作用[16],
Hong等[17]应用CDDO-Me治疗晚期实体瘤和淋巴瘤患者时发现,CDDO-Me可改善患者eGFR,使人们认识到Nrf2信号增强可能对CKD有益[17]。CDDO-Me共价修饰Keap1蛋白中的半胱氨酸残基,使Keap1和Nrf2解偶联,Nrf2得以入核。临床试验表明,CDDO-Me可有效改善糖尿病肾病CKD患者的肾脏功能[18]。
Nrf2激活剂CDDO-Me是否能够改善肾脏病患者的蛋白尿目前尚有争议[14,19-20],但多项CDDO-Me治疗CKD,包括局灶性节段性肾小球硬化患者的临床实验正在进行中(未发表资料)。我们观察了CDDO-Me活化Nrf2对足细胞的影响。
借助经典的PAN诱导足细胞损伤模型[21-22],我们发现CDDO-Me可有效活化Nrf2,表现为促进基础状态和应激状态下足细胞Nrf2入核和表达,Nrf2下游靶分子HO-1和NQO1转录水平升高进一步证实了CDDO-Me激活足细胞Nrf2。Nrf2活化后显著抑制PAN诱导的炎症因子IL-1β和TNF-α上调。Innamorato等[23]研究发现,Nrf2缺失与炎症增强有关。Nrf2敲除小鼠对细菌脂多糖(LPS)诱发的炎症表现出超敏性,而Nrf2诱导剂萝卜硫烷则可显著减弱LPS诱导的海马组织中炎症标记物(诱导型NO合酶,IL-6和TNF-α)。研究已经证实在压力和多种病理生理条件下Nrf2和炎症通路重要分子NF-κB信号通路之间的串扰[24-25]。最新研究则发现Nrf2直接下调炎症因子转录[26]。足细胞Nrf2信号调节炎症因子表达的机制需要进一步探索。
Nrf2活化还可拮抗PAN诱导的足细胞凋亡,Nrf2 siRNA实验证实CDDO-Me对足细胞的保护作用依赖于Nrf2通路的活化。氧化应激和炎症反应均与凋亡密切相关。但Nrf2抗凋亡作用并不完全依赖于其抗氧化的效应。Merchant等[2]在干细胞研究中发现,Nrf2缺陷型(Nrf2-/-)骨髓中活性氧水平并未升高。但Nrf2-/-造血干祖细胞(HPCs)的自发凋亡率增加,抗氧化剂N-乙酰半胱氨酸不能挽救HPCs的凋亡,推测Nrf2可能促进干细胞保护性因子,如粒细胞集落刺激因子的合成[27]。因此,足细胞中Nrf2抗凋亡作用的机制有待进一步研究。

