液相色谱-串联质谱法测定鳗鱼中氯霉素的不确定度评定
臧国栋
(惠州市农产品质量安全监督检测中心,广东 惠州 516008)
测量不确定度定义为表征合理地赋予被测量之值的分散性,与测量结果相联系的参数,它是测量结果质量的指标[1-3].但由于测量误差的存在,无法得到被测量的真值.测量不确定度就是反应了测量误差存在时对所测量值不能肯定的程度,是测量结果质量的指标.在报告物理量测量的结果时,必须给出相应的不确定度,一方面便于使用它的人评定其可靠性,另一方面也增强了测量结果之间的可比性.
氯霉素是一种酰胺醇类广谱抗生素,因为能抑制细菌蛋白质的形成而起到杀菌的作用,所以在水产品养殖中曾被广泛使用,用于治疗由伤寒杆菌、痢疾杆菌等引起的感染,但对造血系统有严重不良反应,长期食用含有该药物残留的食品,将导致人体再生障碍性贫血症,并可能引起人体体内菌群失调及产生耐药性,同时对消化系统也有损害[4-10].根据农业部235号公告,氯霉素在所有动物源食品中不得检出[11].目前,国内关于氯霉素类药物残留的检测方法的报道已比较多,包括酶联免疫法[12]、气相色谱-质谱法[13]以及液相色谱-串联质谱法[14]等.其中高效液相色谱-串联质谱法因其结果准确、灵敏度高,成为氯霉素类药物残留检测的重要方法,但对其不确定度的分析评定相关报道非常少,而且测量不确定度的来源也不够全面,因测量误差的客观存在,我们无法得到被测量值的真值,而所得到的被测量值具有分散性,因而所有测量结果都毫无例外的具有不确定度.本研究依据农业部781号公告-2-2006《动物源食品中氯霉素残留量的测定液相色谱-串联质谱法》[15]和JJF1059.1-2012《测量不确定度评定与表示》[16]着重对鳗鱼中氯霉素残留的测定进行了分析评定.
1 材料与方法
1.1 仪器与试剂
Agilent G6460三重串联四极杆质谱仪(美国Agilent公司),配电喷雾离子源,配Agilent 1290超高效液相色谱仪;TGL-16M高速冷冻离心机(湘仪离心机公司);EYELA N-1200BV-W旋转蒸发仪(日本东京理化);SC-8L-150数控固相萃取装置(广州智真生物公司),waters Oasis HLB固相萃取柱:500 mg,6 mL(美国Waters公司);微孔滤膜:0.22 μm(天津津腾公司);鳗鱼(单位抽样).氯霉素标准物质:纯度99.0%(Dr.E公司);甲醇、乙腈(色谱纯、MERCK公司),正己烷、乙酸乙酯(色谱纯,Amethyst Chemicals)试剂均为分析纯中国医药(集团)上海化学试剂公司,实验室用水为Milli-Q超纯水.
1.2 标准溶液制备
氯霉素标物储备液:精确称取氯霉素10mg于100 mL量瓶中,用甲醇溶解并稀释至刻度,配制成100μg/mL的标准储备液,-18℃保存.
氯霉素标物工作液:精确取上述储备液适量,用流动相逐级稀释制备成100ng/mL混合标准工作液,4℃避保存.
氘代氯霉素内标储备液:取氘代氯霉素10mg于100mL量瓶中,用甲醇溶解并稀释至刻度,配制成100μg/mL的标准储备液,-18℃保存.
氘代氯霉素内标工作液:精确取上述储备液适量,用流动相逐级稀释制备成10ng/mL混合标准工作液,4℃避保存.
2.3 标准曲线的制备
准确量取氯霉素标物工作液和氘代氯霉素内标工作液适量,用流动相稀释成氯霉素浓度分别为0.5、1.0、2.0、5.0和10ng/mL,氘代氯霉素内标浓度为5.0 ng/mL的溶液,供高效液相色谱-串联质谱测定.
2.4 样品处理
准确称取已均质的鳗鱼样品5.00g于50mL离心管,加氘代氯霉素内标工作液250μL,加乙腈5mL,4%氯化钠溶液5mL,匀浆1 min,涡旋振荡2min,15000 r/min离心10 min,吸取上清液到另一个50mL离心管中,重复提取一次.合并两次提取液,提取液中加正己烷5mL,涡旋振荡1min,5000 r/min离心10 min,弃上层液体,重复一次,加水饱和乙酸乙酯溶液5mL,涡旋振荡2min,5000 r/min离心10 min,将上层溶液转移到15mL离心管中,重复提取一次.合并提取液,氮气吹干.用水-乙腈(95:5)3ml溶解,加入已用10mL甲醇、10mL水预洗的固相萃取柱然后用3水洗柱两次,用流动相4mL以1mL/min洗脱于15mL离心管中,然后加入水饱和乙酸乙酯溶液4mL,涡旋振荡1min,5000 r/min离心5min,吸上层溶液,重复提取一次,合并提取液,氮气吹干.用流动相1.0mL溶解残留物,过0.22μm微孔滤膜于进样瓶,供液质分析.
2.5 液相色谱条件
色谱柱:ZORBAX Eclipse PlusC18柱,2.1 mm×50 mm×1.8μm(Agilent公司);柱温:30℃;流速:0.4 mL/min;进样量:20μL;流动相:甲醇-水(50+50).
2.6 质谱条件
电离方式:电喷雾电离源(ESI),负离子模式扫描,多反应监测(MRM),监测离子为:氯霉素320.6/152.2,320.6/256.9,氘代氯霉素内标326.3/157.2,离子源温度:350℃;气体:氮气;干燥气流速:6L/min;雾化器压力:310kPa;鞘气温度:350℃.
2.7 不确定度数学模型的建立
测量不确定度数学模型如下所示:
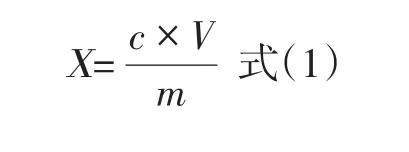
其中:X为试料中氯霉素的残留量(μg/kg);c为供试溶液中氯霉素的浓度(ng/mL);V为溶解残余物的体积(mL);m为组织样品质量(g).
3 不确定度评估
3.1 测量不确定度的来源
根据测量过程和数学模型分析,测定氯霉素的不确定度主要有几个来源:①标准品配制引入的不确定度;②样品称量m引入的不确定度;③测量重复性的不确定度;④样品定容V引入的不确定;⑤标准曲线拟合引入的不确定;⑥回收率引入的不确定度.
3.2 不确定度分量的评定
3.2.1 标准品溶液配制的相对不确定度
3.2.1.1 氯霉素标准物质纯度引入的不确定度
根据标准物质证书提供的信息,氯霉素的P为98.5%,扩展不确定度均为0.5%(k=2).其相对标准不确定度Urel(P)为:

3.2.1.2 标准品称量引入的不确定度
称量天平为Sanorius BS224S电子天平,根据天平检定证书,其最大允许误差为0.1 mg(区间半宽度为0.1 mg),取矩形分布,则称量误差引入的标准不确定度U(m标)为:
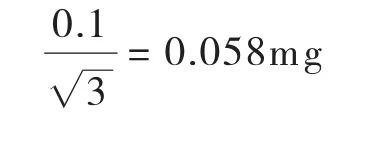
称量氯霉素标准品10.25mg,故氯霉素称量引入的相对标准不确定度Urel(m标)为:
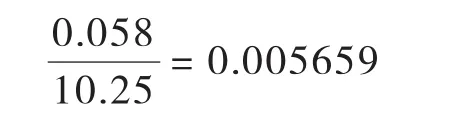
3.2.1.3 标准工作液配制中稀释定容过程中引入的不确定度
标准溶液在稀释定容过程中使用到10mL、100mL容量瓶和1mL和2mL移液管,均检定均为A级.按照JJGl96-2006《常用玻璃量器检定规程》[17],用最大允差计算不确定度,假设为三角分布.
(1)1mL移液管引入的不确定度
校准引入的不确定度:按照JJGl96-2006《常用玻璃量器检定规程》[17],1mLA级移液管最大容量允差为±0.007mL,按三角分布,标准不确定度U1(V1)为:
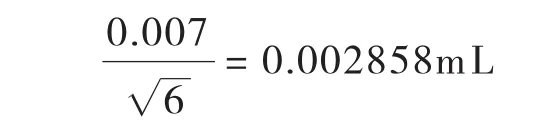
温度变化引入的标准不确定度:环境温度变化为±3℃,甲醇的膨胀系数为1.18×10-3℃,取矩形分布(k=3),其标准不确定度U2(V1)为:

合成:将以上两项标准不确定度合成如下:
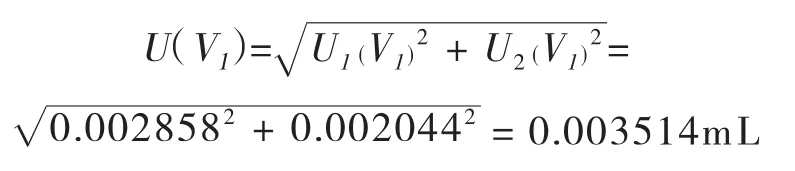
lmL移液管引入的相对标准不确定度Urel(V1)=U(V1)/1=0.003514/1=0.003514
(2)2mL移液管引入的不确定度
校准引入的不确定度:按照JJGl96—2006《常用玻璃量器检定规程》[17],1mLA级移液管最大容量允差为±0.010mL,按三角分布,标准不确定度U1(V2)为:
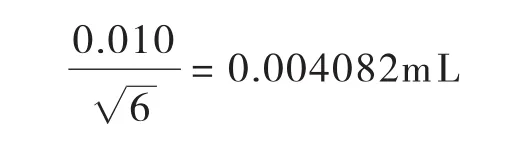
温度变化引入的标准不确定度:其标准不确定度U2(V2)为:
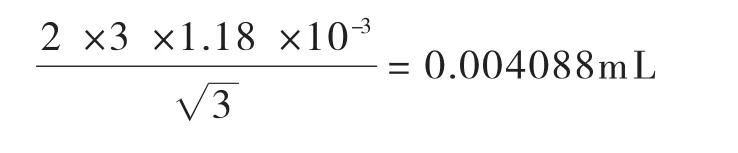
合成:将以上两项标准不确定度合成如下:
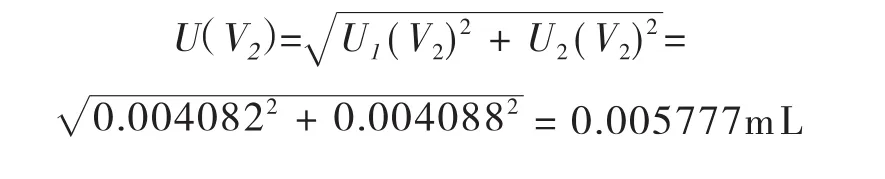
2mL移液管引入的相对标准不确定度Urel(V2)=U(V2)/2=0.005777/2=0.002889
(3)10mL容量瓶引入的不确定度
校准引入的不确定度:按照JJGl96-2006《常用玻璃量器检定规程》[17],10mLA级容量瓶最大容量允差为±0.02mL,按三角分布,标准不确定度U1(V10)为:
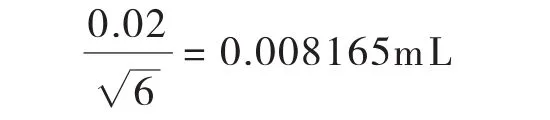
温度变化引入的标准不确定度:其标准不确定度U2(V10)为:
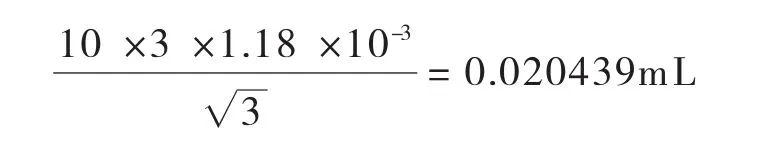
合成:将以上两项标准不确定度合成如下:

10mL容量瓶引入的相对标准不确定度Urel(V10)=U(V10)/10=0.022010/10=0.002201
(4)100mL容量瓶引入的不确定度
校准引入的不确定度:按照JJGl96-2006《常用玻璃量器检定规程》[17],100mL容量瓶的容量允差为±0.10mL,取三角分布,则引入的标准不确定度U1(V100)为:

温度变化引入的标准不确定度:其标准不确定度U2(V100)为:
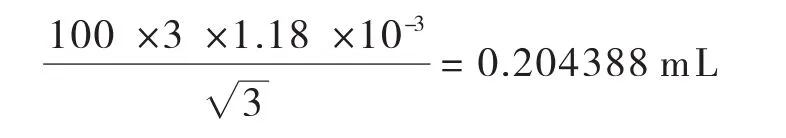
合成:将以上两项标准不确定度合成如下:
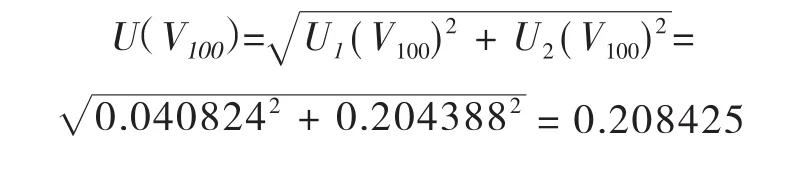
l00mL容量瓶引入的相对标准不确定度Urel(V100)=U(V100)/100=0.208425/100=0.002084
故合成标准工作液配制中稀释定容过程中引入的相对标准不确定度:
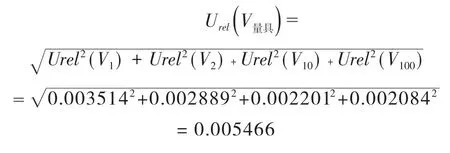
3.2.2 样液中D5-氯霉素总量引入的不确定度
样液中D5-氯霉素总量引入的不确定度主要由移取时使用的1.0ml移液管引入.按JJGl96-2006《常用玻璃量器检定规程》[17]规定,1mL A级移液管最大容量允差为±0.007mL,按三角分布,标准不确定度U1(V1)为:
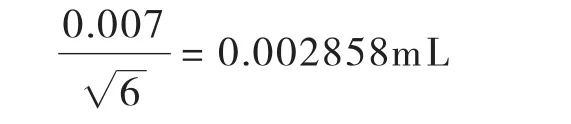
温度变化引入的标准不确定度:其标准不确定度U2(V1)为:
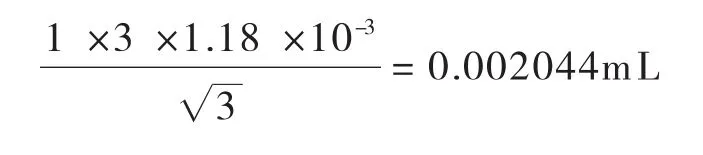
合成:将以上两项标准不确定度合成如下:
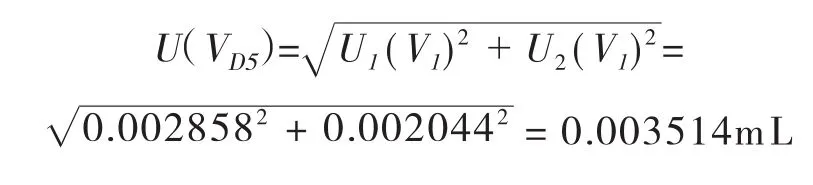
则样液中D5-氯霉素总量引入的相对标准不确定度为:
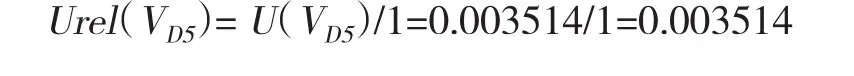
3.2.3 样品称量引入的不确定度
鳗鱼称样量为5.01g,根据天平检定证书,天平允许最大误差为0.01 g(区间半宽度为0.01 g),取矩形分布,引入的相对标准不确定度Urel(m)为:
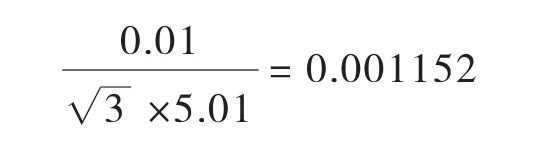
3.2.4 测量重复性引入的不确定度
由重复测定引入的不确定度主要考虑A类不确定度.制备6份平行样品,各加入氯霉素标准工作液(100ng/mL)50μL,则样品加标浓度为1.0μg/kg.上机测得6份加标样品的氯霉素值分别为0.9116μg/kg、0.9092μg/kg、0.9089μg/kg、0.9107μg/kg、0.9092μg/kg和0.9158μg/kg,平均值`x为0.9109μg/kg.单次测量结果的标准偏差为:
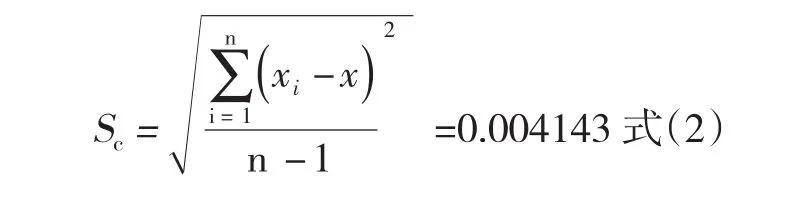
因为在实际检测样品时一般只做两个平行样品,所以测量重复性引入的标准不确定度为:

由测量重复性引入的相对标准不确定度:
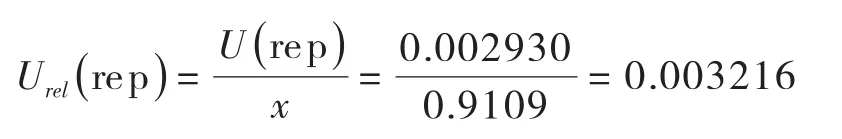
3.2.5 样液最后定容引入的不确定度
校准引入的不确定度:按照JJGl96-2006《常用玻璃量器检定规程》[17],1mL A级移液管最大容量允差为±0.007mL,取三角形分布,则样品定容引入的标准不确定度U1(V1)为:
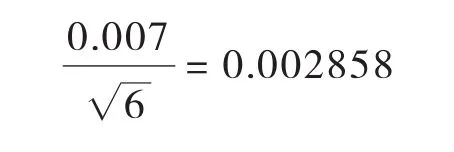
温度变化引入的标准不确定度:其标准不确定度U2(V1)为:
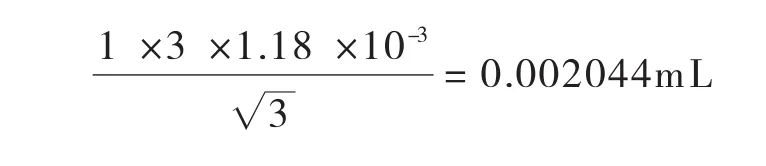
合成:将以上两项标准不确定度合成如下:
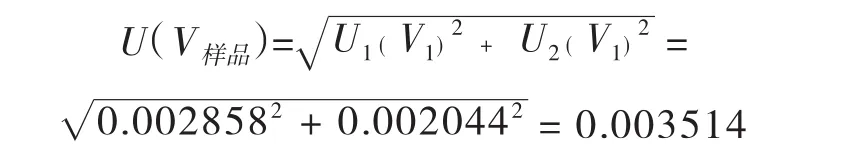
lmL移液管引入的相对标准不确定度Urel(V样品)=U(V样品)/1=0.003514/1=0.003514
3.2.6 由标准曲线拟合引入的不确定度
取由2.3制备的5种不同浓度的标准溶液供液相色谱-串联质谱仪测定,测得标准曲线的回归方程为y=1.7425x+0.0129,相关系数(r)为0.9992.测定结果见表1.
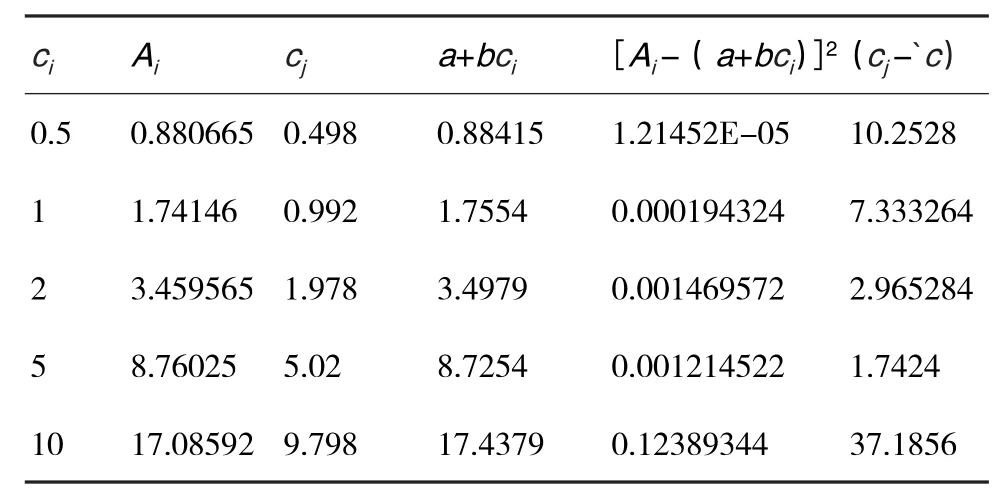
表1 标准曲线拟合计算结果
曲线拟合引入的标准不确定度计算公式为:

式中:S(A)—标准曲线的标准差
p—样品溶液的测定次数,p=6
N—标准溶液的测定次数,N=9
a—标准曲线的截距
b—标准曲线的斜率
xˉ—样品溶液中待测物的浓度,μg/L
c—标准溶液浓度的平均值,μg/L
ci—校准标准溶液的浓度
cj—由校准曲线方程求得的标准溶液的浓度值,μg/L
Ai—单次标准溶液的响应值
3.2.7 由加标回收率引入的不确定度
实验加标回收率结果见表2,按A类不确定度,由加标回收率引入的标准不确定度U(R)为:
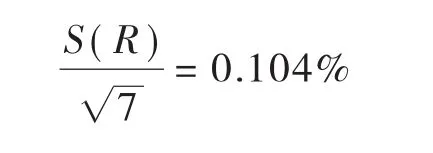
故由加标回收率引入的相对标准不确定度Urel(R)为:
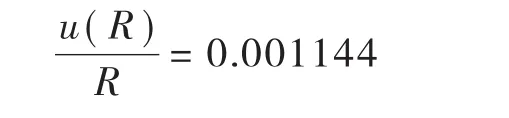
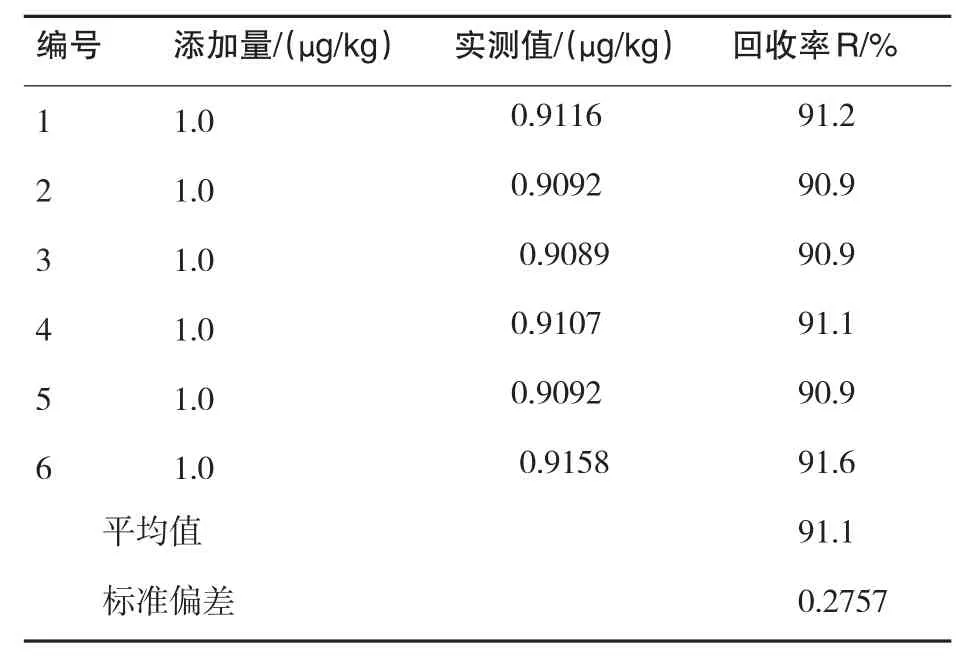
表2 鳗鱼中氯霉素含量测定结果
3.2 .8 合成相对标准不确定度
把所有相对标准不确定度的分量汇总成表,结果见表3.

表3 相对标准不确定度分量汇总表

所以
U(x)=0.085412×0.9109=0.077802μg/kg
4 扩展不确定度与测量结果表示
扩展不确定度:置信概率95%,取包含因子k=2,U=k×U(x)=2×0.077802=0.155604 μg/kg.结果表述:依据农业部781号公告-2-2006《动物源食品中氯霉素残留量的测定液相色谱-串联质谱法》测得鳗鱼中氯霉素残留量为 0.9109μg/kg,则结果表述为(0.9109±0.1556)μg/kg,
5 讨论
本研究对使用液相色谱-串联质谱法测定鳗鱼中氯霉素的检测结果进行了不确定度评定.各不确定度分量评定结果显示,测量不确定度主要来源于测定结果重复性、标准溶液配制以及标准曲线拟合引入的不确定度.因此制样要彻底均匀,减少标准品配制的步骤,标准曲线的配制要精确,减小测定结果的不确定度,以提高测定的结果的准确性.

