新型ED3A类螯合型表面活性剂去除土壤重金属的机理研究
彭忠利,陈鸿雁,王春花
(惠州学院 化学与材料工程学院,广东 惠州 516007)
重金属污染土壤的治理是当今世界的热点和难点.在众多的治理重金属污染土壤的方法中,化学淋洗法能够高效、彻底地去除污染土壤中的重金属.近年来,基于环境保护和治理成本因素考虑,以生物表面活性剂[1-3]和螯合型表面活性剂(ED3A类)[4]为化学淋洗剂的重金属污染土壤的治理已成为研究热点.从结构上分析,目前报道的生物表面活性剂[1-3]都具有一定螯合功能.生物表面活性剂去除土壤重金属机理,目前普遍认为是金属离子与生物表面活性剂形成可溶性络合物[1]或形成金属-生物表面活性剂半胶束[2,3].然而,这种去除机理只是作者的推论,并没有给出直接证据.
近年国内赵保卫课题组[4]开展了螯合型表面活性剂N-LED3A去除土壤重金属的研究,但是对于去除机理没有进行深入探讨.土壤重金属的存在形态有可交换态、碳酸盐结合态、铁锰氧化态、有机态和残渣态.我们前期的研究也表明,螯合型表面活性剂能够不同程度地去除土壤中各种形态的重金属[5],但是其去除机理还不是很清楚.
本文通过对重金属离子溶液和螯合型表面活性剂溶液相互滴定以及用螯合型表面活性剂溶液溶解难溶性重金属盐或氧化物,从直观的实验现象入手,研究螯合型表面活性剂去除土壤重金属机理.
1 材料与方法
1.1 材料
N-(3-十二烷氧-2-羟基丙基)乙二胺三乙酸钠(C12-ED3A3Na),自制,其结构式见图示1[5];其他化学试剂均为分析纯;实验用水由FBZ2001-UP-P超纯水机(青岛富勒姆科技有限公司)制备,电阻率为18.25MΩ.cm.
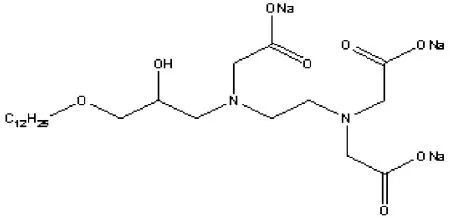
图示1 螯合性表面活性剂C12-ED3A3Na的结构式
1.2 络合滴定
1.2.1 C12-ED3A3Na溶液滴定金属离子溶液
分别配制浓度为0.02 mol/L的硝酸铅、硝酸锌和硝酸铜溶液250mL,配制浓度为0.02 mol/L和0.01 mol/L的C12-ED3A3Na溶液各500mL.分别用移液管取出50mL硝酸铅、硝酸锌和硝酸铜溶液于放有磁力搅拌子的三个250mL锥形瓶中,并将锥形瓶置于磁力搅拌机上搅拌,然后用0.02 mol/L的C12-ED3A3Na溶液分别滴定三种金属离子溶液,观察溶液变化,直到锥形瓶的溶液由澄清至浑浊再到澄清为止.在滴定过程中,每增加几毫升滴定液,搅拌均匀后用电导率仪测试溶液的电导率.作溶液电导率与n(C12-ED3A3Na)/n(金属离子)图.实验温度为25℃±2℃,下同.
1.2.2 金属离子溶液滴定C12-ED3A3Na溶液
用0.02 mol/L的硝酸铅、硝酸锌和硝酸铜溶液分别滴定50mL0.01 mol/L的C12-ED3A3Na溶液,观察溶液变化,直到锥形瓶的溶液由澄清至完全浑浊为止,在滴定过程中同样测试溶液的电导率,作溶液电导率与n(C12-ED3A3Na)/n(金属离子)图.
1.2.3 EDTA滴定Zn2+
取0.02mL/L 25mL硝酸锌于100mL容量瓶中,稀释溶液体积至100mL,定容摇匀后,倒入150ml的锥形瓶中,加入2g六次甲基四胺,再加1滴二甲酚橙,用0.02mL/LEDTA溶液滴定至溶液由紫色变黄色,记录所消耗的EDTA的体积,并按以下公式计算EDTA与金属离子的络合比(m),m=(CEDTA× VEDTA)/CZn2+× VZn2+);在滴定过程,每增加几毫升滴定液,用电导率仪测试溶液的电导率,直到EDTA与硝酸锌的摩尔比值至1.6为止,作电导率与n(EDTA)/n(硝酸锌)图.
1.3 C12-ED3A3Na溶液溶解难溶金属碳酸盐和氧化物
分别将少量碱式碳酸铅、碳酸钙、氧化锌、氧化铅和氧化铜固体放入研钵中,将固体充分磨细,然后各称取5.0×10-4mol分别放入一个盛有50mL0.02mol/L的C12-ED3A3Na溶液的锥形瓶中,震荡,静置一定时间,观察固体溶解情况;分别用超纯水作溶剂浸泡上述固体,作实验对照.
1.4 螯合物的红外光谱测定
分别取25 mL0.02mol/L硝酸铜、硝酸铅和硝酸锌溶液于三个锥形瓶中,然后分别缓慢滴入12.5mL 0.02mol/LC12-ED3A3Na溶液,震荡;将反应混合物放在TG16-WS台式高速离心机(上海卢湘仪离心机仪器有限公司)中,离心机速度为3000r/min,时间为10min,取出,把上清液倒掉;离心管中再加蒸馏水、离心、倒掉上清液,重复三次;将沉淀物取出放在三个烧杯中,然后放在电热鼓风干燥箱(115℃)干燥8个h后取出,冷却;螯合物用KBr晶体混合制片,在TENSOR27傅立叶变换红外光谱仪(布鲁克光谱仪器公司)上测试红外光谱.
2 结果与讨论
2.1 C12-ED3A3Na溶液滴定金属离子溶液的实验现象分析
用C12-ED3A3Na溶液滴定三种金属离子(Pb2+、Cu2+和Zn2+)溶液,溶液都经历由澄清到浑浊再到澄清的过程.

图1 C12-ED3A3Na溶液滴定硝酸铅溶液的实验现象变化
图1显示了C12-ED3A3Na溶液滴定硝酸铅溶液的实验现象变化过程.可以看出,当1mL0.02mol/L的C12-ED3A3Na溶液滴入到50mL0.02mol/L的硝酸铅溶液中时,溶液出现少量沉淀物;当滴入25mLC12-ED3A3Na溶液时,溶液沉淀物最多;继续C12-ED3A3Na溶液,沉淀物开始缓慢变少,滴加到75mLC12-ED3A3Na溶液时溶液变为半透明;滴加到92mLC12-ED3A3Na溶液时,溶液变为澄清透明.这个实验结果说明少量的C12-ED3A3Na与Pb2+作用生成难溶性螯合物,而不是可溶的螯合物,这与文献[3]和刁静茹等人[6]用N-十二酰基ED3A溶解氢氧化铜的实验所得的结论不同.当硝酸铅溶液的Pb2+完全与滴加的C12-ED3A3Na作用生成难溶性螯合物后,再继续滴加C12-ED3A3Na溶液,C12-ED3A3Na会形成胶束,C12-ED3A3Na浓度越大,形成的胶束越多;最后C12-ED3A3Na与Pb2+作用生成难溶性螯合物完全增溶于C12-ED3A3Na胶束中,溶液变为澄清.
2.2 金属离子溶液滴定C12-ED3A3Na溶液的实验现象分析
用上述三种金属离子溶液滴定C12-ED3A3Na溶液的实验中,我们发现溶液都经历由澄清到少许浑浊到出现大量沉淀物的过程.图2显示了硝酸铜溶液滴定C12-ED3A3Na溶液的实验现象变化过程.


图2 硝酸铜溶液滴定C12-ED3A3Na溶液过程中的实验现象变化
从图2可以看出,当1mL0.02 mol/L硝酸铜溶液滴入到50mL0.01 mol/LC12-ED3A3Na溶液时,溶液颜色变为淡蓝色,但是仍然是澄清的,这说明少许的难溶性螯合物能够被大量的C12-ED3A3Na胶束增溶;继续滴加硝酸铜溶液,难溶性螯合物越来越多,溶液变浑浊,而C12-ED3A3Na胶束越来越少直至完全消失,最后,锥形瓶里水层在上面,沉淀物在下层.
2.3 C12-ED3A3Na溶液溶解难溶金属碳酸盐和金属氧化物
对碳酸钙、碱式碳酸铅、氧化铅、氧化锌和氧化铜在C12-ED3A3Na溶液的溶解情况进行了试验,发现除氧化铜在C12-ED3A3Na溶液无明显溶解外,其他的难溶金属碳酸盐和金属氧化物在C12-ED3A3Na溶液中都有明显溶解.碳酸钙固体放入到C12-ED3A3Na溶液后很快会消失、碱式碳酸铅和氧化锌浸泡在C12-ED3A3Na溶液7d左右会完全溶解、氧化铅则需要25d左右才可以完全溶解;氧化铜浸泡在C12-ED3A3Na溶液35d还没有明显溶解.我们知道土壤中有碳酸盐结合态和铁锰氧化态的重金属,因此,这个研究有助于我们了解土壤中碳酸盐结合态和铁锰氧化态的重金属是如何被C12-ED3A3Na去除的.
图3是C12-ED3A3Na溶液溶解碱式碳酸铅的照片.从照片可以看出,碱式碳酸铅浸泡在C12-ED3A3Na溶液6d后,完全溶解,溶液变为澄清.从图4也可以看出,氧化锌完全溶解于C12-ED3A3Na溶液也只需7d时间.在对照实验中,碱式碳酸铅和氧化锌经6d后几乎不溶于水.我们认为在C12-ED3A3Na溶液溶解碱式碳酸铅过程中存在以下溶解-沉淀平衡(1)和络合平衡(2).C12-ED3A3Na能与Pb2+生成难溶性螯合物,难溶性螯合物又会被C12-ED3A3Na胶束增溶,这样会打破(PbCO3)2Pb(OH)2在水中的溶解-沉淀平衡,促使(PbCO3)2Pb(OH)2不断溶解.
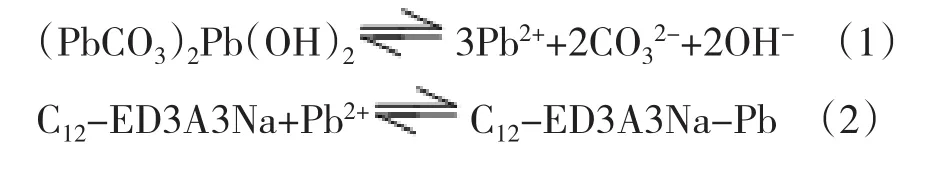

图3 C12-ED3A3Na溶液溶解碱式碳酸铅情况


图4 C12-ED3A3Na溶液溶解氧化锌情况
同样,在C12-ED3A3Na溶液溶解氧化锌过程中,体系存在以下化学平衡(3)(5)和溶解-沉淀平衡(4).C12-ED3A3Na能与体系中微量的Zn2+作用生成难溶螯合物,后者又被C12-ED3A3Na胶束增溶,这样促使(4)和(3)两个平衡向正反方向进行,氧化锌不断被溶解.氧化铜浸泡在C12-ED3A3Na溶液无明显变化,可能是由于在实验条件下氧化铜与水极难生成氢氧化铜,导致溶液体系中几乎不存在Cu2+,这样即使溶液有C12-ED3A3Na存在也不能溶解氧化铜.
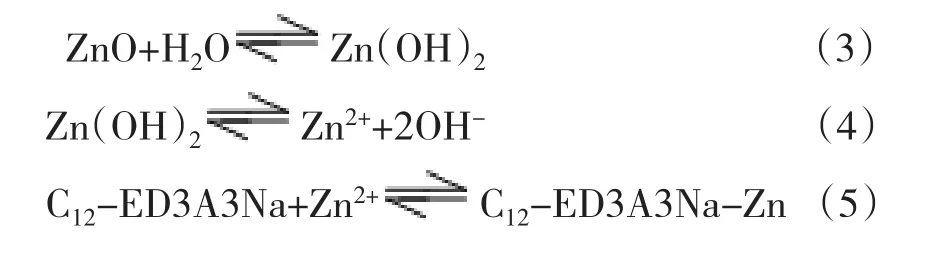
2.4 螯合物的红外光谱分析
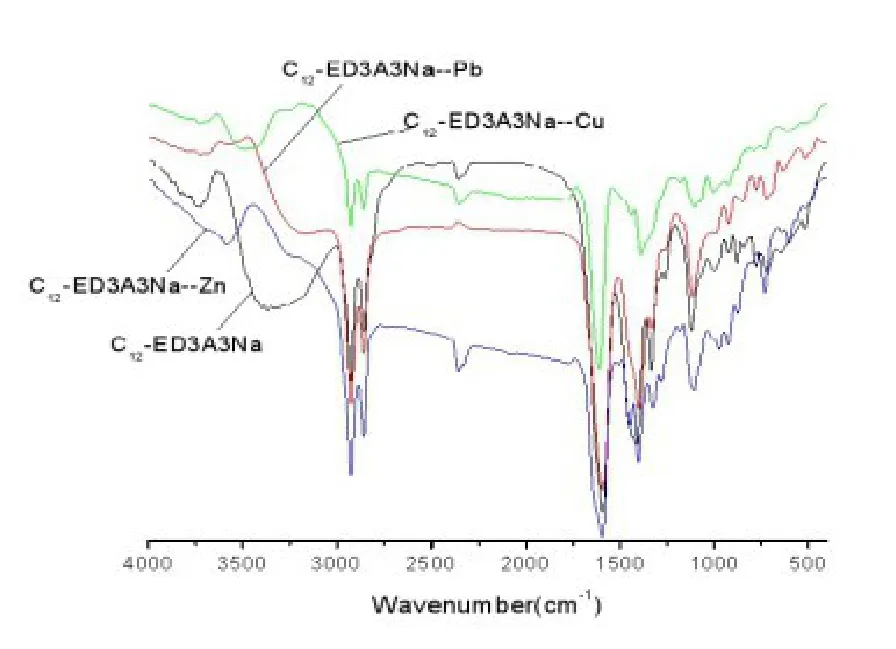
图5 三种螯合物及C12-ED3A3Na的红外谱图
从图5可以看出,在C12-ED3A3Na红外图谱中3300cm-1附近存在-OH缔合峰,而在三种螯合物的红外图谱上这个峰消失或大大减弱,说明C12-ED3A3Na分子中的羟基参与了与金属离子的配位反应.
2.5 滴定过程中电导率分析
图6是C12-ED3A3Na溶液滴定三种金属离子的电导率与两者摩尔比图.从图可以看出,在n(C12-ED3A3Na)/n(金属离子)在0.5(1:2)附近,溶液的电导率最小;同样,用三种金属离子溶液滴定C12-ED3A3Na溶液时,当n(C12-ED3A3Na)/n(金属离子)在0.5(1:2)附近,溶液的电导率也最小.这个实验结果与我们之前的工作[7]的结果不同.我们以前的结果是n(C12-ED3A3Na)/n(金属离子)为1:1时,溶液的电导率最小,由此推断C12-ED3A3Na与金属离子的络合比为1:1.这两个实验结果不同的原因可能是测试的温度不同,因为溶液的电导率受温度的影响,而且温度也可能会影响到螯合剂与金属离子的配位.为了验证电导率法是否可以用来测试络合比,我们用EDTA来滴定硝酸锌溶液,发现溶液电导率一直上升(见图7);当使用经典法EDTA络合指示滴定金属离子求算络合比时,指示剂在n(EDTA)/n(硝酸锌)=1:1时变色,说明EDTA与锌离子的络合比是1:1(此结果与事实相符合),因此,用电导率法测试络合比不可靠.事实上影响电导率的因素有很多,如测量的频率、温度差、电导池两极板表面污着以及电导池的选用等[8],因此,使用电导率测试络合比的方法还有待完善.我们也尝试用EDTA滴定金属离子的方法,使用相同的指示剂和测试条件来测试C12-ED3A3Na与金属离子的络合比,但是发现指示剂在滴定过程中一直不变色,因此,络合指示法测定C12-ED3A3Na与金属离子的络合比也有待进一步研究.

图6 C12-ED3A3Na溶液滴定三种金属离子的电导率变化
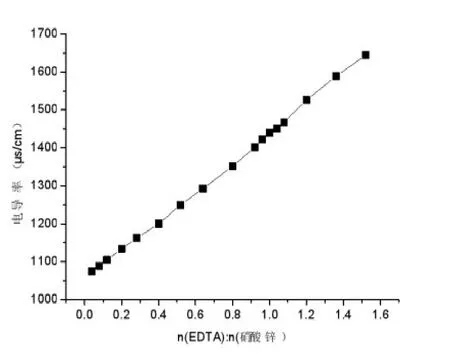
图7 EDTA溶液滴定硝酸锌溶液的电导率变化
3 结论
(1)C12-ED3A3Na去除土壤或水体重金属的机理可以概述为:C12-ED3A3Na单体首先与游离的可溶性重金属离子生成难溶性螯合物,难溶性螯合物随即增溶于C12-ED3A3Na胶束中,这样就促使难溶性的重金属盐(碱或氧化物)发生化学转化和(或)溶解成可溶性重金属离子,可溶性重金属离子又与C12-ED3A3Na单体结合成难溶性螯合物,后者再增溶C12-ED3A3Na胶束中,这样就可去除土壤或水体各种形态的重金属.
(2)三种螯合物的红外图谱表明C12-ED3A3Na中的羟基参与了配位反应.
(3)用测试电导率来确定螯合剂与金属离子的络合比的方法还有待完善.

