淋巴浆细胞性淋巴瘤/华氏巨球蛋白血症10例临床病理学特征分析及MYD88基因突变检测
盛 东,王维格,蒋翔男,薛 田,朱晓丽,周晓燕,李小秋
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系 上海 200032
淋巴浆细胞性淋巴瘤(lymphoplasmacytic lymphoma,LPL)是一类相对少见的小B细胞淋巴瘤,临床上以男性患者居多,常伴有骨髓受累、贫血和血清IgM型免疫球蛋白异常增 高[1]。组织学形态多表现为淋巴结副皮质区、髓质区弥漫性淋巴样浸润,肿瘤由数量不等的小淋巴细胞、浆细胞和浆样淋巴细胞组 成[1]。免疫表型而言,肿瘤细胞表达全B细胞抗原,并限制性表达免疫球蛋白轻链[1]。华氏巨球蛋白血症(Waldenström macroglobulinemia,WM)为LPL中累及骨髓并伴有血清IgM蛋白不同程度增高的病例[2]。LPL/WM常需与其他小B细胞性肿瘤、特别是伴有浆细胞样分化的病例鉴 别[1],然而,相当部分LPL/WM具有不典型临床或组织病理学表现[3],使得此类鉴别诊断较为困难。近期研究发现,绝大部分LPL/WM病例存在MYD88 L265P基因突变[4],而其他小B细胞类肿瘤则较少检出这一异常[3-5]。在国外,利用二代测序等技术检测MYD88 L265P突变已被应用于临床实践,而在我国,应用这一检查手段诊断和鉴别LPL/WM尚未推广、普及,相关报道亦不多见。本研究回顾性分析了10例LPL/WM的临床病理学特点,并应用传统测序技术完成MYD88 L265P突变点检查,从而探讨这一分子生物学标志物对于确诊LPL/WM的意义。
1 资料和方法
1.1 临床资料
收集复旦大学附属肿瘤医院病理科2016年—2017年期间诊断的LPL/WM病例10例,对照组包括5例伴有显著浆细胞性分化的黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)型边缘区淋巴瘤、4例低级别滤泡性淋巴瘤以及4例小淋巴细胞性淋巴瘤/慢性淋巴细胞性白血病(small lymphocytic lymphoma/chronic lymphocytic leukemia,SLL/CLL),复阅所有病例的H-E及免疫组织化学染色切片,并适当补充、完善免疫组织化学指标检测。所有病例诊断均由3位淋巴瘤专科病理医师复核、确认。患者临床资料来自病史以及部分电话随访信息。
1.2 免疫组织化学染色
采用全自动免疫组织化学分析仪(BenchMark XT,美国Roche公司)进行EnVision两步法染色。第一抗体CD20、CD5、CD10和Ki-67购自瑞士Roche公司,第一抗体kappa、lambda和CD23购自丹麦Dako公司,IgG4购自广州安必平医药科技股份有限公司。具体操作步骤参照试剂盒说明书和全自动免疫组织化学分析仪的标准操作流程。染色结果半定量判读为以下4种类型:① 弥漫强阳性(记作“+”),90%以上的肿瘤细胞呈弥漫强阳性着色;② 阳性(记作“+/-”),瘤细胞有强弱不等的抗原表达,且阳性细胞占所有瘤细胞比例为25%~90%;③ 弱阳性(记作“-/+”),10%~25%的瘤细胞强阳性或异质性阳性着色;④ 阴性(记作“-”),无阳性瘤细胞或阳性瘤细胞比例少于10%。
1.3 MYD88 L265P基因突变检测
经常规4%甲醛溶液固定、石蜡包埋的肿瘤组织样本制备成4~6 μm厚度切片,经二甲苯脱蜡、梯度浓度乙醇去除二甲苯和流水冲洗水化后进行核酸提取,步骤按照DNA提取试剂盒(QIAamp DNA迷你试剂盒,德国Qiagen公司)说明书进行。提纯后的核酸模板加入聚合酶链反应(polymerase chain reaction,PCR)混合液,PCR法扩增MYD88基因。根据MYD88基因组序列设计PCR引物,上游引物为5’-GGGG-ATGGCTGTTGTTAA-3’,下游引物为5’-GCAGGGGTTGGT-GTAGTC-3’。反应体系50 μL,反应条件:96 ℃预变性2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 20 s,共40个循环。PCR扩增产物经琼脂糖凝胶电泳鉴定和PCR纯化试剂盒(QIA quick PCR purification kit,购自美国Qiagen公司)纯化后,在ABI3730XL测序仪(美国应用生物系统公司)上行测序验证。具体操作参考仪器及仪器配套试剂盒的说明书。
2 结 果
2.1 临床资料
10例LPL/WM病例的临床特点总结见表1。所有患者均为男性,发病年龄58~77岁,中位61岁。临床表现多为乏力(9例)、贫血(8例)、出血(包括鼻衄、牙龈出血、皮肤紫癜和瘀斑等,5例),1例有B症状(发热、盗汗、体重减轻)。8例表现为淋巴结肿大,2例伴有脾肿大。所有患者行血清蛋白电泳检查及骨髓活检,均发现有不同程度的IgM型血清免疫球蛋白水平升高(IgM范围为6.8~37.4 g/L)和骨髓受累表现 。4例患者接受R-CHOP(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松)方案治疗,2例接受苯丁酸氮芥(留可然)治疗,1例接受BRD(硼替佐米+利妥昔单抗+地塞米松)方案治疗,1例接受BR(硼替佐米+利妥昔单抗)方案治疗。随访6~36个月(中位18个月),至随访终点,2例无病生存,5例带病生存,3例死亡。

表 1 10例LPL/WM病例的临床信息Tab. 1 Clinical features of 10 LPL/WM cases
2.2 组织病理学表现
10例患者均行病变淋巴结及骨髓活检,镜检结果显示淋巴结结构部分破坏,但多数病例滤泡和淋巴窦结构仍可辨认,肿瘤细胞浸润至淋巴结外脂肪组织(图1A),边缘窦和部分髓窦开放(图1B)。肿瘤细胞主要由肿瘤性小淋巴细胞、浆细胞和浆样淋巴细胞构成(图1C)。肿瘤性小淋巴细胞体积较正常成熟淋巴细胞稍大,细胞质较少,细胞核圆形或轻度不规则,染色质粗,核仁不明显;肿瘤性浆细胞有异型性,体积较正常浆细胞大,细胞核增大,染色质凝集,车辐状结构不明显。浆样淋巴细胞的细胞核与小淋巴细胞相似,但呈偏心性分布,细胞质相对丰富(图1D)。免疫组织化学检测结果总结见表2。所有病例肿瘤细胞CD20呈弥漫强阳性(图2A),6例程度不等地表达CD23(图2B),2例少数细胞表达CD5(图2C),所有检测病例均呈CD10阴性,所有病例肿瘤细胞限制性表达κ轻链(图2D,2E)。肿瘤细胞Ki-67增殖指数在5%~30%之间。IgG4染色显示有4例病灶中反应性浆细胞成分低水平表达这一抗原(图2F)。骨髓活检示7例有骨髓受累表现,多呈结节状或弥漫性小淋巴细胞、浆细胞及浆样淋巴细胞混合性 浸润。

图 1 LPL/WM组织学形态Fig. 1 Histological features of LPL/WM
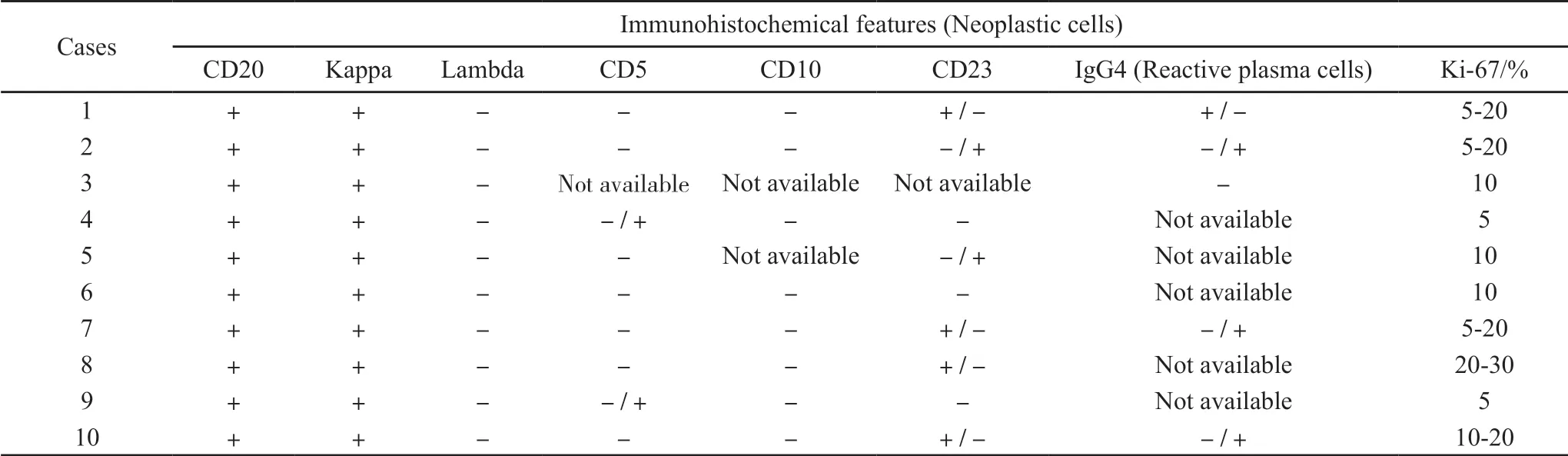
表 2 10例LPL/WM病例的免疫表型特征Tab. 2 Immunohistochemical features of 10 LPL/WM cases

图 2 LPL/WM免疫组织化学染色结果Fig. 2 Immunohistochemical features of LPL/WM
2.3 MYD88 L265P突变分析
10例LPL/WM病例均可检出MYD88 L265P突变(图3),而对照组边缘区淋巴瘤、滤泡性淋巴瘤与小淋巴细胞性淋巴瘤/慢性淋巴细胞性白血病均未检出。
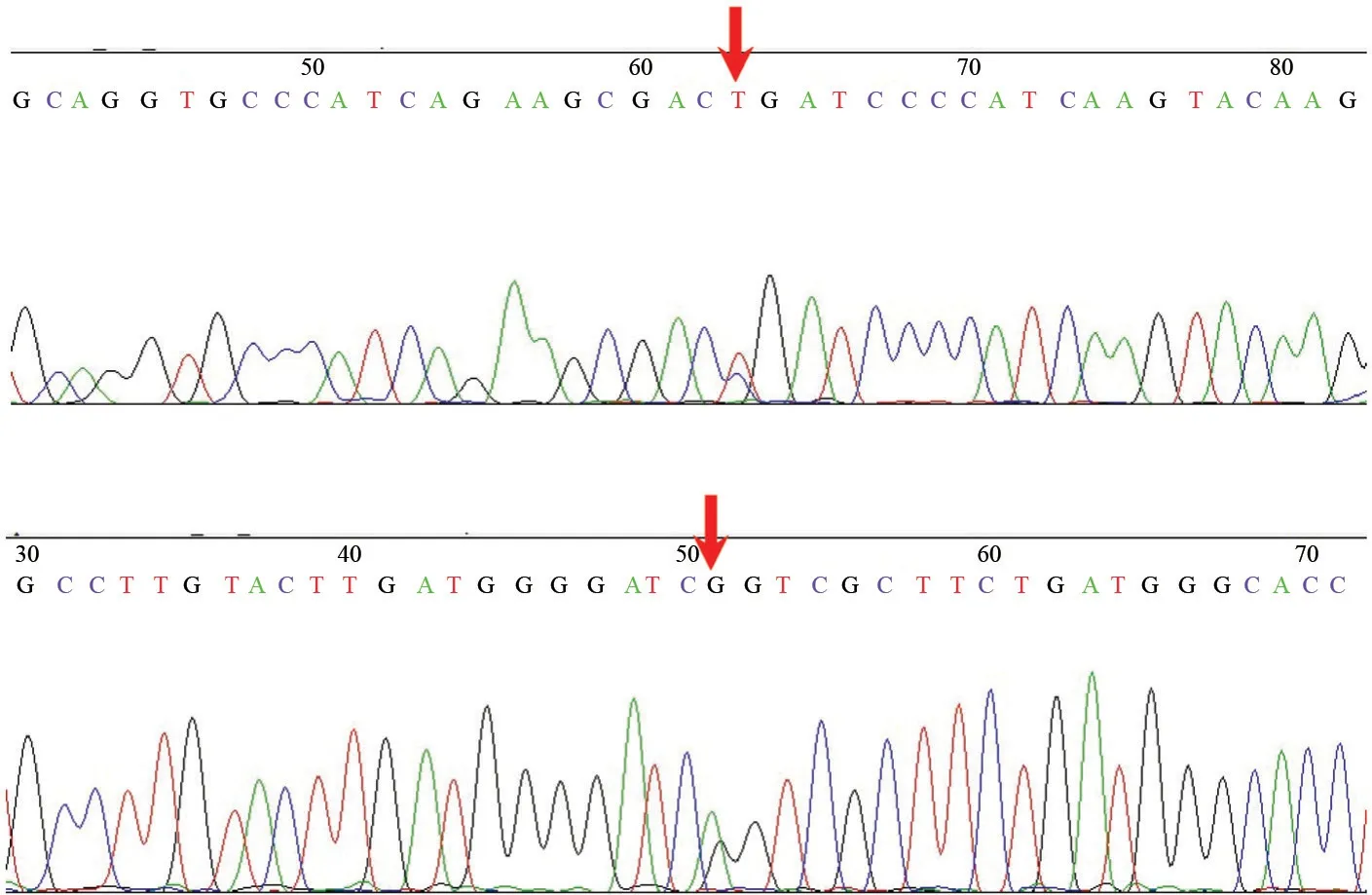
图 3 LPL/WM显示有MYD88 L265P突变Fig. 3 MYD88 L265P mutation in LPL/WM
3 讨 论
LPL/WM是一类较为罕见的非霍奇金淋巴瘤,根据国内一项多中心大样本研究,LPL/WM只占所有淋巴瘤的0.57%[6]。LPL累犯淋巴结通常缺乏特征性形态改变,尽管传统上认为淋巴结结构部分保留是这类肿瘤的形态学特点之一,但近来研究发现淋巴结结构完全毁损者也并不少见,瘤细胞形态方面,LPL/WM主要由肿瘤性小淋巴细胞、浆细胞和浆样淋巴细胞构成,这和其他伴有明显浆细胞样分化的小B细胞类肿瘤(例如MALT型或淋巴结边缘区淋巴瘤、SLL/CLL)非常相似而不易区分[1]。另一方面,LPL/WM又不像滤泡性淋巴瘤、SLL/CLL等其他小B细胞肿瘤那样具有特征性的免疫表型以助确诊与鉴别,不仅如此,部分LPL/WM病例还会像本研究病例那样呈现CD23阳性、CD5阳性乃至CD10阳性的异常表型,从而导致误诊。Remstein等[7]报道了26例LPL,发现仅58%的病例呈典型表型,其余均程度不等地表达CD5、CD10和CD23。此外,相当多的LPL/WM患者起病阶段或整个病程中均无WM表现,对于这一病种的确诊也增加了困难。有趣的是,我们还发现在部分LPL/WM病灶中有散在分布的IgG4阳性浆细胞存在,但此类细胞形态成熟,且无免疫球蛋白轻链限制性,提示为反应性成分。
分子生物学研究新进展为此类肿瘤的确诊和鉴别提供了新的依据,Treon等[4]发现90%的LPL/WM病例染色体3p22.2的38182641位点有MYD88蛋白编码区第265位氨基酸(MYD88 L265P)错义突变,为亮氨酸错变为脯氨酸。同时,MYD88 L265P突变在IgM型意义不明的单克隆免疫球蛋白血症中也较为常见[8]。此外,活化细胞样型弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)、腿型原发性皮肤DLBCL以及原发于乳腺、睾丸和中枢神经系统的DLBCL亦有高频MYD88 L265P突变检 出[9-13]。而在SLL/CLL、边缘区淋巴瘤等其他类型的小B细胞性肿瘤中,MYD88 L265P突变极少被检出[3]。本研究结果显示,10例LPL/WM均有MYD88 L265P突变,而13例对照组小B细胞肿瘤病例均呈阴性结果,这一结果同国外研究结果相符。MYD88 L265P突变对于LPL/WM与其他伴有浆细胞样分化的小B细胞性肿瘤的鉴别以及临床表现、组织学形态或免疫表型不典型的LPL/WM的确诊尤有价值。Hamadeh等[3]分析了87例髓外LPL、脾边缘区淋巴瘤、未定义的脾淋巴瘤、伴有浆细胞分化的淋巴结边缘区淋巴瘤或小淋巴细胞性淋巴瘤的MYD88 L265P突变状态,发现几乎所有的MYD88突变者皆为LPL(包括病理学特征不典型的病例)。
近来有研究表明,MYD88 L265P突变还与LPL/WM的临床表现和患者预后相关,Treon 等[14]发现有MYD88突变往往预示较好预后,而CXCR4突变则与临床高侵袭性相关。此外,MYD88 L265P突变可能在LPL/WM的肿瘤发生、发展中也发挥重要作用。Yang等[15]发现,MYD88突变可以通过激活布鲁顿酪氨酸激酶(新兴小分子药物依鲁替尼的靶点)和IRAK分子,进而激活NF-κB信号通路,从而促进LPL/WM肿瘤细胞的生长。而共同抑制布鲁顿酪氨酸激酶和IRAK后,则导致NF-κB信号通路失活、肿瘤细胞死亡。
我们的研究显示,多数LPL/WM病例仍具有相对典型的临床表现、组织学形态以及免疫表型,但少数病例亦可有CD23+或CD5+等异常免疫表型。MYD88 L265P突变作为此类肿瘤的特征性分子遗传学改变,对于疾病的确诊与鉴别、预测预后乃至指导个体化治疗可能具有重要 意义。

