微囊型脑膜瘤2例临床病理学特征分析并文献复习
冯润林,王 燕
昆明医科大学第二附属医院病理科,云南 昆明 650101
脑膜瘤是由脑膜皮细胞(蛛网膜细胞)构成的肿瘤,发生在硬脑膜内表面,微囊型脑膜瘤是脑膜瘤的罕见亚型,2007年世界卫生组织(World Health Organization,WHO)中枢神经系统肿瘤分类将其列入良性脑膜瘤亚型,定义为Ⅰ级[1]。有文献记载,该肿瘤在颅内所有脑膜瘤中所占的比例约为1.6%[2-3]。为避免漏诊及误诊,现参阅2016年《WHO中枢神经系统肿瘤分类及诊断标准》,回顾分析昆明医科大学第二附属医院所有诊断为脑膜瘤的病例,从中筛选2例微囊型脑膜瘤,查阅相关文献,并对其临床表现、影像学资料、免疫组织化学表型、诊断及鉴别诊断等方面展开分析,以提高对微囊型脑膜瘤的 认识。
1 资料和方法
1.1 临床资料
病例1,男性,40岁,4个月前被铁块砸伤后出现右侧肢体活动不灵,行走右偏,伴右侧肢体麻木酸胀,视物模糊,言语困难,词不达意,偶有头痛。CT示:左侧额顶叶见混杂密度肿块,大小为5.3 cm×5.8 cm×5.0 cm,周围见低密度水肿,中线结构右偏,双侧脑室受压右偏,增强扫描明显强化,邻近骨板骨质破坏,多考虑脑外肿瘤。磁共振成像(magnetic resonance imaging,MRI)示:左侧额部见一巨大类圆形稍长T1稍长T2信号影,周边可见环形长T1长T2信号影,病变与脑膜呈宽基底相连,增强后明显强化并可见脑膜尾征,病变大小为5.75 cm×5.03 cm× 5.23 cm,邻近额骨内板局灶骨质破坏,考虑血管内皮瘤可能。术中于左侧额叶中央前回前方见肿瘤,肿瘤与硬脑膜相连,边界清楚。
病例2,女性,41岁,10 d前无明显诱因出现头痛,为间歇性刺痛,以右前额部为主,无规律,出现在凌晨睡觉时。CT示:右额部见稍高密度肿块影(图1),增强强化明显,右额叶片状低密度水肿带,考虑脑膜瘤,恶性可能。MRI示:右侧额部见一混杂稍长T1稍长T2信号肿块影(图2),边界清,大小为5.04 cm× 4.19 cm×5.47 cm,其内见多发小长T1长T2囊变影,增强后病变呈明显不均匀强化,邻近脑膜增厚并强化,考虑脑外肿瘤,脑膜瘤可能。术中于右侧额叶内侧面见病变,呈灰红色,质韧,病变基底在大脑镰上,侵犯大脑镰。
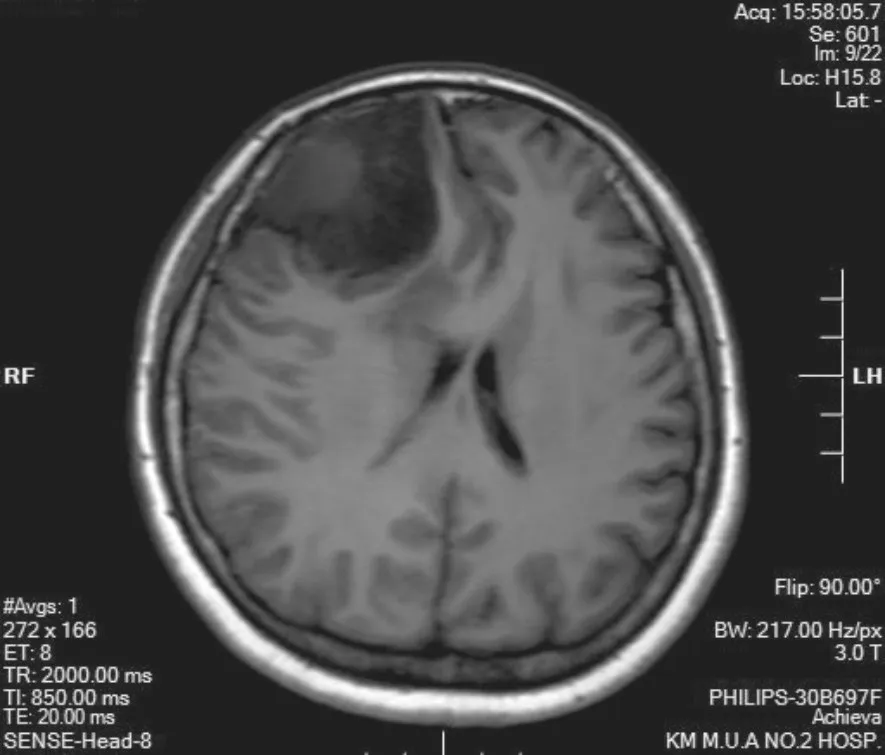
图 1 肿瘤呈现等低信号影,伴囊变影,边界清(病例2:MRI T1平扫)Fig. 1 The tumor exhibited low-signal shadows with cystic change and clear border (case 2: MRI T1 sweep)
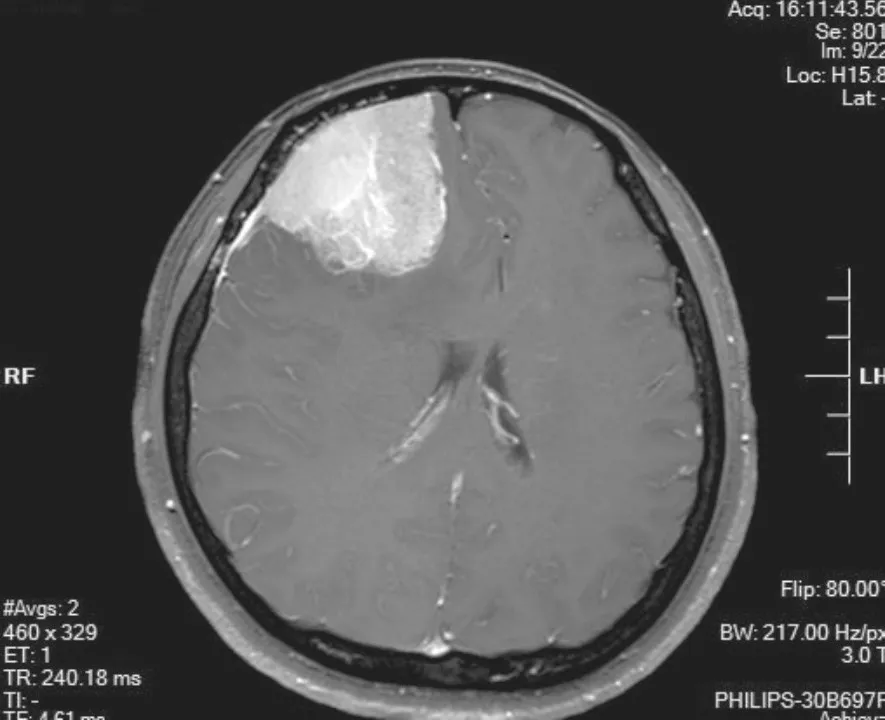
图 2 肿瘤呈现稍高信号影,邻近脑膜增厚并强化(病例2:MRI T1增强)Fig. 2 The tumor showed a slightly higher signal, and the adjacent meninges were thickened and strengthened (case 2: MRI T1 enhancement)
1.2 方法
标本经常规4%的甲醛溶液固定,石蜡包埋,切片厚4 μm,分别进行H-E染色和免疫组织化学分析。免疫组织化学分析采用SP法。使用针对以下分子的抗体,包括胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、S100、上皮膜抗原(epithelial membrane antigen,EMA)、波形蛋白(vimentin)、孕激素受体(progesterone receptor,PR)、CD34、p40、p63、肌酸激酶(creatine kinase,CK)、p53、D2-40、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、CD57、α-抑制素、CD57、Ki-67、表皮生长因子受体(epidermal growth factor receptor,EGFR)和血管内皮生长因子(vascular endothelial growth factor,VEGF),采用二氨基联苯胺(diaminobenzidine,DAB)显色,所有抗体及DAB显色剂均为福建迈新生物技术开发有限公司产品,操作步骤严格按照说明书进行,常规设置阳性及阴性对照。
1.3 特殊染色
过碘酸-雪夫(periodic acid-Schiff,PAS)染色,细胞质红色为阳性结果。
1.4 免疫组织化学结果判读
细胞质或细胞核呈黄棕色,且背景清楚。
2 结 果
2.1 巨检
病例1灰白灰红色带有包膜的质软组织1块,大小为5.5 cm×5.5 cm×4.0 cm,包膜完整,切面灰白灰红、质软,未见出血及坏死。病例2灰红灰褐色似有包膜的包块1个,表面呈分叶状,大小为5.5 cm×5.0 cm×3.8 cm,切面灰白灰红、质细,未见出血及坏死。
2.2 镜检
肿瘤边界清楚,可见纤维包膜包绕肿瘤细胞(图3),肿瘤细胞排列疏松,形成大小不等的微囊,部分区域可见含有少量黏液样物质(图4),间质血管丰富,多为薄壁血管,管壁透明变性及玻璃样变(图5),部分肿瘤细胞呈稀疏漩涡状排列(图6),部分区域肿瘤细胞的细胞质透明,间质明显纤维化(图7)。肿瘤细胞呈卵圆形,细胞质丰富且不规则,有突起,核染色质细腻,有小核仁(图8);部分区域肿瘤细胞呈星芒状或梭形,极似蛛网膜小梁细胞,形成薄而细长的细胞间网状交错(图9)。但未见核分裂像、坏死及脑实质浸润。
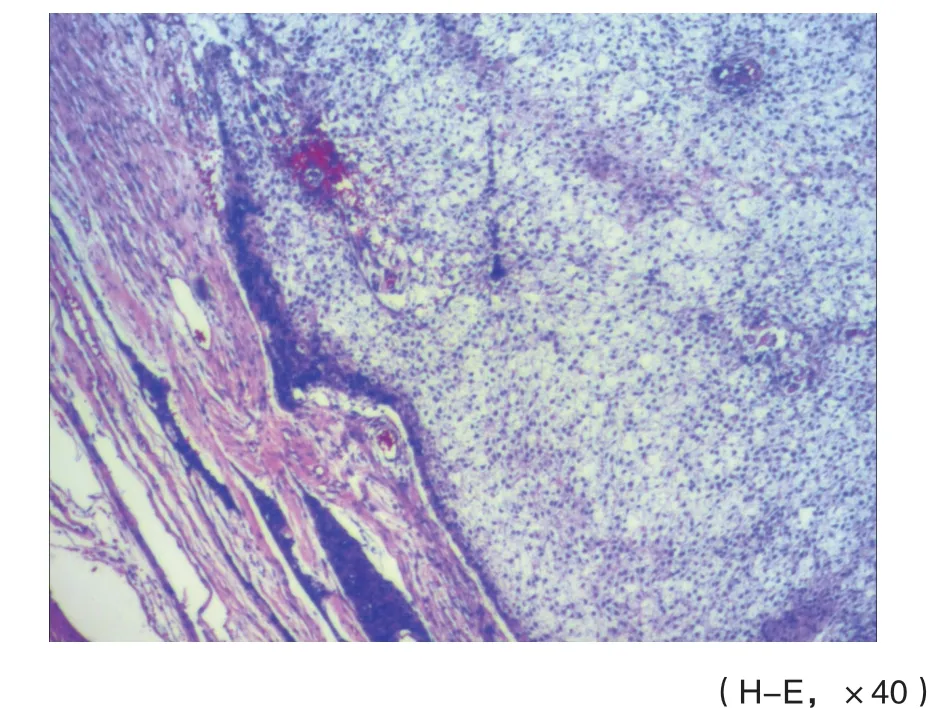
图 3 肿瘤细胞边界清楚,可见纤维包膜包绕瘤细胞(病例2)Fig. 3 The border of tumor was clear, and the f ibrous envelope surrounds the tumor cells (case 2)
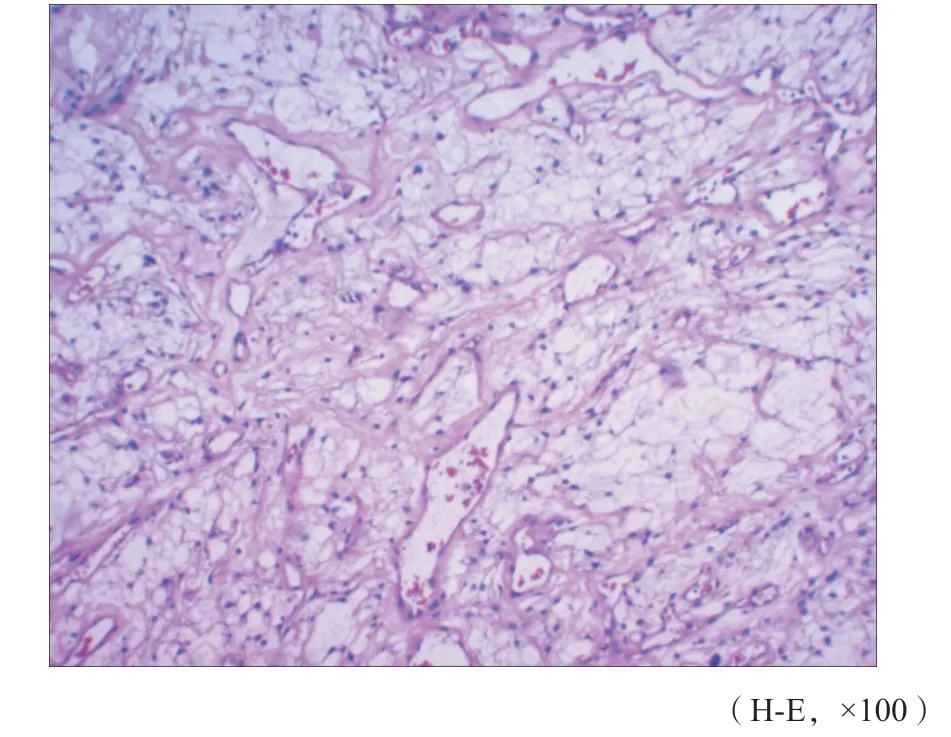
图 4 肿瘤细胞为大小不等的微囊,部分区域可见含有少量黏液样物质(病例1)Fig. 4 Tumor cells were microcapsules of varying sizes, and some areas may contain small amounts of mucus-like substances (case 1)
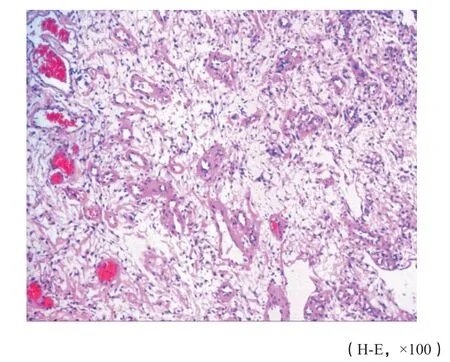
图 5 肿瘤内见薄壁血管,管壁透明变性及玻璃样变(病例1)Fig. 5 Thin-walled blood vessels in the tumor, hyaline degeneration and glass-like changes in the wall (case 1)
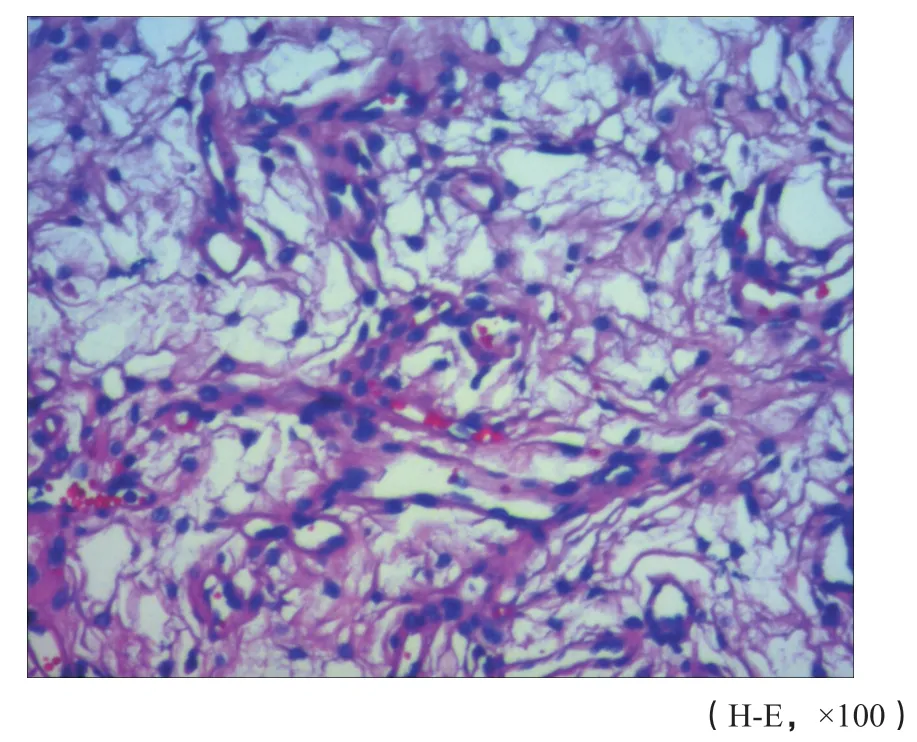
图 6 肿瘤细胞呈稀疏的漩涡状结构(病例2)Fig. 6 Tumor cells from sparsely swirling structures (case 2)

图 7 肿瘤细胞的细胞质透明,间质明显纤维化(病例1)Fig. 7 Tumor cell cytoplasm was transparent and interstitial f ibrosis is evident (case 1)
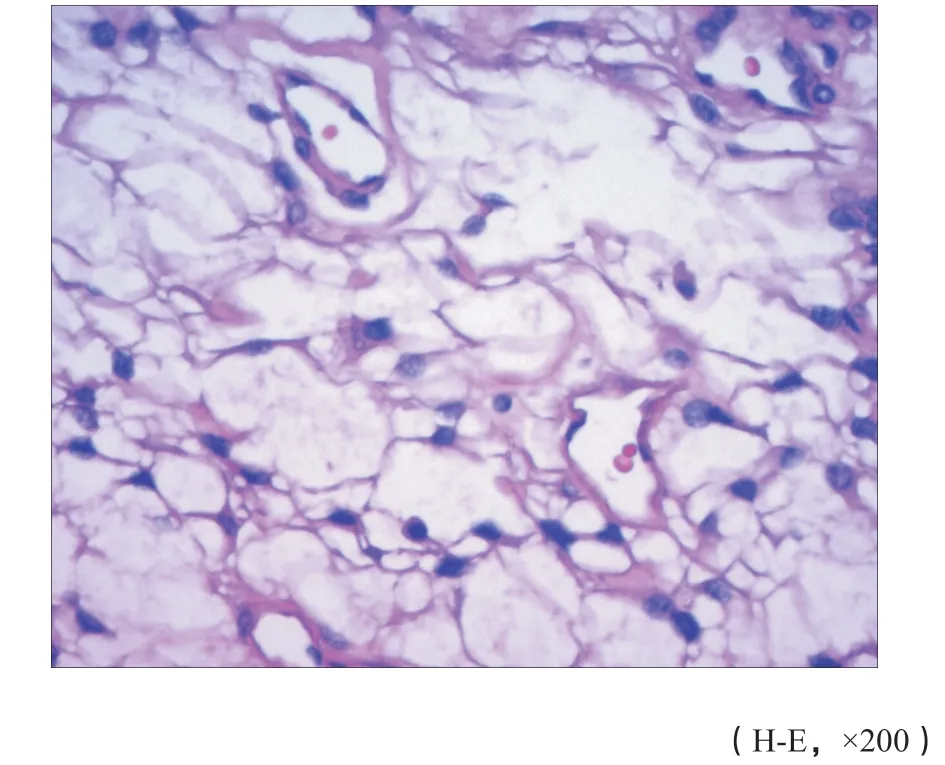
图 8 肿瘤细胞卵圆形,细胞质丰富且不规则,有突起,核染色质细腻,有小核仁(病例1)Fig. 8 Tumor cells were oval, cytoplasm was rich and irregular evident with protrusions, and f ine nuclear chromatin and small nucleoli (case 1)
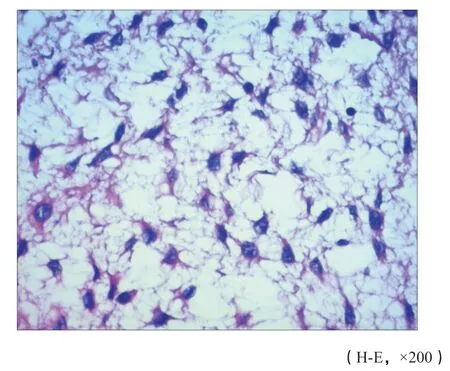
图 9 肿瘤细胞呈星芒状或梭形,极似蛛网膜小梁细胞(病例2)Fig. 9 Tumor cells were star-shaped or fusiform, much like arachnoid trabecular cells (case 2)
2.3 免疫组织化学
病例1:vimentin(图10)、EMA(图11)、PR(图12)、D2-40、CD56、VEGF和EGFR均(+),α-inhibin、NSE、CK-pan、S-100、GFAP和PAS均(-),CD34(血管+),Ki-67阳性率达3%。病例2:EMA、PR和vimentin均(+),CD34(血管+),GFAP、S-100、CK、p40、p63、CK和p53均(-),Ki-67阳性率达5%。
2.4 特殊染色
2例肿瘤中,1例肿瘤细胞的细胞质内见PAS阳性着色。
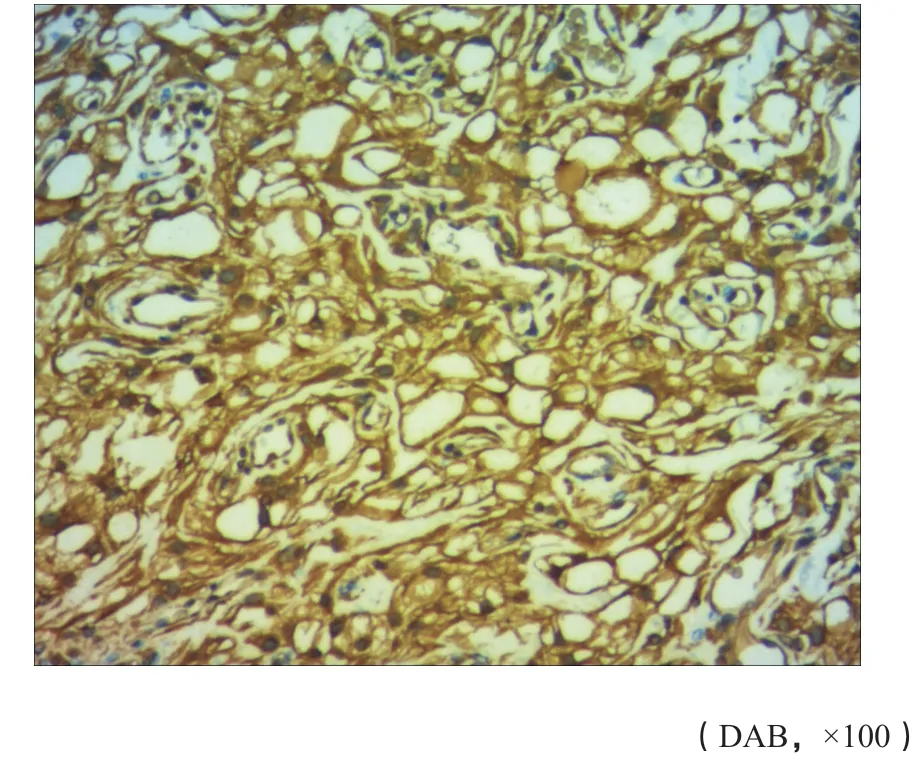
图 10 免疫组织化学(SP法)检测vimentin示肿瘤细胞的细胞质阳性(病例1)Fig. 10 Immunohistochemical (SP method) staining for vimentin showed tumor cell cytoplasm positive (case 1)
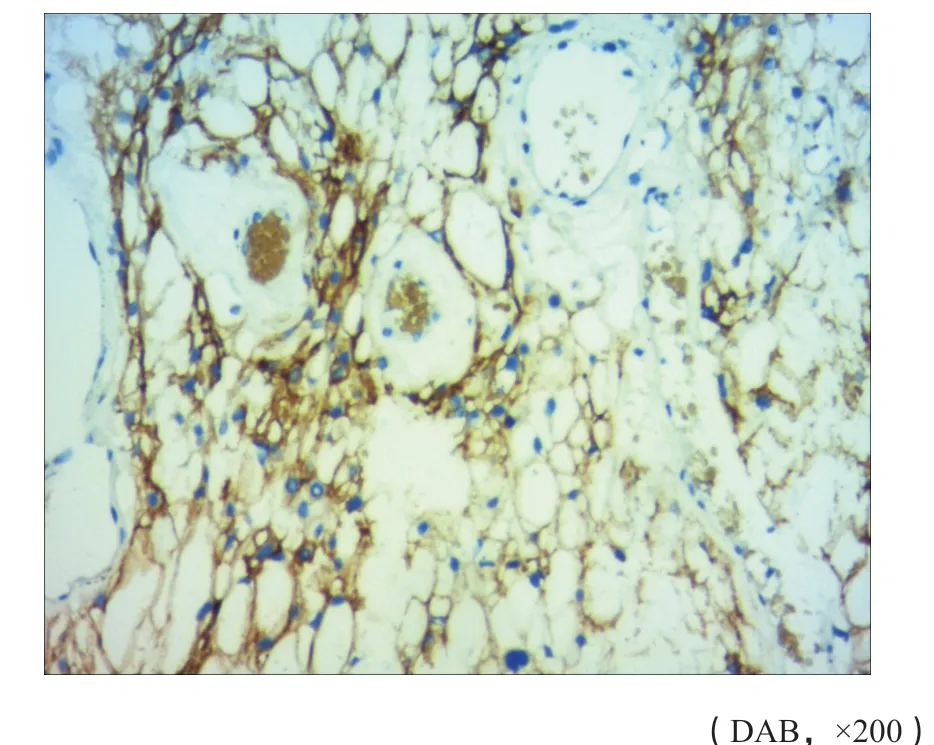
图 11 免疫组织化学(SP法)检测EMA示肿瘤细胞的细胞质阳性(病例1)Fig. 11 Immunohistochemical (SP method) staining for EMA showed tumor cell cytoplasm positive (case 1)
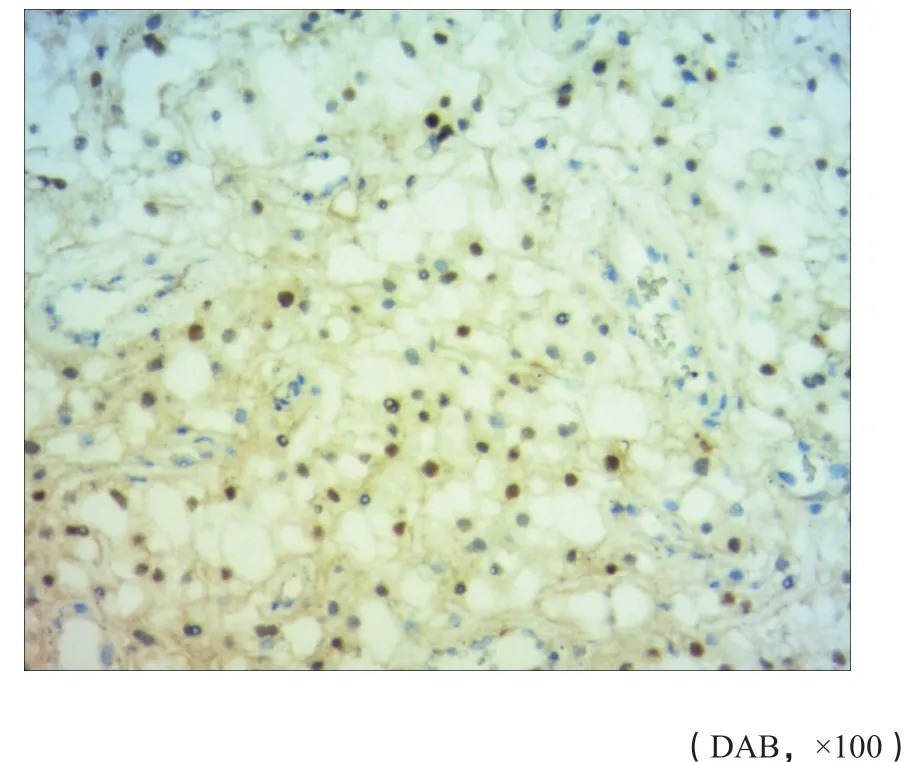
图 12 免疫组织化学(SP法)检测PR示肿瘤细胞的细胞核阳性(病例1)Fig. 12 Immunohistochemical (SP method) staining for PR showed tumor cell nucleus positive (case 1)
2.5 病理诊断
2例均诊断为微囊型脑膜瘤,WHO Ⅰ级。
2.6 随访
2例均进行随访,随访时间为5~6个月,截至2018年1月,2例患者一般情况良好,均未见肿瘤 复发。
3 讨 论
微囊型脑膜瘤又称湿性脑膜瘤或空泡状脑膜瘤,系肉眼见不到囊腔的一类脑膜瘤,是脑膜瘤中一种极为少见的亚型,在2007年WHO中枢神经系统肿瘤分类中,根据脑膜瘤复发和分级分组表将其归为WHO Ⅰ级。微囊性脑膜瘤起源于脑膜帽状细胞,对于微囊的形成机制目前尚不明确,可能原因包括肿瘤的变性、蛋白液渗出和蛛网膜下隙结构的再现[4]。男女发病各个文献报道不尽相同,部分文献记载男性发病多于女 性[5],部分文献记载男女发病无差异[6]。肿瘤的发病年龄与经典型脑膜瘤无明显差异,各个年龄段均可发病[7-8]。肿瘤生长缓慢,常出现压迫周围神经,常出现头痛、头晕、呕吐及肢体功能障碍等肿瘤压迫症状,临床表现与肿瘤发生部位及肿瘤大小密切相关。本组2例患者,男女各1例,男性患者因脑出血就诊;女性患者因头痛就诊,病变均位于额部,与文献报道基本一致。微囊型脑膜瘤在CT上主要表现为低密度,在MRI的T1WI表现低信号,T2WI表现高信号,伴有不同程度的脑水肿[9],且边缘强化更具有特 异性[10]。
肿瘤边界清楚,可见纤维包膜包绕瘤体组织,切面灰白,质韧,部分呈分叶状,一般见不到出血及坏死,更见不到微囊形成。镜下肿瘤细胞排列疏松,形成大小不等的微囊,大囊腔系小囊腔融合而来,微囊位于细胞外,腔内含粉染之浆液,内表面未见细胞被复囊,但不含黏液、糖原和脂肪,肿瘤细胞具有空泡状细胞质和细长的细胞质突起,常缺乏典型脑膜瘤的特征,亦无漩涡结构及砂粒体。但也有部分研究提示,微囊型脑膜瘤细胞呈稀疏漩涡状排列[11]。间质血管丰富,多为薄壁血管,管壁透明变性,但无内皮或外皮细胞增生。部分区域可见含有少量PAS阳性的黏液样的液体,这些液体可能是血浆透过肿瘤所特有的丰富且常出现玻璃样变的间质血管漏出来的。肿瘤细胞边界不清,多分为两种形态:一种为卵圆形细胞,较小,细胞质丰富且不规则,有突起,核染色质细腻,有小核仁;另一种为多形性细胞,细胞大,三角形或胖梭形,胞突明显,核染色质浓染,可见1~2个核仁及核内假包涵体,核浆比较经典脑膜瘤小,虽然细胞具有异型性,但核分裂罕见,即使出现也不能作为判断预后不良的的指征。
免疫组织化学分析对微囊型脑膜瘤的诊断具有重要参考意义,肿瘤细胞EMA、vimentin和PR呈弥漫强阳性表现,S100、CK、GFAP和核因子(nuclear factor,NF)一般为阴性,但也有文献记载,S-100和NSE可以强阳性表达[12],Ki-67增殖指数不一,多为1%~5%[13]。本组2例病例,免疫组织化学标记情况与文献报道相一致。
微囊型脑膜瘤的超微结构图像显示,微囊位于相互分隔的细胞突之间,囊内可见胶原纤维丝束结构和蛋白性颗粒。细胞间有桥粒连接,有研究表明,肿瘤内大量微囊不是位于细胞内的空泡,而是位于相互交织的瘤细胞突起之间[14]。李玉等[15]研究发现,电子显微镜对微囊型脑膜瘤诊断和鉴别诊断较准确。
微囊型脑膜瘤形态学与以下肿瘤具有重叠性,故需要鉴别:
① 透明细胞型脑膜瘤:因肿瘤细胞含有空泡状细胞质,易误诊为透明细胞型脑膜瘤,该类型脑膜瘤细胞多角形,细胞质透明,富含糖原,在血管周及间质中有数量不均的胶原蛋白及淋巴细胞,肿瘤组织内可见大量飘带样的胶原间质,PAS染色阳性有助于诊断。② 转移性肾透明细胞癌:病变呈囊性或囊实性,可见明显出血及坏死,间质内小血管增生,当出现肾小球样血管增生时对转移性癌诊断有意义,免疫组织化学碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ,CAⅨ)、CK、EMA及CD10强阳性表达,而PR阳性表达。③ 血管母细胞瘤:好发于成人小脑及脑干,生长缓慢,富含血管,组织学由间质细胞及小血管构成,可通过网织纤维染色勾勒,因细胞质内可见大量含有脂质的小泡,导致其特征性的“透明细胞”改变,免疫组织化学标记间质细胞vimentin、NSE、EGFR及转化生长因子-α(transforming growth factor-alpha,TGF-α)强阳性,EMA、CK及CD34阴性。④ 少突胶质细胞瘤:大多数好发于成人,高峰为40~45岁,多见于大脑半球实质区域,肿瘤细胞核圆,细胞质透明,类似CCM,但此细胞稍大,细胞质丰富,偏位,部分伴有黏液变性,类似印戒细胞,此外,可见典型的致密鸡爪样分支血管网,免疫组织化学标记GFAP、S100、CD57、抗-Leu7及OLIG-2强阳性。⑤ 纤维型星形细胞瘤:有微囊形成,微囊内含黏液,细胞核浓染,不规则状,免疫组织化学GFAP、S100阳性有助于鉴别[16]。
微囊型脑膜瘤是一种特殊亚型的脑膜瘤,临床上多以良性为主,目前,对于微囊型脑膜瘤治疗首选肿瘤完整切除术。一般预后较好,但Honda等[17]报道1例微囊型脑膜瘤患者,4个月后肿瘤复发,侵入鼻窦。因此,笔者认为微囊型脑膜瘤具有潜在的侵袭性,术后应严密随访观察,因该肿瘤报道甚少,还需在今后的工作中进一步累积病例,不断总结。

