CBP棕榈酰化位点的突变对皮肤鳞状细胞癌A431细胞生物学行为的影响
高 潇,王 冰,姚 佳,朱玉贞,王 静
青岛大学医学部基础医学院免疫学系,山东 青岛 266000
Src羧基末端激酶结合蛋白(Csk-binding protein,CBP)也被称为富含鞘磷脂的脂膜微区结合酪氨酸磷酸化蛋白(phosphoprotein associated with glycosphingolipid-enriched microdomains,PAG),是新近发现的通过棕榈酰化修饰靶向脂筏的抑制性跨膜接头蛋白。CBP在细胞质上的脂质修饰是棕榈酰化[1]。这种棕榈酰化修饰将CBP锚定在脂筏上,位于脂筏上的CBP通过促进Src的失活发挥Src介导的抑制肿瘤进展的功能。CBP的表达在Src转化的细胞和各种人癌细胞中下调,表明CBP作为肿瘤抑制剂的潜在作用。有研究表明CBP与许多细胞过程和恶性条件相关联[2-5],棕榈酰化位点突变后的CBP将不能定位到脂筏上。因而作为Src家族激酶(Src-family kinases,SFK)重要调节因子的CBP在细胞内表现出的不同的调节机制,其前提可能是棕榈酰化修饰后使CBP锚定脂筏上。虽然CBP在肿瘤中的作用已经引起了很多关注,然而,皮肤鳞状细胞癌中CBP棕榈酰化位点突变对皮肤鳞状细胞癌的生物学效应仍然未知。本实验拟将CBP棕榈酰化位点突变,探究棕榈酰化位点突变对CBP在A431细胞中发挥生物学效应的影响,为肿瘤靶向治疗提供新的靶点。
1 材料和方法
1.1 主要材料和试剂
人皮肤鳞状细胞癌A431细胞系购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,WT CBP-EGFP、Mutant CBP-EGFP以及阴性对照的慢病毒融合蛋白表达载体由上海吉凯基因化学技术有限公司构建。DMED培养基购自美国Hyclone公司,血清、青霉素/链霉素双抗、0.25%胰蛋白酶均购自美国Gibco公司,transwell小室(8.0 μm孔径PC膜)购自美国Corning公司,Matrigel基质胶购自美国BD公司,CCK-8试剂购自美国Sigma公司,CBP、Fyn、Csk兔抗人单克隆抗体购自美国CST公司,荧光标记的羊抗兔IgG二抗购自美国Invitrogen公司,流式细胞仪购自美国BD公司,显影仪购自德国LI-COR Biosciences Odyssey CLx公司。
1.2 实验方法
1.2.1 细胞培养
A431细胞系培养于DMEM完全培养基内(含10%胎牛血清、100 mg/L青霉素和100 mg/L链霉素),置于37 ℃、CO2体积分数为5%及饱和湿度的细胞温育箱中培养。
1.2.2 病毒转染、检测及稳定株建立
将处于对数生长期的A431细胞接种至6孔板,当细胞生长密度达到60%~70%,根据慢病毒使用说明书推荐的病毒感染细胞所用培养基体积和病毒量,将阴性对照组、阳性对照组及实验组病毒液分别加入无双抗的培养基稀释,再分别加入终浓度为8 μg/mL 聚凝胺(polybrene),使6孔板终体积为2.5 mL,混匀后在37 ℃、CO2体积分数为5%的细胞培养箱培养;转染10~12 h后观察细胞状态,同时采集同视野3组细胞在激光共聚焦显微镜下的荧光情况,并更换完全培养基培养,用分选流式细胞仪检测72 h后慢病毒转染A431后荧光的表达情况,并做分选。筛选稳定转染仅含EGFP阴性对照病毒的A431细胞记为阴性对照组(Control组),将稳定转染WT-CBP的A431细胞记为阳性(过表达)对照组(WTCBP组),将稳定转染棕榈酰化位点突变的CBPEGFP病毒的A431细胞记为实验组(Mutant-CBP组)。空白对照组为未进行基因转染的A431细胞(Parental组)。
1.2.3 实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测转染后细胞中CBP的mRNA表达
TRIzol提取细胞总RNA。SYBR Green标记产物,按照RTFQ-PCR检测试剂盒操作说明,建立反应体系。CBP基因上游引物为5’-TCAGCCTGAGAGGAGGAAAT-3’,下游引物为5’-GCTCCTGCTACTTGGG AGTC-3’;GAPDH基因上游引物为5’-GATGA CCTTGCCCACAGCCT-3’,下游引物为5’-ATCTCTGCCCCCTCTGCTGA-3’。反应条件:95 ℃ 10 min,95 ℃ 10 s、60 ℃ 20 s、 72 ℃ 10 s,40个循环。各样品目的基因和管家基因进行RTFQ-PCR反应,分别获得Ct值,通过2-△△Ct方法分析各样品相对CBP表达水平差异,每组实验重复3次。各组实验以Parental组的表达量设定为1,计算出其他组的相对表达量,以相对倍数进行作图。
1.2.4 蛋白质印迹法(Western blot)检测转染后细胞中CBP蛋白水平
收取上述处理后细胞提取和纯化细胞总蛋白,用蛋白质定量(bicinchoninic acid,BCA法)测定蛋白浓度,计算上样。取20 mL蛋白行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿转聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜后,5%脱脂奶粉封闭1 h,加入一抗 4 ℃温育过夜,洗膜缓冲液(TRIS-buffered saline tween,TBST)漂洗3次,每次5 min,加入相应浓度的二抗稀释液,室温2 h,采用TBST缓冲液漂洗5次,每次5 min,暗室下显影。
1.2.5 细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8)检测细胞增殖
将处于对数生长期的4组细胞,调整细胞密度为1×105个/孔,分别接种于96孔板,以上各组均设立1个调零孔和4个平行复孔。在37 ℃、CO2体积分数为5%的细胞培养箱中培养24 h后分别在0、24、48、72、96和120 h(即第1、2、3、4、5和6天)6个时间点检测细胞增殖情况,每孔加入10 μL CCK-8试剂,继续培养2 h,在多功能酶标仪上检测450 nm波长处的吸光度(D值)。以D值为纵坐标,时间为横坐标绘制生长曲线。上述操作重复3次。
1.2.6 流式细胞术(f low cytometry,FCM)检测细胞凋亡
加入不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的0.25%胰蛋白酶消化收集处于对数生长期的4种细胞制备单细胞悬液,冷磷酸盐缓冲溶液(phosphate-buffered saline,PBS)、1×结合缓冲液各洗涤细胞1次,再用 100 μL 1×结合缓冲液重悬细胞,调整细胞浓度为1×106个/mL。取1 mL细胞悬液加入5 μL Annexin Ⅴ-APC室温避光反应15 min,2 300×g离心30 s,弃上清液,用500 μL 1×结合缓冲液重悬细胞,再加5 μL碘化丙啶(propidium iodide,PI)用400目的筛网过滤后,采用流式细胞术检测,上述实验重复3次。
1.2.7 划痕修复实验
分别收集处于对数生长期的4组细胞,以1×106个/孔接种于6孔板,每组细胞设置3个复孔。置于37 ℃、CO2体积分数为5%的培养箱中培养至细胞融合度约为95%,用200 μL无菌微量移液头在6孔板内垂直孔板在单层细胞上划痕,尽量保持每孔划出的细胞“伤口”宽度相同。加入无血清DMEM培养基,在37 ℃、CO2体积分数为5%的细胞培养箱培养,分别在0、24 h观察划痕愈合的情况并拍照,计算伤口愈合率(观察点划痕宽度/起始点划痕宽度),以反映各组细胞迁移能力。实验重复3次。
1.2.8 Transwell 迁移实验
收集处于对数生长期的4组细胞,调整细胞浓度为2×105个/mL,transwell小室上室分别加入各组细胞的单细胞悬液200 μL,小室内的细胞是重悬在无血清的培养基中,将小室置于24孔板,并在下室加入650 μL含10%胎牛血清的DMEM完全培养液,置于37 ℃、CO2体积分数为5%细胞培养箱培养12 h。取出小室,吸出小室中培养基,小心擦去上层细胞,PBS洗2次,倒置晾干,用甲醇于4 ℃固定30 min,再用0.1%结晶紫染色 20 min,染色后用1×PBS冲洗,并用棉签轻轻擦去微孔膜上层的细胞。在倒置光学显微镜下观察共计数中央和四周各5个视野(×400),取平均值。重复3次实验。
1.2.9 Transwell侵袭实验
将Matrigel基质胶4 ℃过夜融化,transwell小室及所用的微量移液头均置于4 ℃预冷。用无血清的DMEM培养液将其1∶8稀释混匀。100 μL包被transwell小室聚碳酸脂膜上室面,37 ℃过夜温育凝固备用。整个操作过程在冰上及无菌条件下进行。调整细胞浓度为1×106个/mL,加入小室后继续温育24 h,其他实验步骤同迁移实验。重复3次实验。
1.2.10 Western blot检测细胞中相关蛋白水平 变化
收取上述处理后细胞提取和纯化细胞总蛋白,重复上述1.2.4的操作。此时一抗用Csk(1∶1 000)、Fyn(1∶1 000)蛋白特异性单克隆抗体。重复3次实验。
1.3 统计学处理
2 结 果
2.1 稳定表达EGFP细胞株的鉴定
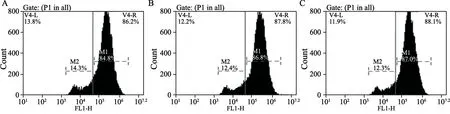
图 1 流式细胞术检测慢病毒转染的各组细胞的荧光率Fig. 1 Transfection efficiency detected by f low cytometry
根据预实验转染慢病毒96 h后,在荧光显微镜下观察荧光情况,采用流式细胞术检测转染率及光镜下细胞的状态,确定感染复数(multiplicity of infection,MOI)为100时为慢病毒转染A431细胞最佳浓度滴度。MOI=100转染A431细胞96h后,用流式细胞术检测反转录病毒感染A431细胞效率(图1),Control组、WT-CBP组以及Mutant-CBP组流式细胞术检测转染率分别为86.2%、88.1%及87.8%,转染后RTFQ-PCR检测WT-CBP组和Mutant-CBP组中CBP基因mRNA的表达量分别约为Parental组的1.65和1.68倍(图2)。Western blot进一步证明WT-CBP组和Mutant-CBP组转染后CBP蛋白的表达量(0.89±0.03, 0.92±0.02)相比Parental组(0.41±0.04)和Control组(0.41±0.03)明显增加,证明转染成功,WT-CBP组和Mutant-CBP组中的CBP稳定过表达(图3)。
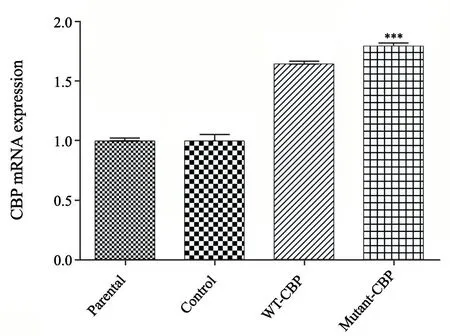
图 2 RTFQ-PCR分析转染后CBP mRNA的表达Fig. 2 Expression level of CBP assayed by RTFQ-PCR after transfection
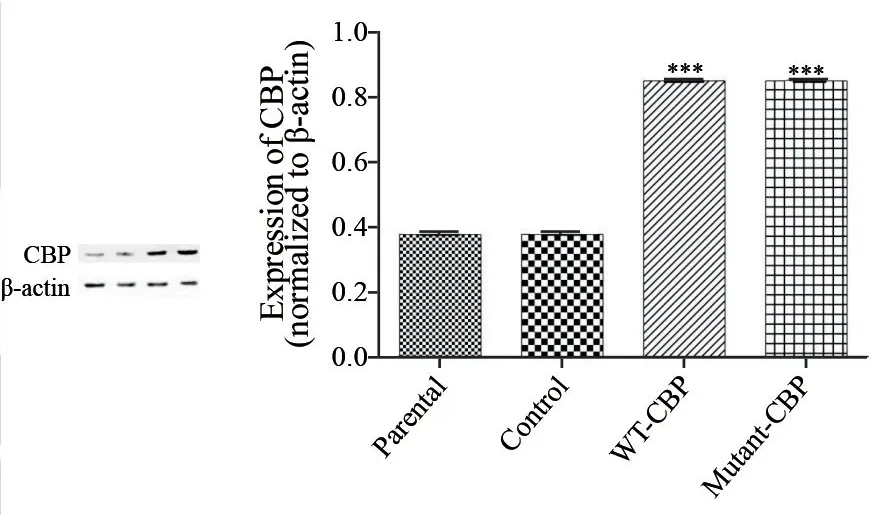
图 3 Western blot检测转染后CBP蛋白的水平Fig. 3 Expression of CBP protein after transfection measured by Western blot
2.2 棕榈酰化位点突变的CBP失去了CBP对A431细胞增殖的抑制能力
CCK-8实验对4组细胞生长情况进行检测,结果显示,WT-CBP组与Parental组和Control组相比,野生型CBP的过表达明显抑制细胞的增殖(P<0.05),而过表达棕榈酰化位点突变的Mutant-CBP组与WT-CBP组相比,过表达棕榈酰化位点突变的CBP失去了抑制细胞生长的能力,在2~6 d组间差异有统计学意义(P<0.05,图4)。这提示CBP过表达明显抑制A431细胞的生长效率,而CBP棕榈酰化位点突变使其对细胞增殖抑制的作用明显减弱,甚至丧失。
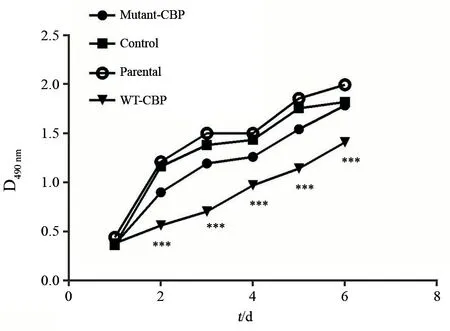
图 4 CBP棕榈酰化位点突变对细胞增殖能力的影响Fig. 4 The effect of mutant-CBP on proliferation ability of human cSCC cell line A431
2.3 棕榈酰化位点突变的CBP丧失诱导细胞凋亡的生物学功能
采用Annexin V凋亡检测试剂盒进行APC 染色,流式细胞术检测的散点图分析结果显示,Control组和Parental组分别为(14.40±0.96)% 和(14.60±0.40)%;WT-CBP组细胞发生中晚期凋亡坏死的细胞为(31.40±1.45)%,分别与Control组和Parental组比较差异均有统计学意义 (P<0.001,图5)。Mutant-CBP组细胞发生中晚期凋亡坏死的细胞为(16.50±0.74)%,与WT-CBP组比较凋亡率减少,差异有统计学意义 (P<0.05),说明CBP过表达可以诱导A431细胞发生凋亡,而棕榈酰化位点突变的CBP诱导细胞凋亡的能力明显减弱,也就是说棕榈酰化位点突变的CBP丧失了发挥诱导细胞凋亡的生物学 功能。
2.4 棕榈酰化位点突变的CBP丧失了CBP对伤口愈合的抑制能力
划痕修复实验结果显示:划痕24 h后,各组细胞均有一定程度的愈合,其中WT-CBP组(70.36±4.61)与Control组(173.74±5.26)和Parental组(197.81±6.51)相比,划痕愈合率明显降低,差异有统计学意义(P<0.001);Mutant-CBP组(157.34±3.26)与WT-CBP组相比,划痕愈合率明显增加,差异有统计学意义(P<0.05,图6)。
2.5 棕榈酰化位点突变的CBP丧失了CBP对细胞迁移和侵袭的抑制能力
Transwell迁移实验结果显示:Mutant-CBP组穿孔细胞数量为164.00±2.46,WT-CBP组细胞穿孔细胞数目为56.00±2.09,Control组细胞穿孔细胞数目为176.00±2.23,Parental组穿孔细胞数目为180.00±2.34,与划痕实验结果一致, WTCBP组与Control组和Parental组相比,细胞迁移数量明显减少(P<0.001),而Mutant-CBP组细胞迁移数量与WT-CBP组相比明显增多(图7)。这表明CBP的过表达明显抑制了A431细胞的迁移能力,但棕榈酰化位点突变的CBP对A431细胞迁移能力的影响明显减弱甚至丧失。
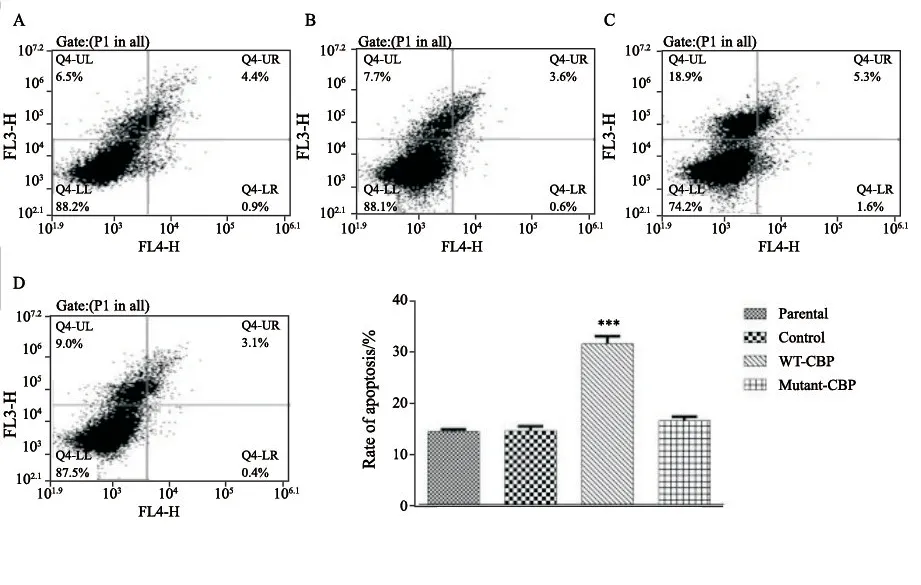
图 5 流式细胞术检测CBP棕榈酰化位点突变对细胞凋亡能力的影响Fig. 5 The effect of mutant-CBP on apoptosis ability of human cSCC cell line A431 by f low cytometry
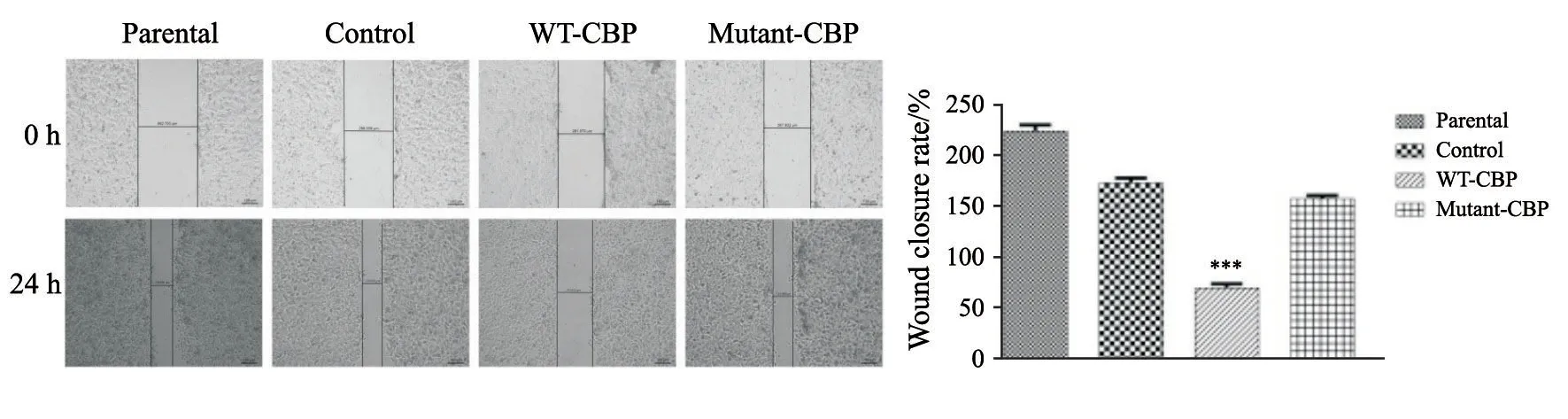
图 6 划痕修复实验检测棕榈酰化位点突变的CBP对A431细胞迁移能力的影响Fig. 6 Effect of mutant-CBP on migration ability of cSCC cell line A431 detected by wound-healing assay
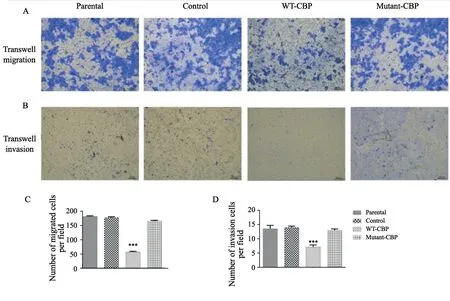
图 7 Transwell侵袭和迁移实验检测过表达棕榈酰化位点突变的CBP对A431细胞迁移和侵袭能力的影响Fig. 7 Effect of mutant-CBP on migration and invasion ability of A431 detected by transwell assay
Transwell侵袭实验结果表明,WT-CBP组细胞侵袭实验穿孔细胞数目(7.07±0.72)与Control组和Parental组(13.85±0.48,13.42±1.19)相比减少(P<0.001),Mutant-CBP组细胞侵袭穿孔数目(12.89±0.48)与WTCBP组相比明显增多,而与Control组和Parental组相比差异无统计学意义(P>0.05,图7)。这表明CBP的过表达明显抑制了A431细胞的侵袭能力,但棕榈酰化位点突变的CBP对A431细胞侵袭的抑制能力减弱,甚至丧失。
2.6 棕榈酰化位点突变的CBP细胞中CBP不再通过Csk、Fyn调节细胞的增殖
Western blot检测细胞中Csk和Fyn蛋白表达水平(图8)。有研究表明CBP通过调节上游信号转导通路中的蛋白酪氨酸激酶Csk、Fyn来调节细胞的增殖活性[6]。本研究结果显示,与Parental组(1.31±0.06, 1.13±0.07)和Control组(0.95±0.04, 1.39±0.07)相比,WT-CBP组Csk和Fyn蛋白相对表达水平(2.37±0.08, 2.37±0.06)明显增多(P<0.001),而Mutant-CBP组Csk和Fyn相对表达水平(1.48±0.07, 1.09±0.05)与WT-CBP组相比明显减少(P <0.05)。上述结果表明伴随外源性野生型CBP的过表达,A431细胞可以活化更多的Csk招募CBP到脂筏上,参与调节Fyn的活化来调控细胞的活性,与之前的报道一致。而在高表达棕榈酰化位点突变的CBP的A431细胞中,棕榈酰化位点突变的CBP不会影响Src相关蛋白Csk和Fyn的表达 水平。
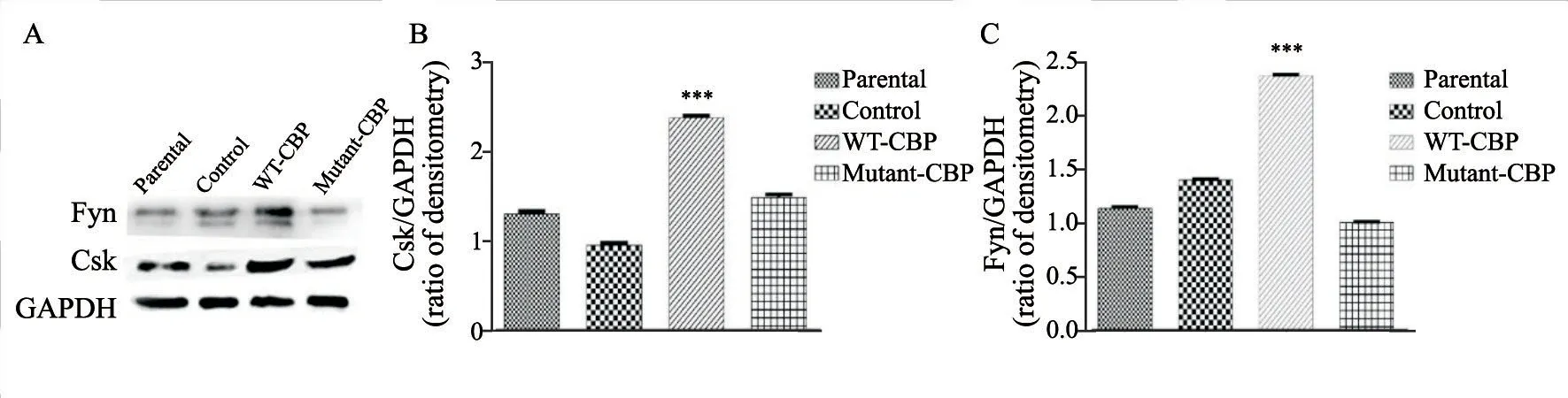
图 8 Western blot检测棕榈酰化位点突变的CBP在A431细胞中过表达对蛋白酪氨酸激酶Csk和Fyn表达水平的影响Fig. 8 The inf luence of mutant-CBP on the activation of Fyn and Csk detected by Western blot
3 讨 论
脂筏(1ipid raft)是细胞膜微结构域,在细胞膜上呈岛状分布,如漂浮的木筏,因此被称为脂筏。脂筏可动态性和选择性地聚集多种蛋白质,使膜蛋白区域化进而使膜功能区域化。定位于脂筏上的接头蛋白,它们共同含有一个将其定位于脂筏上的模体[C-X-X-C,C=半胱氨酸(Cys),X=任意氨基酸]。Cys被棕榈酰化后,接头分子被锚定于脂筏上。CBP在细胞质上的脂质修饰是棕榈酰化[1,7-8],这种棕榈酰化修饰在细胞信号转导和肿瘤的发生、发展中都起着重要的作用[9]。且有研究表明棕榈酰化位点突变后的CBP将不能定位到脂筏上[10]。
CBP是短胞外域和一个较长的胞质域构成的参与信号转导调节的跨膜衔接蛋白[11]。CBP的胞质结构域含有棕榈酰化位点,使 CBP定位于富含胆固醇的膜微域,是参与信号转导调节的接头蛋白。位于脂筏上的CBP被SFK磷酸化后,CBP通过特定位点(人类中的Tyr-317)与C末端Src激酶(一种SFK的负调节剂)相关联并使其与膜相关的SFK接近。然后Csk磷酸化SFK的C端负调节酪氨酸残基,抑制它们的活化。SFKs是与膜相关的非受体蛋白酪氨酸激酶,在调节包括增殖、分化、黏附、迁移和存活在内的各种细胞过程中发挥关键作用。因此,Csk具有肿瘤抑制活性,并且研究表明其表达减少可以促进由c-Src促进的恶性细胞行为[12]。Csk是细胞质蛋白[13],需要适当的膜衔接蛋白以使其结合锚定在膜上的c-Src。有研究已经表明,发挥这种作用的蛋白质为CBP,也称为PAG[7],作为Csk的特定膜适配器[11]。CBP通过棕榈酰化修饰定位于脂筏中,并通过将Csk募集到SFK积累的脂筏中参与调节Src家族激酶(SFK)的活性[14-15]。同时Fyn和Csk是与CBP相互作用蛋白中表现最好的两种 蛋白[16]。
为了探讨CBP棕榈酰化位点突变对皮肤鳞状细胞癌正常生物学行为的影响,本实验将构建有CBP棕榈酰化位点中的半胱氨酸突变为丙氨酸(C-X-X-C变为A-X-X-A)的载体转染进入A431细胞中,并用稳定过表达棕榈酰化位点正常(C-X-X-C)的野生型CBP的A431细胞作为对照,结果提示CBP的棕榈酰化位点对CBP在控制皮肤鳞状细胞癌A431细胞系恶性潜能方面的重要作用。但CBP膜近侧的Cys被Ala替换后,棕榈酰化位点突变,过表达棕榈酰化位点突变的CBP并不呈现过表达CBP的生物功能,两者差异有统计学意义。这提示棕榈酰化位点突变的CBP影响了CBP在A431中发挥正常的细胞生物学功能,同时Western blot检测结果显示棕榈酰化位点突变的CBP对Src家族激酶活性也没有出现明显的影响。说明棕榈酰化位点突变的CBP丧失了CBP通过促进Src的失活发挥Src介导的抑制肿瘤进展的生物学功能。
本研究表明,CBP通过Src信号通路抑制A431细胞的增殖,并诱导凋亡,抑制细胞的迁移和侵袭。而CBP棕榈酰化位点突变后,突变的CBP不再通过调节Src信号通路中相关蛋白的表达水平的变化,而发挥抑癌的生物学效应。最近,一些研究陆续表明CBP在恶性肿瘤中发挥不同的生物学作用,CBP根据不同的癌症类型具有不同的功能。棕榈酰化位点的突变也可能因为CBP在不同细胞中生物学功能的不同,而发挥不同的生物学作用。为了阐明CBP的不同功能的分子基础,以及棕榈酰化位点对不同细胞CBP生物学功能的影响,需要在每种情况下对棕榈酰化位点突变的CBP功能进行更广泛的分析。寻找CBP参与癌细胞功能的信号途径作用位点,为癌症的诊断与治疗提供新的研究方向,并积极寻找抗癌药物的新靶点,以提高肿瘤患者的生存质量,延长生 存期。

