奥希替尼治疗T790M 突变的肺腺癌后小细胞转化1例
陈东方,滕昊骅,赵瑞英,韩昱晨,钟润波
1.上海交通大学附属胸科医院呼吸内科,上海200030;
2.上海交通大学附属胸科医院病理科,上海200030
肺癌是中国乃至全球范围内发病率及死亡率均很高的恶性肿瘤之一。非小细胞肺癌(nonsmall cell lung cancer,NSCLC)占肺癌总数的80%~85%,其中腺癌占多数。表皮生长因子受体(epidermal growth factor receptor,EGFR)具有酪氨酸激酶活性。有研究报道肺癌患者在EGFR酪氨酸激酶区域存在驱动突变,特别是在东亚,女性及不吸烟NSCLC人群中普遍存 在[1-2]。超过90%的EGFR基因突变为19号外显子突变(19del)和21号外显子点突变(21L858R),两者均为敏感突变[3]。EGFR基因突变会导致下游信号分子通路的持续激活,并导致肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制[4]。EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)可阻断三磷酸腺苷(adenosine triphosphate,ATP)结合到细胞内酪氨酸激酶结构域,因此抑制受体自身磷酸化并导致下游信号的阻断[5]。多项临床试验已表明EGFR-TKI在治疗EGFR基因突变晚期NSCLC在疗效及生存期改善等方面优于单纯化疗,因此美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南已批准EGFR-TKI用于EGFR基因突变晚期NSCLC的治疗[6-8]。然而,随着用药时间的延长,EGFR-TKI治疗不可避免地出现耐药的情况,一线治疗获得性耐药中T790M阳性患者比例较高,对于这部分患者,三代EGFR-TKI奥希替尼是治疗的金标准药物[9]。本文报道1例一线EGFR-TKI治疗肺腺癌进展后出现T790M阳性,继续奥希替尼治疗发生小细胞转化的病例。
1 临床病史
患者女性,57岁,2013年11月以主诉“右侧背痛”入院。胸部CT:右肺上叶占位,腔静脉后淋巴结肿大,右肺中叶小结节,右侧少量胸水。PET/CT提示右肺癌并纵隔淋巴结及胸膜转移。气管镜检查对4R组淋巴结行经支气管针吸引活检术(transbronchial needle aspiration,TBNA),病理学诊断结果显示为腺癌,采用突变扩增系统(amplification refractory mutation system,ARMS)法行EGFR基因检测,结果显示为EGFR 19del。临床分期为T1bN0M1a期(胸膜)。2013年11月起服用吉非替尼,2015年5月接受胸部CT扫描,结果显示原发病灶较前增大,右侧胸水较前增多;骨扫描结果显示右侧第8前肋点状放射性增强,考虑转移性病变。一线治疗无进展生存期(progression-free survival,PFS)为18个月(图1)。2015年6月停用吉非替尼,二线改予培美曲赛+卡铂化疗2个疗程,评估结果为疾病进展(progression disease,PD)。2015年8月对患者行肺穿刺活检,病理学检查结果显示为肺腺癌,EGFR基因检测结果显示为EGFR 19del和EGFR 20T790M。临床再分期为T2aN0M1b期(胸膜、骨)。2015年9月起口服奥希替尼,2016年3月接受胸部CT示原发病灶较前增大,三线治疗PFS为6个月(图2)。再次行肺部病灶活检,病理学检查考虑小细胞癌,EGFR基因检测示EGFR 19del。临床再分期为T4N0M1b期(胸膜、骨)。2016年5月予依托泊苷+卡铂化疗2次后部分缓解(partial release,PR),四线治疗PFS为5个月(图3~5)。
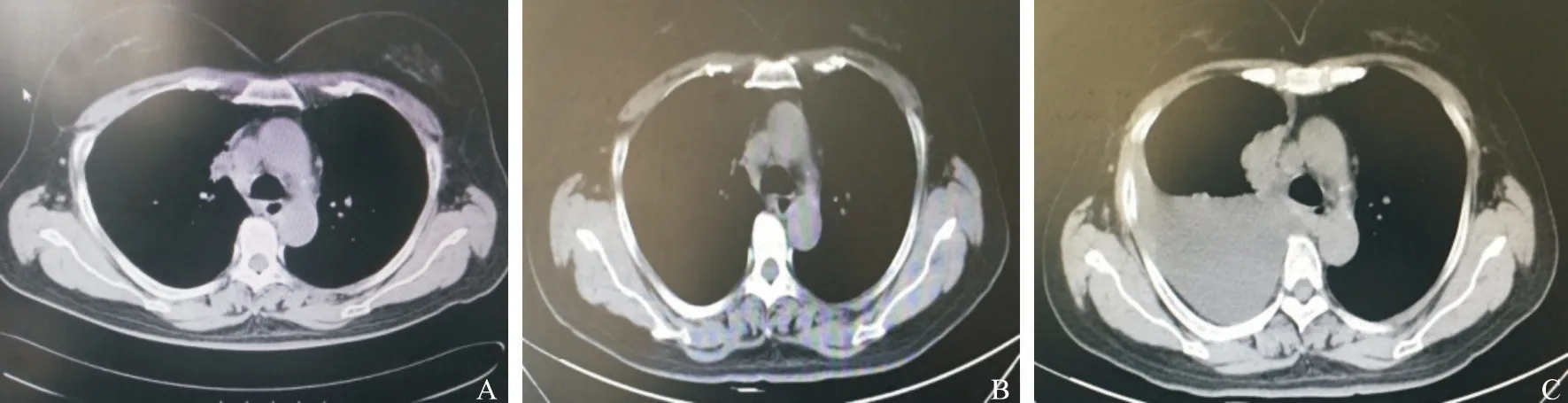
图 1 吉非替尼治疗期间胸部CT变化 Fig. 1 The changes of chest CT during gef itinib targeted therapy
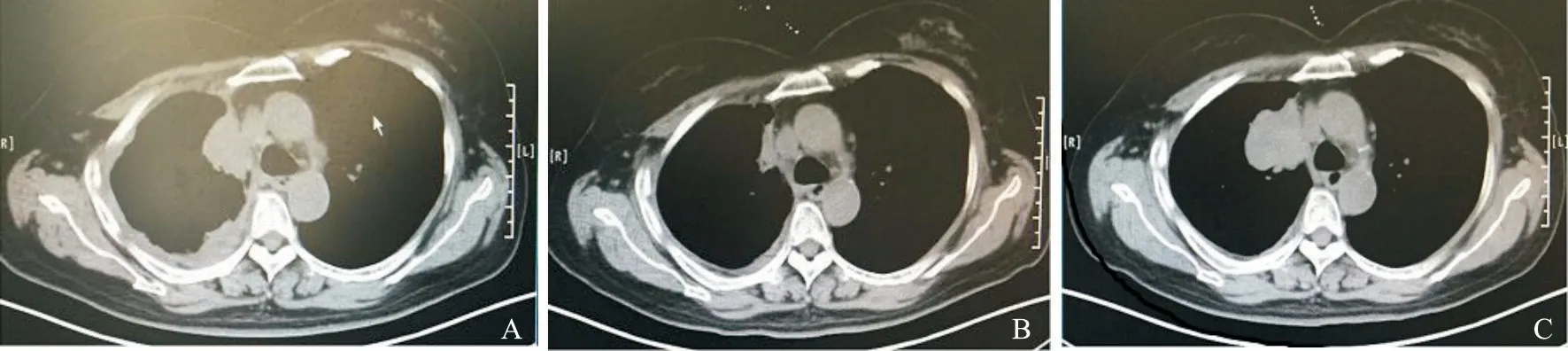
图 2 奥希替尼治疗期间患者胸部CT变化 Fig. 2 The changes of chest CT during osimertinib targeted therapy
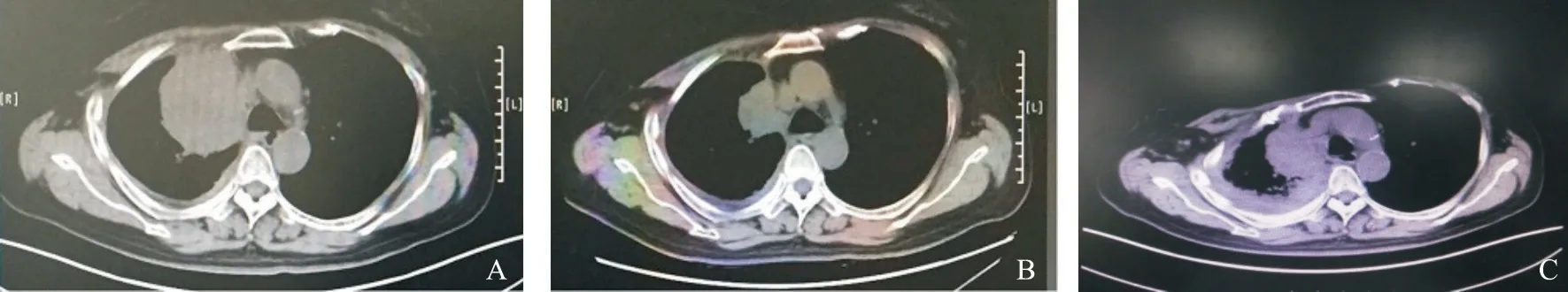
图 3 EC方案化疗期间患者胸部CT变化 Fig. 3 The changes of chest CT during chemotherapy of carboplatin and etoposide
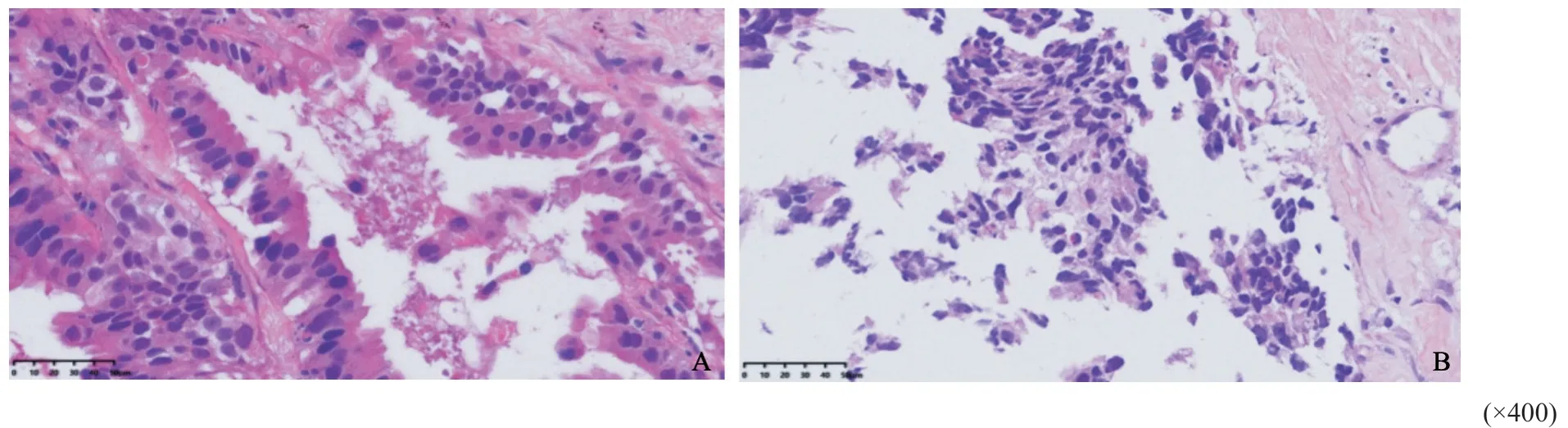
图 4 病理学诊断结果 (×400) Fig. 4 Pathological diagnosis by H-E staining
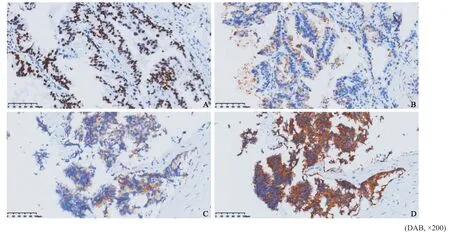
图 5 肺腺癌免疫组织化学检测 Fig. 5 Immunohistochemistry diagnosis of the lung adenocarcinoma
2 讨 论
EGFR基因敏感突变的晚期NSCLC的一线标准治疗包括吉非替尼、厄洛替尼等EGFR-TKI,而多数患者在接受治疗10~12个月后出现疾病进展,即出现获得性耐药[10]。最常见的耐药原因是T790M突变,约占60%,其它耐药原因还包括c-Met、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)基因扩增,小细胞肺癌(small cell lung cancer,SCLC)转化 等[11]。本例患者在一线治疗出现进展,予化疗未能控制病情后行第二次活检,病理学检查仍显示为肺腺癌,并出现T790M突变。根据NCCN指南,我们后续选择奥希替尼进行治疗。然而与一代或二代EGFR-TKI相似,对于T790M突变的晚期NSCLC,奥希替尼最终也会产生耐药。根据临床观察到的现象,耐药形式可分为3种情况:① 原始EGFR基因敏感突变和T790M突变均消失;② 仍可检测到EGFR基因敏感突变,但T790M突变消失;③ EGFR基因敏感突变和T790M突变均存在。在2017WCLC一项奥希替尼耐药分析中,发现保持T790M突变的患者主要出现了获得性C797S突变,而在T790M突变消失的患者中,其耐药机制主要为非EGFR依赖性的,例如出现SCLC转化,c-Met扩增,以及PI3KCA、BRAF和k-ras基因突变等。
本例患者在使用奥希替尼5个月后再次出现疾病进展,我们对其实施第3次活检,结果发现了SCLC转化。关于腺癌的SCLC转化,有研究表明在高加索肺癌人群中一线使用一代EGFR-TKI治疗耐药后组织学类型转化为SCLC的概率最高可达14%[14]。在过去的病例总结中,我们发现一些小细胞转化的临床易感倾向,包括非吸烟女性、相对年轻者、携带EGFR基因突变者(特别是19del)以及初诊为晚期肺腺癌[15]等。但也有报道称EGFR基因突变肺腺癌在EGFR-TKI治疗前以及EGFR基因野生型肺腺癌也会出现SCLC转化,这暗示EGFR-TKI及EGFR基因状态均不是促进SCLC转化的独立因素,但均可以作为促进SCLC转化的诱发因素[16]。另外,大部分经一线EGFR-TKI治疗后出现SCLC转化的患者保持与初诊肺腺癌相同的基因突变,只有一小部分患者会失去原始基因突变或者是获得另一种类型基因突变;但EGFR基因突变的SCLC中EGFR蛋白表达水平较低,EGFR基因也处于低扩增状态,一线靶向治疗失败后出现的转化型SCLC也是如此,提示在SCLC转化后继续接受靶向治疗可能疗效并不理想[17]。关于T790M阳性患者使用奥希替尼治疗后发生SCLC转化的病例报道相对更少,本例患者在SCLC转化后行基因检测发现T790M的消失以及初始EGFR突变的保持,与既往报道相符[18-19]。至于奥希替尼耐药后SCLC转化的相关特性是否与一线靶向耐药后SCLC转化或初治SCLC相似目前还未见相关报道,未来这方面值得探索。
而转化型SCLC的生存预后也是人们关注的焦点。在一项39例患者接受EGFR-TKI后转化为SCLC的汇总分析中(其中26例是一线接受EGFR-TKI治疗后转化的),转化后仍存在EGFR基因突变者有37例,从诊断肺腺癌到转化中位时间为19个月,转化后中位总生存期为6个月[20]。2017年欧洲临床肿瘤协会(European Society for Medical Oncology,ESMO)大会类似研究显示,转化为SCLC所需的中位时间为29.6个月,转化后中位总生存期为12.4个月。这些结果均提示从初诊到出现SCLC转化一般要在接受EGFR-TKI治疗较长时间后才会出现,转化后患者生存期与初治广泛期SCLC相同或更差。
EGFR-TKI治疗后出现SCLC转化的机制目前仍不明确,但曾经也提出过多种假设:
第一种假设:初始NSCLC中就存在了SCLC成分,由于活检时只取一部分组织,因而在病理学类型上忽视了SCLC成分[15];第二种假设:SCLC转化是由于之前诊断明确的病理学类型去分化所导致的[21];第三种假设:NSCLC与SCLC来源于共同的肿瘤干细胞。
有研究报道,肺泡Ⅱ型上皮细胞有转化为SCLC及EGFR突变肺腺癌的潜能;此外,在SCLC的基因测序中发现,Rb1及TP53基因的失活可能导致两者的转换,且MYC基因可能是SCLC的驱动基因[17]。针对SCLC转化后的治疗,我们发现绝大多数都是在SCLC标准治疗的基础上进行的,即依托泊苷+铂类方案化疗[22]。本例患者在行4次依托泊苷+卡铂化疗后,原发病灶明显缩小稳定,说明给予标准化疗有效。肺癌至出现SCLC转化的时间间隔较长,在此之前患者接受过多线治疗,因此患者对后续治疗的反应性及耐受性也会因人而异,个体化治疗尤为重要。
EGFR突变肺腺癌患者在接受EGFR-TKI治疗后,随着药物的选择压力,肿瘤亚克隆会不断演变,基因靶点可能出现变化[23],因此我们需要对其进行动态监测并调整治疗策略。虽然原发肿瘤病灶以及其他部位转移病灶的影像学变化,血液肿瘤标志物水平的改变都有提示病情的作用,但是再次活检是明确EGFR-TKI耐药原因的有力手段。本例患者在一线治疗进展后,在后续的诊疗中又经历了两次组织活检,前后发现了T790M突变及SCLC转化,说明再次活检对于治疗后耐药患者是必要的。然而在临床操作中,考虑到安全性、患者依从性等问题,有时并不能进行多次重复组织活检。近年来,液体活检作为一种新的检测方法正处于不断探索中。液体活检,即通过采集患者的血液进行检查,与之相关的有循环肿瘤细胞检测、循环游离DNA检测等,一些研究显示液体活检与组织活检有较好的一致性,但在敏感性方面尚待提高[24],因而目前的观点是液体活检作为重要的补充手段,与组织活检相辅相成,而非替代关系。未来随着技术的发展,相信对EGFR-TKI耐药机制的认识也将更加深入,个体治疗也将更加精准。

