阿特珠单抗联合卡铂和依托泊苷一线治疗广泛期小细胞肺癌的Ⅲ期试验
——IMpower 133研究解读
【简评】
广泛期小细胞肺癌(extensive-disease small cell lung cancer,ED-SCLC)的治疗20多年来没有重大进展,无论是在发病机制、驱动基因靶点探索还是药物研发等领域一直没有突破。IMpower 133研究在今年世界肺癌大会上公布结果,并同步发表在《新英格兰医学杂志》(New England Journal of Medicine,NEJM)上。该研究两个主要研究终点均为阳性,抗PD-L1单抗阿特珠单抗联合依托泊苷/卡铂(etoposide/carboplatin,EC)化疗方案一线治疗ED-SCLC可以改善患者的中位总生存期(median overall survival,mOS)和中位无进展生存期(median progression-free survival,mPFS),给ED-SCLC的治疗提供了新的选择,是小细胞肺癌治疗领域里程碑式的进展。
尽管该研究取得了阳性结果,但其中仍有些细节值得人们思考。首先,虽然阿特珠单抗联合EC化疗较单纯化疗有总生存(overall survival,OS)获益,而且是首个打破ED-SCLC既往mOS不超过10个月瓶颈的研究,但仅延长2个月OS的疗效仍无法令人满意;其次,IMpower 133研究的亚组分析并未找到免疫治疗的优势人群,对疗效预测生物标志物的探索也同样不足;最后,脑转移患者似乎无法从免疫治疗联合化疗的治疗中获益,而高龄患者却似乎获益更多,这些均有待进一步研究进行证实。
本期分享的是2018年9月发表在《新英格兰医学杂志》(New England Journal of Medicine,NEJM)上的IMpower 133研究,旨在比较抗PD-L1单抗阿特珠单抗联合依托泊苷/卡铂化疗方案对比安慰剂联合依托泊苷/卡铂化疗方案一线治疗广泛期小细胞肺癌(extensive-disease small cell lung cancer,ED-SCLC)的疗效和安 全性[1]。
1 背景
小细胞肺癌(small cell lung cancer,SCLC)约占肺癌的15%,是侵袭性最强的肺癌亚型,具有肿瘤倍增时间短、病情进展迅速、早期易转移等特点。尽管SCLC对放化疗敏感,但易复发耐药。SCLC治疗目前使用的仍是20年前就已确立的化疗方案,进展甚微。不断有研究者尝试开发用于SCLC患者的新药物,但其结果均不理想,许多三代化疗药物和分子靶向药物均在SCLC的战场上铩羽而归。不仅如此,约10个月的中位总生存期(median overall survival,mOS)就像牢牢困在ED-SCLC头上的魔咒一般,无论采用何种治疗策略或方案都始终无法突破。PD-1/PD-L1单抗先后被美国食品药品管理局(Food and Drug Administration,FDA)批准用于非小细胞肺癌(non-small cell lung cancer,NSCLC)的二线治疗、放化疗后的维持治疗和选择人群的一线治疗,我们不禁期待免疫治疗是否可以为SCLC患者带来新的希望。
2018年4 月,美国FDA基于CheckMate 032研究公布的数据,批准了nivolumab ± ipilimumab用于二线治疗6个月内复发的ED-SCLC患者[nivolumab单药的客观缓解率(objective response rate,ORR)约为12%,联合ipilimumab的ORR约为21%]。免疫检查点抑制剂(immune checkpoint inhibition,ICI)首次在难治性/转移性SCLC中显示出临床活性。针对阿特珠单抗开展的Ⅰa期临床研究(PCD4989g)发现,阿特珠单抗单药对既往多线治疗SCLC患者的ORR约为6%,依据免疫相关反应标准(immune-related response criteria,IRRC)标准则为24%,进一步证实ICI策略在SCLC中具有可行性。不仅如此,前期基础研究发现,SCLC具有高肿瘤突变负荷(tumor mutation burden,TMB)、抗原递呈减弱、肿瘤微环境内富含髓系来源抑制细胞(myeloid derived suppressor cells,MDSC)等特征。借鉴ICI联合化疗在NSCLC中的成功经验,阿特珠单抗联合化疗一线治疗ED-SCLC的IMpower 133研究应运而生。
2 研究概况
该研究入组经组织学或细胞学证实的初治ED-SCLC患者,无症状且已接受过治疗的脑转移患者也可以入组。排除具有自身免疫病史或之前接受过CD137激动剂或免疫检查点阻断治疗的 患者。
该研究采用置换区组随机法,以患者性别、PS评分及有无脑转移作为分层因素,患者按1∶1随机分配到阿特珠单抗/EC联合治疗组或安慰剂/EC治疗组,接受4个周期治疗后继续接受阿特珠单抗或安慰剂维持治疗直至病情进展或出现不可耐受的不良反应(图1)。
该研究主要终点为意向性原则(intention to treat,ITT)分析集的总生存期(overall survival,OS)以及研究者评估的中位无进展生存期(median progression-free survival,mPFS)。次要研究终点包括ORR、缓解持续时间和安全性。探索性分析包括疗效与TMB之间的相关性[采用基于血液学的TMB(blood-based TMB,bTMB)检测评估TMB)]。

图 1 患者入组与治疗分配[1]Fig. 1 Registration and randomization[1]
3 统计学设计特点
本研究设置了2个共同主要研究终点,统计检验水准α基于成组序贯Holm设计,总的一类错误概率设双侧0.050,针对OS和PFS分别设0.045、0.005,其中任何一个终点经比较检验后,若拒绝无效假设,则相应的α可以传递给另一个终点(图2)。
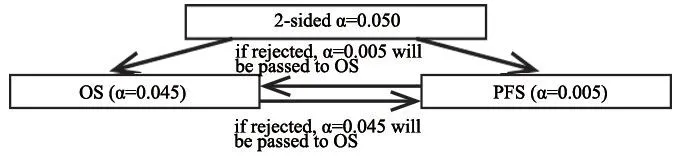
图 2 成组序贯Holm设计示意图Fig. 2 Group sequential Holm procedure
按照该设计,研究样本量基于OS进行估算。根据经验,安慰剂/EC治疗ED-SCLC的中位OS约为10个月,假设阿特珠单抗/EC相比安慰剂/EC的风险比(hazard ratio,HR)为0.68,检验水准α=0.045,假设入组12个月并考虑5%失访,第1例入组后31个月时,要有88%的把握度检验出差异有统计学意义,则所需事件数为280例,相应样本量为400例。研究经4次方案修订后,最终确定样本量不变,所需事件数提高到306例。
研究预设开始随机后23个月约240例死亡事件时进行OS期中分析,提前终止的检验水准为α=0.019;实际在发生238例死亡事件时(2018年4月24日)进行数据锁定,作为OS期中分析的结果。PFS无期中分析计划,最终分析与OS期中分析同时进行,预期将发生295例事件,相当于在α=0.005检验水准时,有98%的把握度检验出HR=0.55的组间PFS差异。
对于OS和PFS的组间定性比较均采用分层Log-rank检验(当预设亚组事件数少于10例时,则忽略该亚组因素)。定量比较采用分层COX回归分析计算HR,分层因素与Log-rank检验保持一致,并基于Brookmeyer and Crowley方法计算95%CI。
4 研究结果
2016年6 月—2017年3月,研究共入组403例患者:阿特珠单抗/EC组201例,安慰剂/EC组202例。两组分别有124例(61.7%)和142例(70.3%)患者因死亡、失访等原因而终止研究;分别有104例(51.7%)和116例(57.4%)患者完成了诱导期治疗并接受至少1个周期维持治疗;分别有198例(98.5%)和196例(97.0%)患者纳入安全性分析。
患者年龄、性别、吸烟状态、bTMB水平等基线特征在两组间分布均衡(表1)。结果显示,中位随访13.9个月后,阿特珠单抗组显著延长患者中位OS(12.3个月 vs 10.3个月,HR=0.70,95%CI:0.54~0.91,P=0.007),达到了研究预设的OS期中分析经验水准0.019,阿特珠单抗组较安慰剂组死亡风险降低了30%。两组中位PFS分别为5.2和4.3个月(HR=0.77,95%CI:0.62~0.96,P=0.017)。此外,阿特珠单抗组比安慰剂组1年OS率(51.7% vs 38.2%)和PFS率(12.6% vs 5.4%)同样具有明显优势。OS亚组分析结果显示,大部分患者,不论肿瘤bTMB高低、是否肝转移、性别如何都可从阿特珠单抗/EC治疗获益,但脑转移患者似乎并不能从阿特珠单抗的治疗中获益(图3)。两组患者ORR差异无统计学意义(60.2% vs 64.4%),客观缓解持续时间在阿特珠单抗组更长(4.2个月 vs 3.9个月,HR=0.70,95%CI:0.53~0.92)。6个月无事件生存率(events-free survival,EFS)分别为32.2%和17.1%,12个月 EFS分别为14.9%和6.2%。
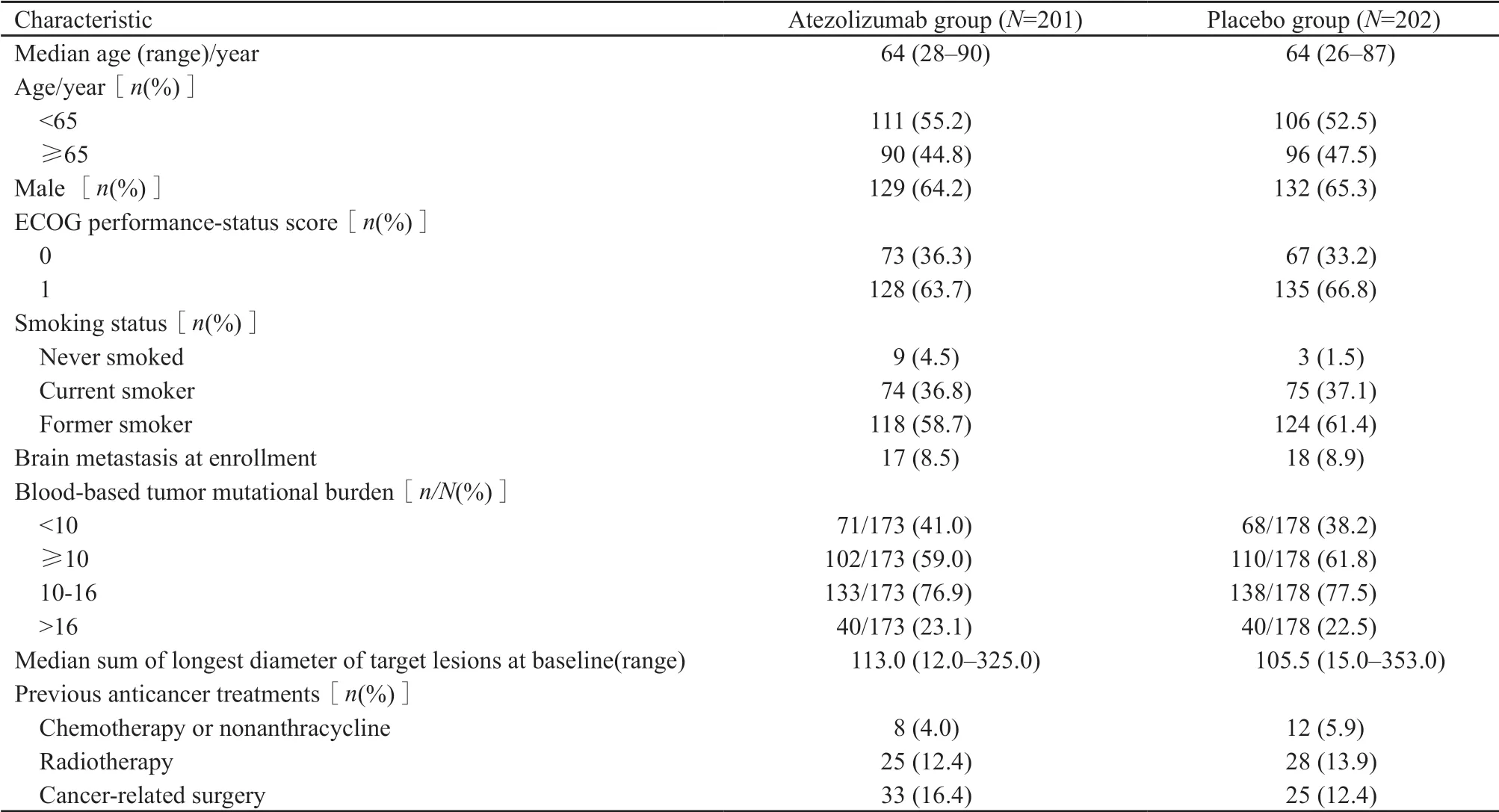
表 1 入组患者基线特征(ITT集)[1]Tab. 1 Baseline characteristics of all enrolled patients[1]
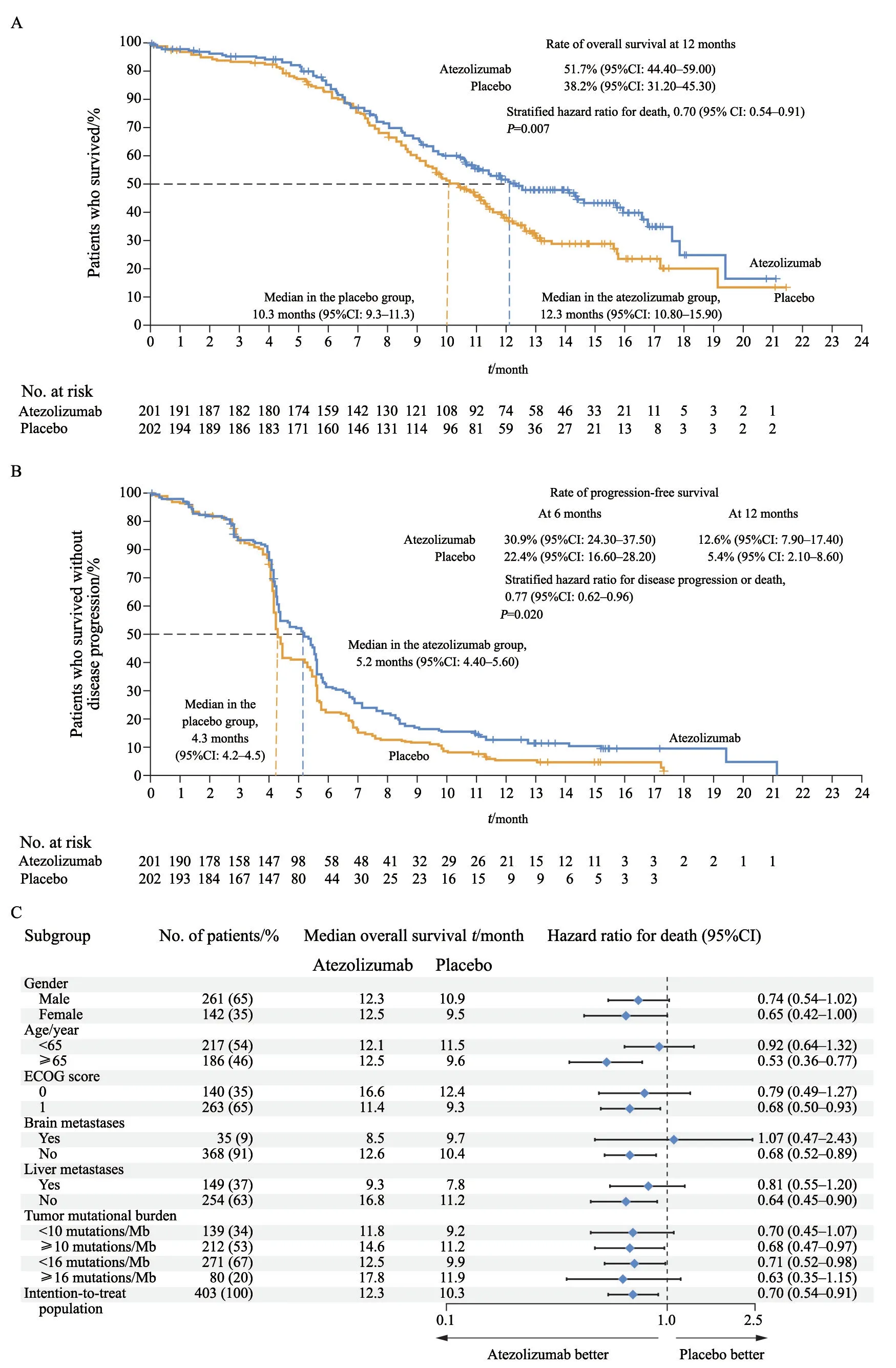
图 3 总生存率、无进展生存率及总生存率基线亚组结果[1]Fig. 3 OS, PFS and OS according to baseline characteristics[1]
安全性分析显示,两组不良反应(adverse effect,AE)发生率差异无统计学意义,阿特珠单抗组与之前研究所报告的安全性相似,未观察到新的不良反应,主要症状为皮疹和甲状腺功能减退。
5 讨论与思考
长久以来,依托泊苷联合铂类药物(卡铂或顺铂)是一线治疗广泛期SCLC的标准化疗方案。尽管有效率可达60%~65%,但患者的中位生存时间仅为10个月。SCLC的TMB高,提示肿瘤可能具有较高的免疫原性并对ICI治疗有效。既往针对复发或转移性SCLC患者的免疫治疗研究(Keynote 001、Checkmate 032等)均显现出一定的疗效。
与既往nivolumab ± ipilimumab二线治疗EDSCLC的Checkmate 032研究和基于Keynote 028开展的pembrolizumab用于铂类联合依托泊苷治疗后获得SD及以上的ED-SCLC维持治疗研究的策略不同,IMpower 133研究直接挑战之前失败的CA184-156 Ⅲ期研究,尝试一线化疗联合PD-L1单抗阿特珠单抗在ED-SCLC中的应用。从研究结果来看,EC方案联合阿特珠单抗,使mOS提高了2个月,1年OS率提高了约13%,OS与PFS获益在亚组分析中也基本保持一致。这是过去25年来,首个观察到相比一线标准治疗可以给ED-SCLC患者带来有临床意义(OS延长)的研究,因此有学者评论IMpower 133研究改写了SCLC治疗历史,撼动了NCCN指南。
为什么同样是一线免疫联合化疗的Ⅲ期临床研究,IMpower 133研究在ED-SCLC中获得了成功,而CA184-156研究却是阴性结果呢?
首先,在研究设计上,CA184-156研究[2]的随机时间点过早,实际上两组在随机后前1~2个周期均只接受EP方案化疗,并未联合ipilimumab或安慰剂治疗。这对于前期脱落率较高(约15%)、疾病本身进展较快和治疗方案毒性较大(EC方案较大的血液学毒性)的研究来说,并非最佳选择。同时,由于ipilimumab自身会引起不良反应,ipilimumab组皮疹和腹泻等免疫相关AE的发生率(25%和19%)显著高于安慰剂组(10%和3%),ipilimumab组在完成诱导期治疗和进入维持期治疗的患者例数均低于安慰剂组。以上都可能影响最终结果。
其次,从CTLA-4与PD-1/PD-L1抑制剂的作用机制来看,二者之间存在差异。在空间分布上,CTLA-4在活化的T细胞和调节性T细胞(regulatory T cell,Treg)细胞表面高表达,其主要通过抑制抗原递呈发挥抑制免疫应答的作用,同时参与T细胞耗竭[3]。而PD-1分子的表达更广泛,在活化的T细胞、Treg细胞以及髓系树突状细胞(myeloid dendritic cells,DC)表面中等表达,而其配体PD-L1/PD-L2在肺癌细胞、血管内皮细胞及MDSCs均有不同程度表 达[4]。因此,CTLA-4在淋巴结中的免疫循环的早期阶段抑制T细胞,而PD-1在外周组织或肿瘤部位的免疫应答中进行调节。对于富含MDSC细胞、抗原递呈减弱的SCLC而言,通过ipilimumab阻断CTLA-4/B7分子间的作用,并不能有效激地活肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)的抗肿瘤免疫应答(PD1/PD-L1因素占主导作用)。因此,ipilimumab可能并非一线治疗ED-SCLC的合适选择。
尽管IMpower 133研究获得了OS和PFS双阳性的结果,但该项研究并非完美无瑕。首先,从生存曲线来看,在治疗的前6个月,阿特珠单抗组与安慰剂组非常接近,甚至有交叉的趋势,直到后期才分开。此外,免疫治疗常见的拖尾效应在该研究中并不明显,OS曲线在19个月左右有相交趋势,这更像传统治疗的效应。其次,亚组分析中,脑转移患者似乎不能从阿特珠单抗/EC方案中获益,由于例数太少(35例),仍需后续研究证实。
研究显示,两组ORR差异无统计学意义,可能的解释是化疗方案本身ORR已经很高,联合治疗很难超越。但无论从基于Keynote 028研究将pembrolizumab作为SCLC维持治疗的尝试,还是IMpower 133研究后阿特珠单抗维持治疗未显示出拖尾效应,均提示单纯的化疗后免疫维持治疗为ED-SCLC患者带来的生存获益仍然有限。因此,从ED-SCLC患者中寻找免疫治疗优势人群显得尤为重要。
IMpower 133研究首次在Ⅲ期临床研究中,尝试利用bTMB作为生物标志物预测免疫治疗的效果。有研究发现,bTMB≥16可以预测阿特珠单抗用于二线或以上晚期NSCLC治疗的疗效[5]。小样本研究表明,SCLC的中位TMB为9[6]。而该研究的亚组分析中,无论是以10还是16作为bTMB的cut-off值,均无法作为阿特珠单抗一线治疗ED-SCLC的疗效预测标志物。对于ICI联合化疗时,bTMB的cut-off值是否应区别于阿特珠单抗单药,也尚无定论。上述线索均提示SCLC的bTMB cut-off值有待进一步确定。针对不同检测平台得到的结果一致性如何也有待进一步探讨。
IMpower 133研究中由于组织取材较少,无法满足免疫组织化学检测的需求,因此并未对肿瘤组织的PD-L1表达水平进行检测,无相关亚组分析。在其前期研究中,也未发现PD-L1表达与阿特珠单抗疗效间的相关性。值得一提的是,与阿特珠单抗匹配的PD-L1检测,用的是被专家质疑最多的Ventana/SP142试剂盒。今年在《胸部肿瘤学杂志》(Journal of Thoracic Oncology,JTO)杂志上公布的blueprint Ⅱ期研究结果,凸显了各检测方法之间的差异[7]。除此之外,作为抗PD-L1单抗,阿特珠单抗保留了免疫检查点PDL2/PD-1间的相互作用,在疗效上是否区别于抗PD-1单抗仍有待进一步探索。
总之,瑕不掩瑜,随着IMpower 133研究的成功,其他PD-1/PD-L1抗体开始奋起直追,在SCLC二线联合治疗、同步放化疗后维持治疗、一线联合化疗等不同阶段开展临床研究。明确单药免疫和免疫联合治疗的优势人群、免疫治疗的最佳时机、联合治疗的理想模式等,均是下一步研究亟待解决的问题。

