瓜蒌提取物的化学指纹特征及5种成分的定量分析
邹纯才,吕文雅,鄢海燕,洪国君,王莉丽
瓜蒌为葫芦科植物栝楼(Trichosanthes kirilowiiMaxim.)或双边栝楼(Trichosanthes rosthorniiHarms.)的成熟阴干果实[1],其皮称为瓜蒌皮,子称为瓜蒌子.由于瓜蒌不易阴干,有关文献以瓜蒌皮:瓜蒌子(35:65)用于胸痹心痛等疾病的治疗[2].本研究在对瓜蒌提取溶剂、瓜蒌皮与瓜蒌子配伍比例考察的基础上[3,4],制备瓜蒌提取物,可为开发现代新剂型如滴丸、微丸奠定基础[5,6].本实验对瓜蒌提取物的化学指纹图谱及尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷进行定量分析,以期为瓜蒌提取物的质量控制提供理论依据.
1 实验仪器及材料
1.1 实验仪器
LC-20A高效液相色谱仪(日本岛津公司),FA2004型电子天平(上海良平仪器仪表有限公司),DZF-6030A型真空干燥箱(上海恒一科技有限公司).
1.2 实验材料
瓜蒌提取物(皖南医学院药物制剂及其质量控制课题组制备,批号:lwy170601~lwy170610);尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷(国药集团化学试剂有限公司,批号分别为:20150417、20140928、20150707、20140522、20150526);甲醇、乙腈为色谱纯,水为娃哈哈纯净水,其他试剂均为分析纯.
2 方法
2.1 溶液的制备
(1)对照品溶液的制备.取尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷对照品适量,精密称定,置于10mL容量瓶中,以15%甲醇溶解并定容,制备浓度均为0.10mg·mL-1的混合对照品溶液,备用.
(2)瓜蒌提取物供试品溶液的制备.取不同批次瓜蒌提取物,精密称定,以15%甲醇溶解并定容,制备浓度为0.5g/mL的瓜蒌提取物溶液,备用.
2.2 色谱条件
色谱柱为YMC-PackODS-A(250mm×4.6mm,5μm);流动相A为甲醇,流动相B为0.1%磷酸水溶液,梯度洗脱:0~25min,100%B;25~40min,98%B;40~90min,98%B→80%B;90~200min,80%B→80%B.柱温为25℃,检测器为DAD,检测波长为254nm,流速为1.0mL·min-1,进样量为10μL.
3 结果
3.1 瓜蒌提取物HPLC化学指纹特征
(1)10批瓜蒌提取物的指纹图谱.瓜蒌提取物及对照品的色谱图,见图1.根据《中药色谱指纹图谱相似度评价系统》,设置1号样品色谱图为参照图谱,经多点校正,Mark峰匹配,生成对照图谱,得到共有峰的数目为44个.其中1、2、3、4、5号峰分别为尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷.
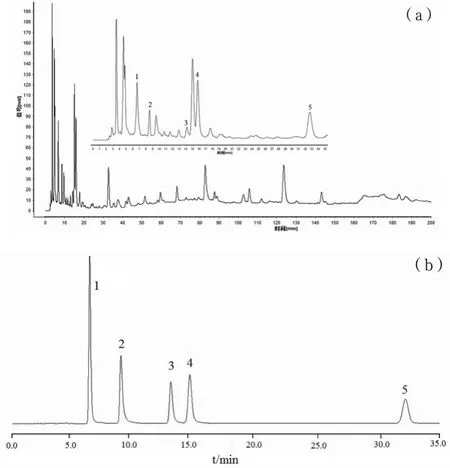
图1 瓜蒌提取物(a)及对照品(b)HPLC色谱图
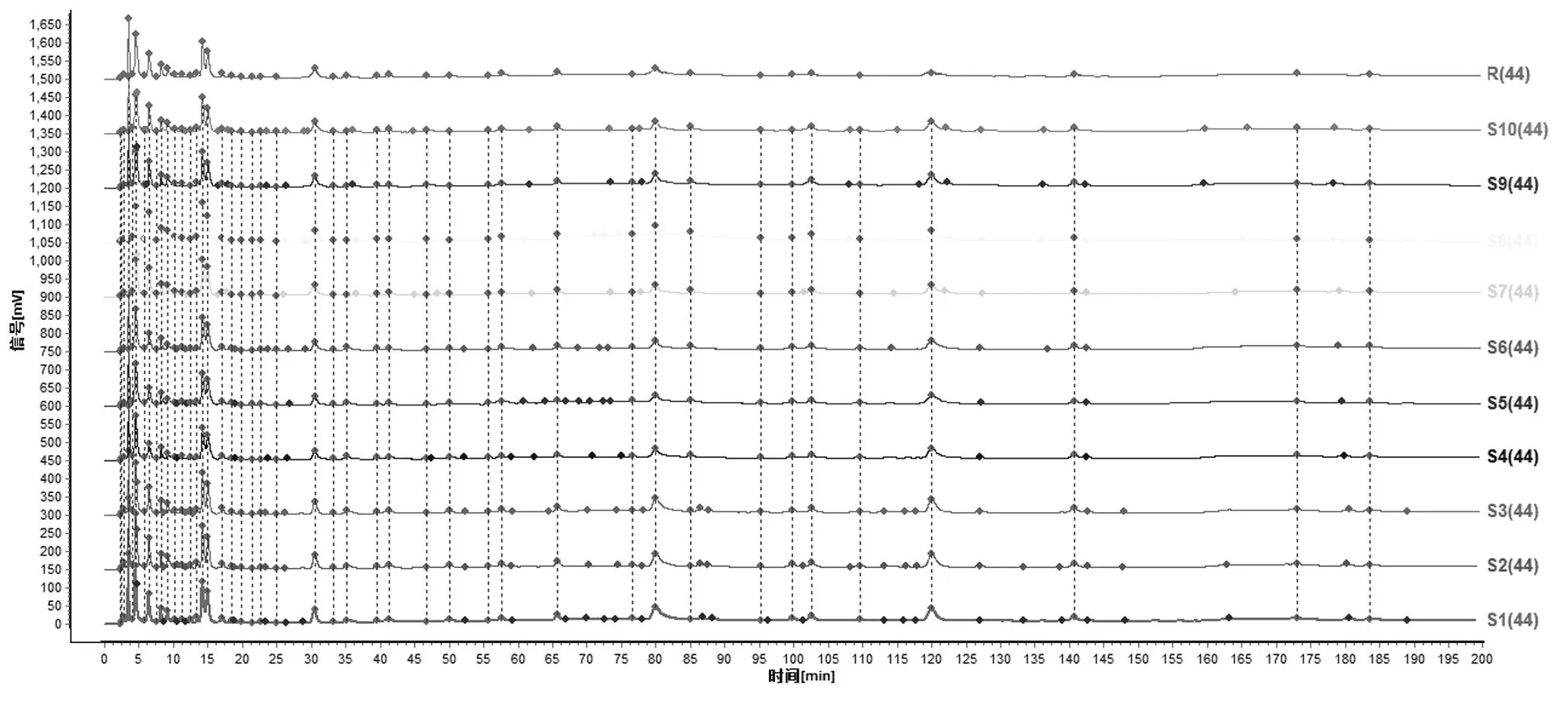
图2 10批瓜蒌提取物HPLC指纹图谱
表1 10批瓜蒌提取物的相似度值(±s,n=10)

表1 10批瓜蒌提取物的相似度值(±s,n=10)
(2)指纹图谱相似度的计算.计算10批瓜蒌提取物的指纹图谱与共有模式的相似度.结果见图2,表1.
3.2 瓜蒌提取物中5种成分的定量分析
(1)标准曲线的建立.精密吸取混合对照品溶液,稀释2、4、8、16倍,按“2.2”项下色谱条件进样.以对照品溶液的质量浓度 x(μg·mL-1)为横坐标,峰面积y为纵坐标进行线性回归.结果见表2.
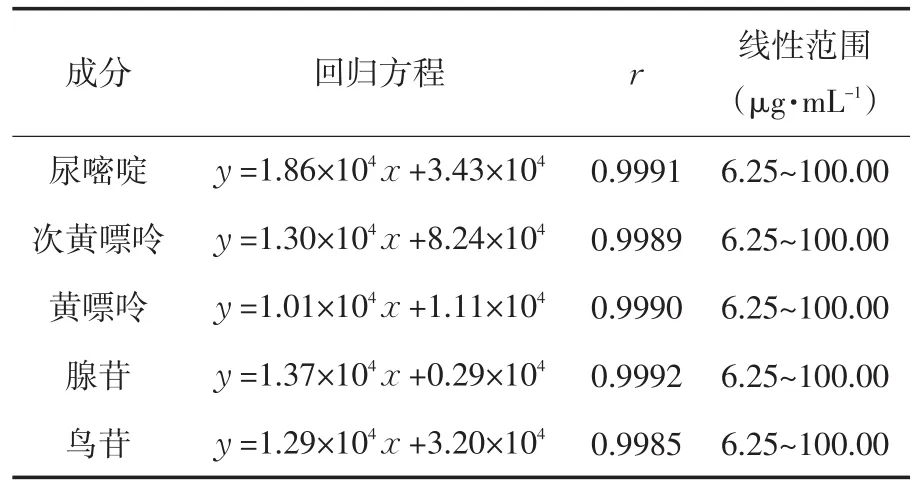
表2 5种成分的回归方程
(2)方法学考察.
①精密度.取瓜蒌提取物(批号:lwy170601)适量,按“2.1(2)”项下方法制备供试品溶液,按“2.2”项色谱条件,连续进样5次.结果显示,尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷峰面积的RSD分别为0.1%、0.3%、0.3%、0.2%、0.3%,表明仪器精密度良好.
②稳定性.取瓜蒌提取物(批号:lwy170601)适量,按“2.1(2)”项下方法制备供试品溶液,按“2.2”项色谱条件,分别在0h、6h、12h、18h、24h进行测定.结果显示,尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷峰面积的RSD分别为1.7%、2.5%、0.9%、1.5%、2.7%,表明样品溶液在24h内稳定性良好.
③重复性.取瓜蒌提取物5份(批号:lwy170601~lwy170605),按“2.1(2)”项下方法制备供试品溶液,按“2.2”项色谱条件测定.结果显示,尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷峰面积的RSD分别为3.2%、2.4%、3.9%、1.4%、3.2%,表明方法重复性良好.
④加样回收率.取已知尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷含量的瓜蒌提取物(批号:lwy170601)供试品溶液9份,分为3组,每组3份,每组分别按尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷已知含量的80%、100%、120%精密加入对照品.按“2.2”项下色谱条件进样测定.结果见表3、表4.
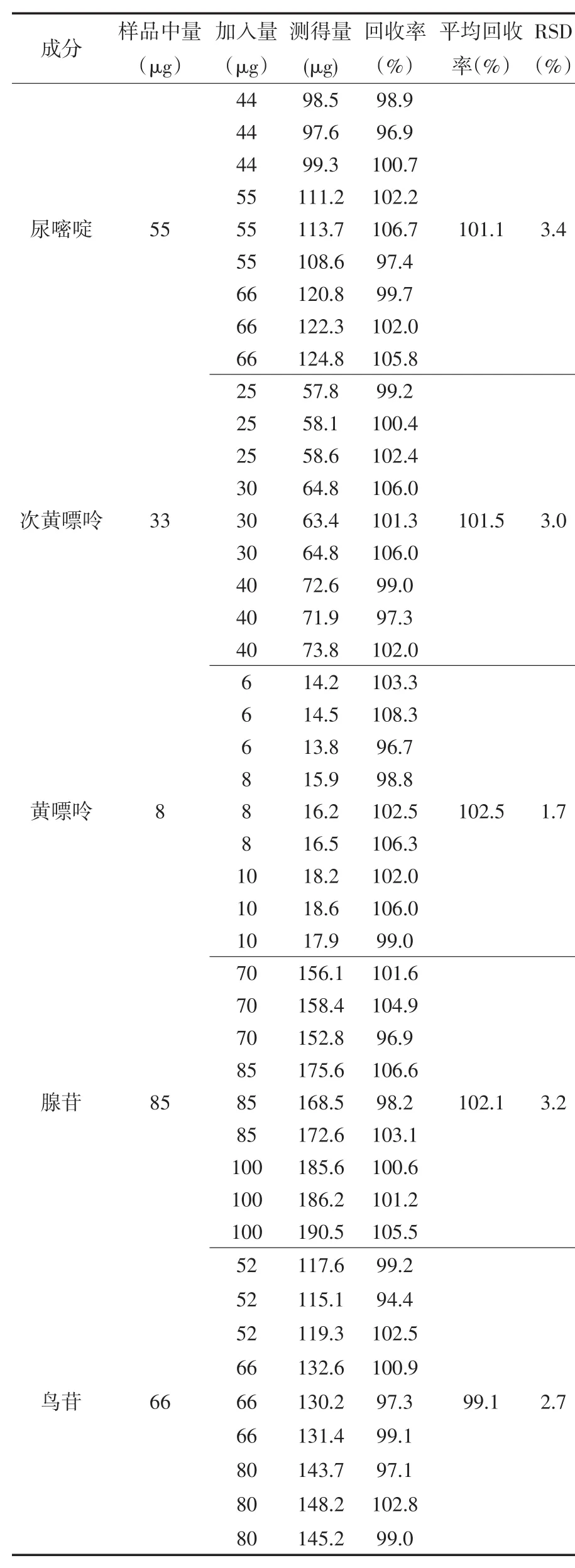
表3 加样回收率试验结果
表4 瓜蒌提取物中5种成分的定量分析结果(±s,n=10)
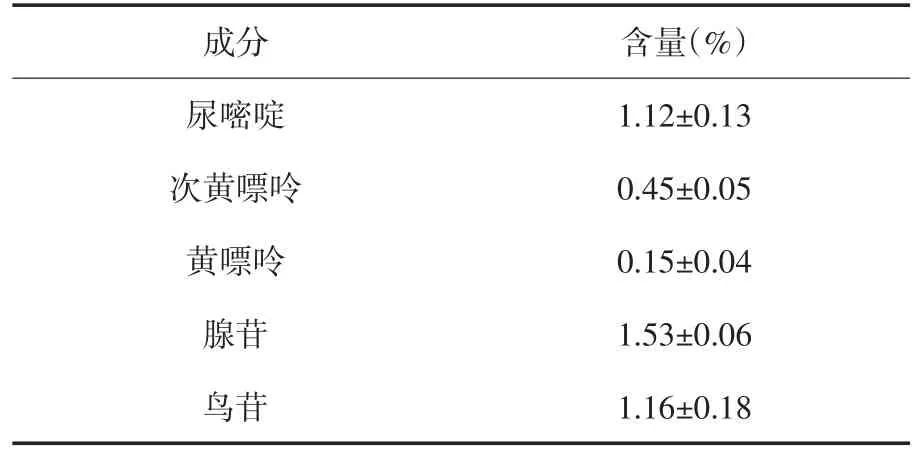
表4 瓜蒌提取物中5种成分的定量分析结果(±s,n=10)
尿嘧啶次黄嘌呤黄嘌呤腺苷鸟苷1.12±0.13 0.45±0.05 0.15±0.04 1.53±0.06 1.16±0.18
4 讨论
本研究考察了SynergiTMHydro-RP(4.6mm×250mm,4μm)和 YMC-Pack ODS-A(250mm ×4.6mm,5μm.)色谱柱及甲醇(乙腈)-水、甲醇(乙腈)-0.1%磷酸水溶液及甲醇(乙腈)-0.1%磷酸-0.02%三乙胺水溶液等流动相对瓜蒌提取物中主要色谱峰分离效果的影响,结果以YMC-Pack ODS-A(250mm×4.6mm,5μm)色谱柱及甲醇-0.1%磷酸水溶液为流动相,瓜蒌提取物的分离效果可满足分析要求.流动相的pH对瓜蒌提取物中核苷类成分的分离效果影响较大,应注意保持流动相pH值的稳定.
现有文献对瓜蒌的化学成分和药理作用研究较多,但尚未有较为统一的瓜蒌提取物制备方法及质量评价方法.本课题组制备的瓜蒌提取物为瓜蒌经水提醇沉后冷冻干燥制备而得.药理学研究表明[7-8],瓜蒌提取物保留了瓜蒌的药效成分,具有较好的抗氧化活性和抗大鼠心肌缺血再灌注损伤的作用,可用于制备瓜蒌滴丸、瓜蒌片等现代剂型.中药指纹图谱用于中药的质量评价已被国内外广泛认可.由实验结果可知,10批瓜蒌提取物HPLC化学指纹特征相似度的平均值为0.98,s值为0.005,说明不同批次的瓜蒌提取物的化学指纹特征相似度较高,且精密度较好,瓜蒌提取物的质量较为稳定.可设定瓜蒌提取物的化学指纹特征相似度值不得低于0.95.
课题组前期研究结果表明,腺苷、鸟苷、尿嘧啶、次黄嘌呤等和瓜蒌抗凝血作用有着重要联系[7],为此,本实验在建立瓜蒌提取物HPLC指纹图谱的同时,对尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷等5种成分进行了定量分析,方法准确,可靠,可满足瓜蒌提取物的质量控制要求.结合本实验瓜蒌提取物的化学指纹特征及尿嘧啶、次黄嘌呤、黄嘌呤、腺苷、鸟苷等5种成分的定量分析,可进一步进行瓜蒌提取物药效学及谱效关系研究.

