大鼠肠粘膜组织鲜味受体传感动力学研究
,,
(1.上海海洋大学食品学院,上海 201406; 2.天津商业大学食品科学与生物技术学院,天津 300134; 3.上海交通大学农业与生物学院,上海 200240)
我国关于鲜味的最早记录是宋朝林洪在《山家清供》中记载竹笋“其味甚鲜”,现代是由池田菊苗于1908年发现,并第一次提出了鲜味的概念[1],用来描述海藻提取物-谷氨酸钠的味道。食品中的鲜味物质包括氨基酸类、核苷酸类、小肽类、其他有机酸类和有机碱类。鲜味由味觉感受细胞上多种不同的鲜味受体传感,主要包括mGluR4和mGluR1两种亲谷氨酸代谢受体与味觉受体异源二聚体T1R1/T1R3[2]。两种代谢型鲜味受体主要发生在后舌,有助于其他口味的鲜味和化合物之间的辨别行为,异源二聚体T1R1/T1R3主要在舌前部的菌状乳突和软腭中共表达。味觉受体主要分布于味蕾组织上,将味觉信号传递到大脑从而感受到味道,达到控制饮食的目的。已有研究表明,鲜味受体不仅分布在味蕾中,还分布在身体的各个细胞、组织和器官中,特别是肠道系统中[3],表明鲜味受体具有其他功能。越来越多的证据表明味觉受体在人体内消化和代谢调控过程中发挥重要的调控作用[4-5]。鲜味受体在肠黏膜内分泌细胞中表达,与其他化学信号分子相协调,调节能量和葡萄糖稳态[6-7]。大量研究表明,分布在肠道系统中的味觉受体通过调节机体代谢与内分泌系统,吸收营养,合成自身成分(如氨基酸),或通过交感-副交感神经系统作用于下丘脑、脑垂体,调节机体的神经内分泌系统[8-9]。
本实验室前期对大鼠肠道组织的磷酸化蛋白组学研究表明,机体通过肠道控制代谢的基因主要在空肠的第二段表达。所以本研究就选用谷氨酸钠、肌苷酸二钠和鸟苷酸二钠这三种典型的鲜味物质。选取空肠第二段黏膜组织为材料,制备电化学型组织传感器,探讨这3种鲜味物质在空肠中与其相应受体作用的动力学特性和参数,推测鲜味受体与这些鲜味物质的传感、吸收、运转调节中的作用。
1 材料与方法
1.1 材料与仪器
Sprague Dawley(SD)大鼠 体重200 g左右,雄性,8~10周龄,天津市翔天科技有限公司;可溶性淀粉 天津市赢达稀贵化学试剂厂;海藻酸钠 天津市光复精细化工研究所;戊二醛 天津博迪化工股份有限公司;核微孔膜 英国Whatman公司;CaCl2、CollagenaseⅡ、DispaseⅡ、谷氨酸钠、肌苷酸二钠、鸟苷酸二钠 美国Sigma公司;所有试剂 均为分析纯;水为超纯水。
LCQ分析天平 上海精密科学仪器有限公司;Millipore Milli-Q纯水 上海雅荣生化设备仪器有限公司;KQ 3200B型超声波清洗器 昆山市超声仪器有限公司;LRH-70生化培养箱 上海一恒科技有限公司;CHI600E电化学工作站、三电极系统(玻碳电极(GCEΦ=3 mm)、参比电极-Ag/AgCl电极、对电极-铂丝电极) 上海辰华仪器有限公司。
1.2 实验方法
1.2.1 实验设计方法 受体与配体相互结合,符合酶与底物相互作用的动力学曲线,即受体配体相互结合,随着配体浓度的增大,通过电化学工作站而计算出的电流变化率为,先不断增长,再趋于稳定,即在受体未饱和的情况下,不断与配体相结合,当饱和后,电流不再发生变化。
1.2.2 肠粘膜组织的制备 大鼠脱颈致死,用手术刀剖开腹部,取大鼠空肠组织第二段(从近十二指肠的空肠组织开始,以10 cm为一个段,取第二段),再用剪刀剪为三段,洗净内容物,用刀片将肠段剖开为平面,取0.25 cm2的肠粘膜平面置于生理盐水中待用。
1.2.3 肠粘膜组织鲜味传感器的制备 将1 g可溶性淀粉溶解于100 mL 1%的戊二醛水溶液中,80 ℃水浴加热并搅拌30 min,配成一定质量浓度的淀粉溶液,室温下放置过夜,使淀粉与戊二醛得到充分的交联,获到醛基化淀粉胶溶液。将2 g海藻酸钠加入100 mL超纯水中制成溶液,再与醛基化淀粉胶溶液1∶1混合[10-12]。取上述溶液10 μL,均匀涂抹于2张直径为25 mm、孔径为0.22 μm聚碳酸酯微孔膜上,将准备好的0.25 cm2肠粘膜组织放置于一张微孔膜的圆心上,然后将另一张聚碳酸酯微膜覆盖其上,制成三明治结构的测定膜。将制成的肠粘膜组织膜浸入5 g/100 mL的CaCl2溶液中10 s后取出,使海藻酸钠与CaCl2发生离子交换反应形成稳定的螯合物,凝胶化成良好的固定剂[13-14]。然后用生理盐水冲洗肠粘膜组织膜(去除膜上存留的Cl-、Ca2+等)。最后,将肠粘膜组织膜固定在玻碳电极头的表面,使得肠粘膜组织与表征完全的电极芯重合,制成鲜味生物传感器。
1.2.4 鲜味生物传感器对鲜味物质的测定方法 采用三电极系统,将固定好肠粘膜组织测定膜的玻碳电极作为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极,以超纯水为空白对照,-0.38 V,通过电流-时间测定法测定不同浓度(10-14~10-1mol/L)的谷氨酸钠、肌苷酸二钠、鸟苷酸二钠的响应电流,以响应电流的变化率作为检测指标[15],响应电流的变化率的计算公式为:
式(1)
式中:I1及I2分别表示鲜味物质被测定前后同一时间点的稳态电流值(A)。
1.3 数据处理
利用chi660电化学工作站测定指定浓度范围内的稳定电流值,再用excel表计算出如式1中的电流变化率,将这些值放入Orgin9软件中,利用线性拟合曲线和非线形拟合曲线分别作图。
2 结果与分析
2.1 电流-时间测定法的电位优化
制备好的传感器在不同电位下(测试底液为超纯水)用电流-时间法进行测定,以加入10-5mol/L的谷氨酸钠、肌苷酸二钠、鸟苷酸二钠前后稳态电流差,来衡量不同电位对传感器电化学响应效果的影响,以电位的负值(-E)为横坐标、电流前后变化率为纵坐标作图。结果表明,在-0.38 V条件下电流的变化值最大,说明在此电流值下,鲜味物质的响应最明显。故选定-0.38 V为恒电位进行鲜味生物传感器对谷氨酸钠、肌苷酸二钠、鸟苷酸二钠响应特性的研究。
2.2 鲜味配体与鲜味受体检测范围作用曲线
将固定化肠粘膜组织的电化学传感器置于不同浓度的谷氨酸钠、肌苷酸二钠、鸟苷酸二钠从低浓度(10-14mol/L)到高浓度(10-1mol/L)作时间-电流法扫描,扫描电位选择-0.38 V,使受体和配体充分结合后,选择第90秒电流值作为稳态电流,以电流在受体-配体结合前后的变化率ΔI与配体的浓度作图。为便于作图,以谷氨酸钠、肌苷酸二钠、鸟苷酸二钠浓度的对数值为横坐标,响应电流的变化率为纵坐标作图,如图1。
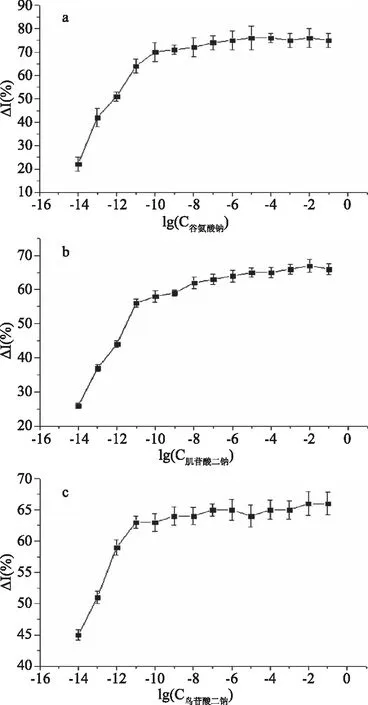
图1 谷氨酸钠、肌苷酸二钠、鸟苷酸二钠在检测范围内的电流变化率Fig.1 Current change rates of sodium glutamate,disodium inosinate,disodium guanylate in the detection range
由图1可以看出:谷氨酸钠、肌苷酸二钠、鸟苷酸二钠电流变化率达到稳定时的响应范围基本相同(基本都是在10-11mol/L达到稳定),与动力学曲线与酶促反应相似[16-18]。即在低配体浓度时,其信号输出与配体浓度成正比;当配体浓度达到一定值时,信号输出达到最大值;随配体浓度的增加,信号输出不再增加(如图2)。由此,可以参照酶的动力学特性和参数对鲜味配体与其受体作用所产生的信号输出进行动力学分析。
2.3 鲜味配体与受体作用引发的信号输出动力学曲线
如图1可看出谷氨酸钠、肌苷酸二钠、鸟苷酸二钠都在10-14~10-11mol/L的浓度范围内,与响应电流的变化率呈现良好的递增关系。由此,在此范围内,将三种鲜味物质在10-14~10-11mol/L浓度进一步细分,以检测的鲜味配体(谷氨酸钠、肌苷酸二钠、鸟苷酸二钠)的浓度为横坐标、电流的变化率为纵坐标作图,根据酶-底物结合动力学公式[16]:
[L]+[R]↔[LR]↔信号放大(输出)
式(2)
[L]代表配体,[R]代表受体,上式表述为配体受体相互结合,产生信号,放大输出。进行双曲线拟合所得曲线如图2。
根据Orgin9自带的生成方程式方法可知,其拟合方程见表1:

表1 鲜味配体与受体作用双曲线方程Table 1 Hyperbolic equation of the umami ligand and the receptor
由图2可知,鲜味物质(谷氨酸钠、肌苷酸二钠、鸟苷酸二钠)与其受体的作用曲线符合双曲线,具有配体-受体饱和效应,与酶-底物作用动力学相似[16]。根据表1方程,分别以谷氨酸钠、肌苷酸二钠、鸟苷酸二钠浓度的倒数为横坐标、以电流变化率的倒数为纵坐标作图(即双倒数法作图)[17],得图3。
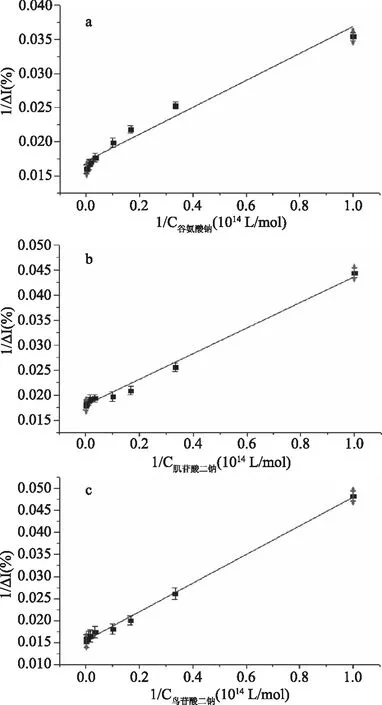
图3 谷氨酸钠、肌苷酸二钠、鸟苷酸二钠在10-14~10-11 mol/L浓度范围内与电流变化率的双倒数法回归曲线Fig.3 Double reciprocal regression curve of sodium glutamate,disodium inosinate,disodium guanylate in the concentration range of 10-14 mol/L to 10-11 mol/L
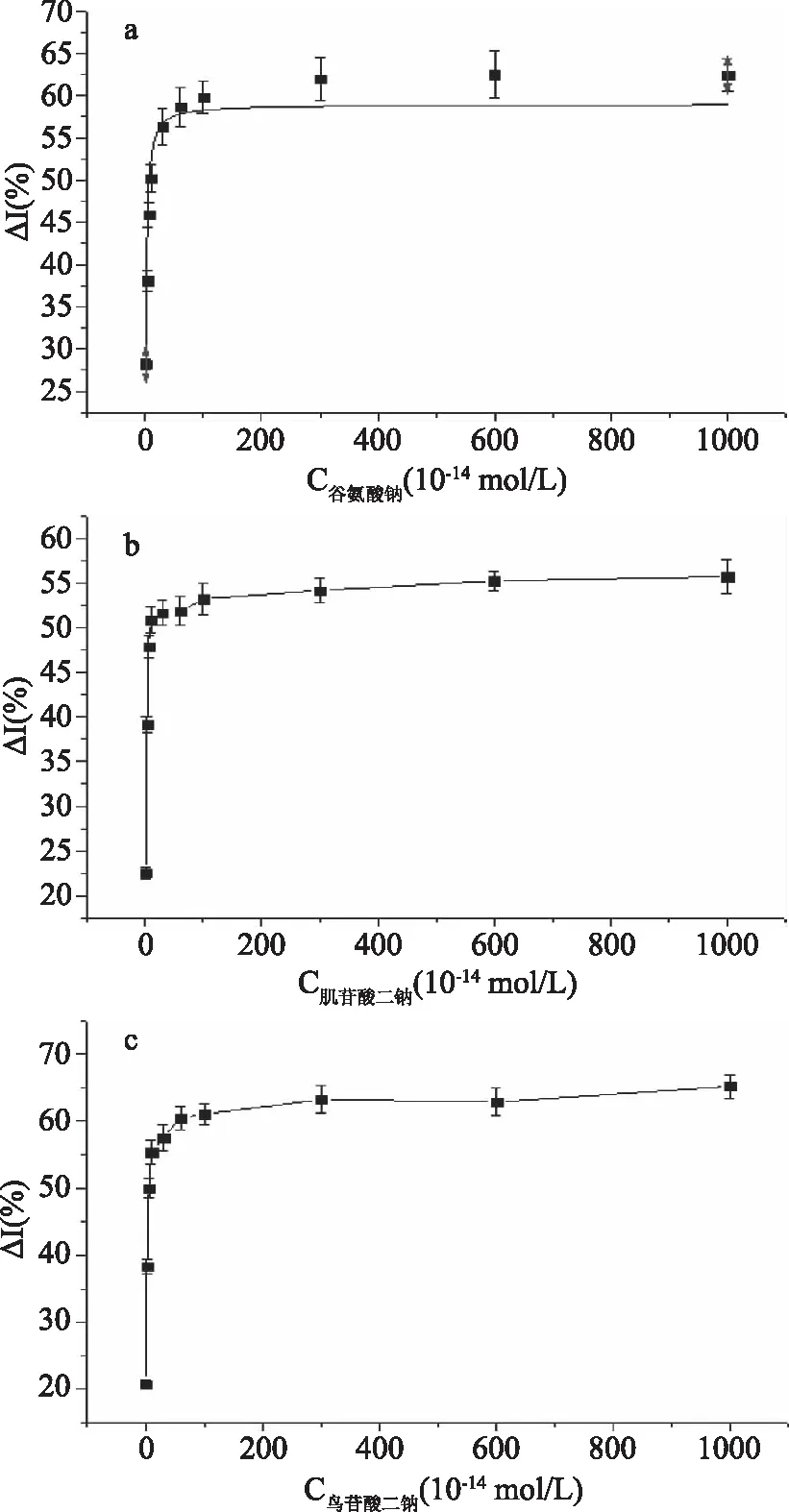
图2 谷氨酸钠、肌苷酸二钠、鸟苷酸二钠浓度对电流变化率的双曲线拟合图Fig.2 Hyperbolic fitting of sodium glutamate,disodium inosinate and disodium guanylate on current rate of change
上述函数所拟合的线性回归方程见表2:

表2 鲜味配体与受体作用线性回归方程Table 2 Linear regression equation of the umami ligand and the receptor
由上可知R2都大于0.95,此拟合效果良好,此双倒数法可靠。
2.4 鲜味受体与鲜味配体激活常数
根据研究结果我们根以及米氏方程[18]可计算得到:谷氨酸钠、肌苷酸二钠、鸟苷酸二钠与其受体相互作用的激活常数分别为:Ka=1.136×10-13mol/L,Kb=1.443×10-13mol/L,Kc=2.080×10-13mol/L。
即对大鼠空肠第二段而言,在这3种物质之间,谷氨酸钠的活性最高、肌苷酸二钠第二、鸟苷酸二钠最低。K越小,说明配体通过与受体作用产生的细胞信号输出的效率越高。当所有细胞输出信号都达到最大时,细胞上的受体(或结构域)全部被饱和,因此该激活常数实质上反映了平均每个细胞上能够与配体结合的受体(或结构域)数量,K越小,说明平均每个细胞上受体(或结构域)数量越少。由此再计算平均每个肠粘膜细胞上鲜味受体的数目。
2.5 平均每个肠粘膜细胞上鲜味受体的数目
由2.4可计算受体数目,计算方法如下,如:当平均每个细胞上只有1个受体时,每个细胞就只有两种状态:无信号放大作用的“0”和最大信号输出“1”。
根据已有研究方法[19],定义每个细胞上的受体数量如下:
式(3)
其中:CM是细胞上受体个数不为1时,到达最大响应信号的浓度;CL是细胞上只有1个受体时达到最大响应信号的浓度(此研究中,CL的值为10-14mol/L)。
根据上述公式,结合2.4计算出的活性常数,分别可得平均每个肠粘膜组织细胞上谷氨酸钠、肌苷酸二钠、鸟苷酸二钠的受体数量分别为:2.30、2.89、4.16/cell。可以看出平均每个肠粘膜细胞上鸟苷酸二钠的受体数量最多,其次为肌苷酸二钠,最低为谷氨酸钠。
2.6 对细胞信号级联放大倍数的估算
为了能够更准确估算配体与受体相互所产生的细胞信号放大作用,需要用裸电极在不同浓度(10-14~10-11mol/L)的配体溶液中所产生的电流响应值作为对照,以排除裸电极的影响。以检测溶液浓度的对数值为横坐标,以电流变化率为纵坐标,用oringin9作图,并用直线拟合。谷氨酸钠、肌苷酸二钠、鸟苷酸二钠这三种鲜味配体与裸电极的作用方程见表3:

表3 鲜味物质与裸电极作用方程Table 3 The equation of the umami substance and bare electrode
由式3得当浓度为K时所对应的电流变化率。分别带入表3的裸电极方程式可算出对应裸电极的浓度,由此计算信号放大倍数,结果见表4。

表4 鲜味物质信号放大倍数Table 4 The umami substance signal amplification
由图4可知,由信号放大倍数可以看出:N1>N2>N3,即谷氨酸钠放大倍数最大,其次为肌苷酸二钠,最低为鸟苷酸二钠。此结果和上文所得到的活性常数和平均每个细胞上的受体数目相对应,说明配体与受体作用产生的信号输出的效率越高,则信号放大倍数也越大,且此生物传感器能在极低浓度的(10-14~10-11mol/L)配体溶液下,极大地放大信号倍数,检测阈值低,为在低浓度的配体溶液中识别并检测鲜味物质打下坚实的基础,这也从侧面猜测:受体-配体互作所产生的生物活性主要取决于它们所引起胞内信号的级联放大作用,不同的配体所激活的和放大途径不同。
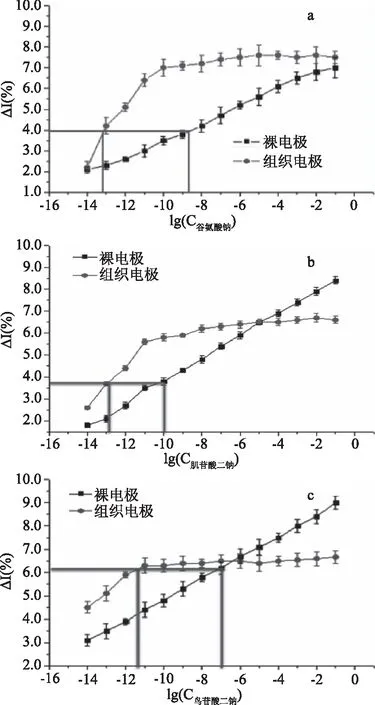
图4 工作电极(添加肠粘膜电极)与裸电极比较图Fig.4 Working electrode(adding intestinal mucosa electrode) comparison of bare electrodes
3 结论
结果表明:激活常数K值鸟苷酸二钠最大,其次为肌苷酸二钠和谷氨酸钠。信号输出效率为谷氨酸钠最高,肌苷酸二钠第二,鸟苷酸二钠最低。当输出效率越高时,平均每个肠粘膜细胞上的效应受体数目及信号放大倍数也越高。说明肠道对这四种鲜味物质的传感,实际上是通过激活细胞信号放大与传递来进行的。
机体对鲜味物质的传感不仅通过味觉系统进行食欲控制,更重要的是通过肠黏膜等复杂的受体系统进行传感、吸收、运转、储藏、代谢与控制。本项研究结果表明:可以通过固定化肠黏膜组织所制备的生物传感器进行动力学测定,通过激活常数,平均每个肠粘膜细胞上的受体个数,对细胞信号级联放大倍数的估算,进一步揭示食品中的不同功能性成分如何通过肠黏膜受体发挥营养和代谢控制作用。该方法在食品营养、功能评价和药物筛选等方面具有广阔的应用前景。

