哈密瓜(Cucumis melo L.)致腐真菌的鉴定
,,,, ,,
(1.北京市农林科学院蔬菜研究中心,北京100097; 2.沈阳农业大学,辽宁沈阳110866; 3.喀什大学,新疆喀什 844006; 4.果蔬农产品保鲜与加工北京市重点实验室,北京100097;5.农业部蔬菜产后处理重点实验室,北京100097)
哈密瓜(CucumismeloL.)主产于新疆,自2015年以来,种植面积稳定在120万亩左右,总产量为280万吨左右,其中大约70%销往内地[1]。在销售过程中,大部分哈密瓜采用常温平板车运输方式,缺乏预冷、冷链运输系统,约有15%的果实发生腐烂[2]。引起果实腐烂主要有两个原因,一个是哈密瓜在常温运输过程中,生理代谢加速,从而发热引起腐烂[3];另一种是真菌侵害引起的腐烂。目前,生理代谢加速引起的腐烂可以通过果实预冷或冷藏车储运的方式减少;真菌引起的腐烂可以通过消毒剂处理的方式减少[4]。但是,引起哈密瓜腐烂真菌的种类还存在一定争议,部分研究者认为青霉属、毛霉属、曲霉属和根霉属真菌是引起哈密瓜腐败的主要病原菌[5-7],而其他研究者认为链格孢属、镰孢属和根霉属是主要致腐菌[8-10]。而且,上述学者对哈密瓜上致腐真菌的鉴定主要是通过显微镜观察菌落特征来鉴定的,缺少进一步的科学证据。因而,引起哈密瓜腐败的真菌种类有待于进一步鉴定。
鉴定真菌种类的方法除了使用显微镜观察菌落特征外,还可以从微生物表型特征和分子学方面对微生物进行鉴定。微生物表型芯片系统(PMs)是利用微生物对95种不同碳源的代谢情况,确定微生物的表型,从而将微生物鉴定至种、亚种水平上[11-13]。分子生物学方面,采用ITS(Internal transcribed spacer)基因序列可以获得菌株的遗传信息,从而确定真菌种类,并为其系统发育的研究提供重要依据[14-15]。
因此,本课题组从哈密瓜表面分离出两种具有致腐作用的真菌,结合显微镜形态学观察、表型特征和分子学方法对其进行鉴定,以期明确引起哈密瓜腐烂的主要菌种,为减少哈密瓜采后腐败提供理论依据。
1 材料与方法
1.1 材料与仪器
哈密瓜和土豆 北京市果香四溢蔬菜超市(曙光花园店);葡萄糖(分析纯) 北京化工厂;琼脂 北京辉宏德业生物科技有限公司;FF-IF接种液(FF板) 美国Biolog公司;TaKaRa Fungi Identification PCR Kit(Code No.RR178)、TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164) 宝生物工程(大连)有限公司。
Incucell系列恒温恒湿培养箱 德国MMM集团;G154DW型高压灭菌锅 美国致微公司;DL-CJ-2N双人双面超净工作台 北京东联哈尔仪器制造有限公司;Gen III Microstation 美国Biolog公司;TaKaRa Thermal Cycler Dice TP600 PCR扩增仪 TaKaRa BIO INC.;Mupid核酸电泳仪 ADVANCE-BIO Co.,Ltd;EPS300 蛋白质电泳仪 上海天能;ImageMaster®VDS电泳成像装置 Pharmacia Biotech公司;ABI PRISMTM3730XL DNA测序仪 美国Applied Biosystem公司。
1.2 实验方法
1.2.1 微生物纯化及其形态观察 PDA培养基:称取马铃薯200 g,葡萄糖20 g,琼脂18 g,加水补足1 L,121 ℃灭菌15 min。将哈密瓜置于25~30 ℃环境中,待哈密瓜表面出现由微生物引起的软化腐烂现象时,将微生物利用无菌接种环在PDA培养基上划线分离培养7 d,然后将不同菌落的微生物挑出划线培养至新的PDA培养基上,直至纯化为单一菌落。将单一菌落的微生物置于PDA培养基上于28 ℃培养7 d,用显微镜观察菌落形态和颜色,物镜40倍,目镜10倍,拍照。
1.2.2 表型特征分析 将分离的菌株在PDA培养基上25 ℃培养7 d,用一次性无菌接种棉签将真菌孢子接种至FF-IF接种液中,使用浊度计调整菌悬液的菌体浓度至浊度为75%±2%,将配好的菌悬液用移液枪接种至FF板上,每孔100 μL。置于25 ℃培养,在24、48、72和96 h分别用Biolog微生物鉴定系统在490和750 nm下记录吸光值,获得致腐菌对95种碳源的消耗情况以及生长情况。
1.2.3 ITS基因测序、比对以及系统发育树构建 在培养基中挑取菌体于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164)中变性后离心取上清作为模板。反应条件:80 ℃,15 min。使用TaKaRa Fungi Identification PCR Kit(Code No.RR178)试剂盒对分离的菌株ITS区进行PCR扩增,PCR 反应体系中含上述变性反应液1 μL;PCR premix 25 μL;引物(20 pmol/L)各0.5 μL;无菌超纯水补足总体积至50 μL。ITS区扩增反应程序为:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸l min,30个循环,72 ℃ 延伸5 min。反应结束后,取5 μL PCR 产物加1 μL 6倍溴酚蓝上样缓冲液,在3%琼脂糖凝胶上200 mA 电泳15 min 进行检测,EB染色后于紫外灯下观察电泳条带,切胶回收目的片段进行测序,使用ABI PRISMTM 3730XL DNA Sequencer测序仪进行测序。
测序结果在GenBank数据库中进行同源序列搜索,比较纯化菌株与已知霉菌相应序列的同源性。为进一步显示实验菌株与已知菌株的亲缘关系及其分类地位,根据同源序列搜索结果与表型鉴定分析得到的几种相似度最高的菌种进行对比,提取相关模式菌株的ITS区基因序列,用MEGA7.0软件选用参数P-距离和成对删除法,将序列资料转换成距离后以邻位归并法构建系统发育树,并通过Bootstraps进行1000次渐启式复制以检验进化树枝的置信度。
2 结果与分析
2.1 菌株形态及显微镜观察
由图1可知,菌株A在培养基上产生大量气菌丝,气生菌丝为白色棉絮状,菌落突起呈白色。分生孢子呈纺锤形至镰刀形,弯曲或端直,3个隔膜的多。菌株B菌丝匍匐,生长初期菌丝为白色,后变为黑褐色;分生孢子倒棒状呈现椭球形,顶端延长成喙状,颜色呈淡褐色,孢子壁光滑,内部隔膜观察明显,具有3个或多个隔膜。将菌落形态与《真菌鉴定手册》[16]进行比对,发现菌株A可能为镰刀属,菌株B可能为链格孢属。
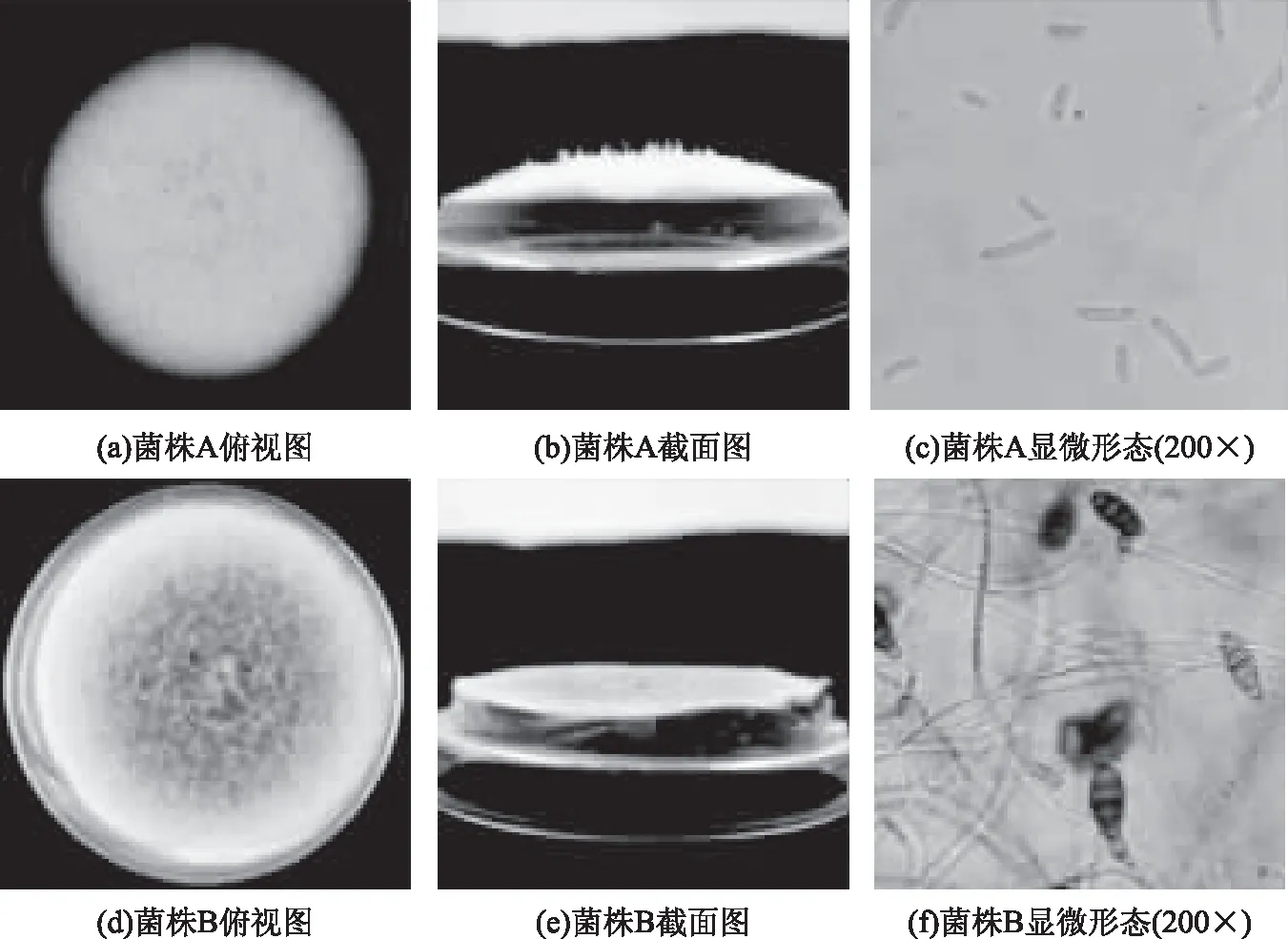
图1 菌株A和菌株B的菌落特征以及显微形态Fig.1 Colony characteristics and micromorphology profiles of strain A and strain B
2.2 微生物表型芯片系统(PMs)表型特征分析
PMs将95种碳源脱水干燥后填充于96孔板中,通过加入碘硝基四唑紫为指示剂来显示微生物对不同碳源的利用情况[17-18]。将菌株A和菌株B接种于上述96孔板中,将生长过程中,菌株A和菌株B碳源利用情况和生长情况与数据库的数据进行比对。在碳源利用方面,菌株A共可以利用72种碳源,与数据库中FusariumoxysporumSchlechtendahl:Fries BGA、FusariumoxysporumSchlechtendahl:Fries BGB和Fusariumchlamydosporum对碳源的利用相似度最高(图2),其中菌株A的碳源消耗与FusariumoxysporumSchlechtendahl:Fries BGA的相似度为77.1%,与FusariumoxysporumSchlechtendahl:Fries BGB的相似度为76.0%,与Fusariumchlamydosporum的相似度为71.9%。菌株A与上述3种真菌均可利用碳源有杏苷、糊精、D-半乳糖、D-葡萄糖酸、麦芽糖、肝糖、L-鼠李糖、L-山梨糖、L-乳酸等58种碳源。在菌株生长情况方面,菌株A的生长情况与FusariumoxysporumSchlechtendahl:Fries BGA的相似度为81.3%,与FusariumoxysporumSchlechtendahl:Fries BGB的相似度为85.4%,与Fusariumchlamydosporum的相似度为80.2%。

图2 菌株A与Fusarium oxysporum Schlechtendahl:Fries BGA、Fusarium oxysporum Schlechtendahl:Fries BGB和Fusarium chlamydosporum的对比Fig.2 Comparison of strain A with Fusarium oxysporum Schlechtendahl:Fries BGA, Fusarium oxysporum Schlechtendahl:Fries BGB and Fusarium chlamydosporum注:其中,A、B和C分别为菌株A与Fusarium oxysporum Schlechtendahl:Fries BGA、Fusarium oxysporum Schlechtendahl:Fries BGB和Fusarium chlamydosporum的碳源利用情况对比;D、E和F分别为菌株A与Fusarium oxysporum Schlechtendahl:Fries BGA、Fusarium oxysporum Schlechtendahl:Fries BGB和Fusarium chlamydosporum的生长情况对比。灰色为物质利用/生长情况相同,黑色为物质消耗/生长情况不同。
在碳源利用方面,菌株B共可以利用54种碳源,与数据库中Alternariaalternata[Fries]Keissl.BGA、Phomasorghina(Saccardo)Boerema和Curvularialunatavar lunata[Wakker]Boedjin BGA的碳源利用情况相似度最高(图3),其中菌株B的碳源消耗与Alternariaalternata[Fries]Keissl.BGA的相似度为76.0%,与Phomasorghina(Saccardo)Boerema的相似度为74.0%,与Curvularialunatavar lunata[Wakker]Boedjin BGA的相似度为67.7%。菌株B与上述3种真菌均可利用碳源有L-阿拉伯糖、D-果糖、丙三醇、蔗糖和木糖醇等45种碳源。在菌株生长情况方面,菌株B的生长情况与Alternariaalternata[Fries]Keissl. BGA的相似度为83.3%,与Phomasorghina(Saccardo)Boerema的相似度为79.2%,与Curvularialunatavar lunata[Wakker]Boedjin BGA的相似度为76.0%。

图3 菌株B与Alternaria alternata[Fries]Keissl.BGA、Phoma sorghina(Saccardo)Boerema和Curvularia lunata var lunata[Wakker]Boedjin BGA的对比Fig.3 Comparison of strain B with Alternaria alternata[Fries]Keissl.BGA, Phoma sorghina(Saccardo)Boerema and Curvularia lunata var lunata[Wakker]Boedjin BGA注:其中,A、B和C分别为菌株B与Alternaria alternata[Fries]Keissl. BGA、Phoma sorghina(Saccardo)Boerema和Curvularia lunata var lunata[Wakker]Boedjin BGA的碳源利用情况对比;D、E和F分别为菌株B与Alternaria alternata[Fries]Keissl.BGA、Phoma sorghina(Saccardo)Boerema和Curvularia lunata var lunata[Wakker]Boedjin BGA的生长情况对比。灰色为物质利用/生长情况相同,黑色为物质消耗/生长情况不同。
以相似度为排序指标,根据菌株A和B的PMs比对结果进行排序[19-20],菌株A与尖孢镰刀菌的相似度最高,菌株B与链格孢菌的相似度最高。
2.3 ITS序列分析
图4显示菌株A和菌株B ITS rDNA PCR的电泳图。正对照有条带证明PCR扩增试剂正常,负对照无条带,样品1、2有条带,说明电泳结果正常。菌株A和菌株B的PCR条带清晰完整,ITS区rDNA片段约为750 bp。
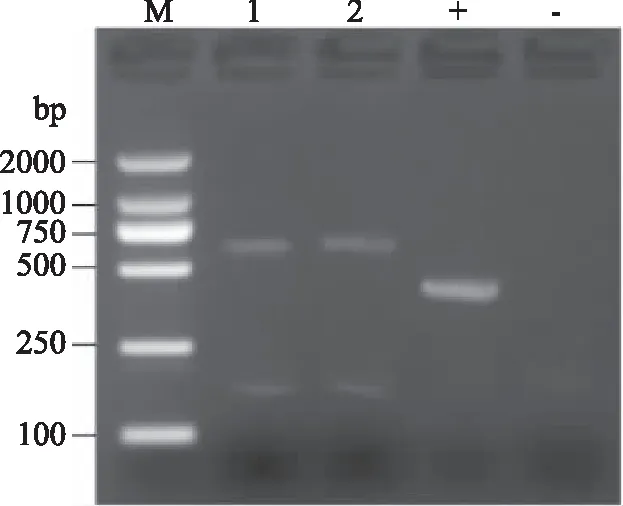
图4 菌株A和B的ITS rDNA PCR的电泳图Fig.4 Electrophoresis profile of PCR product of ITS rDNA of strain A and strain B注:M:Marker;1:菌株A;2:菌株B;+:正对照;-:负对照。
2.4 菌株A和菌株B在NCBI比对及系统发育树构建
根据Biolog表型鉴定得到的相似度最高的几个菌种(FusariumoxysporumSchlechtendahl:Fries BGA、FusariumoxysporumSchlechtendahl:Fries BGB和Fusariumchlamydosporum),菌株A与镰刀菌属中的尖孢镰刀菌和禾谷镰刀菌的相似度最高,因此将分离得到的菌株A的ITS区rDNA基因部分序列与GenBank内登录的相应序列进行比对,构建菌株A与已知菌株的ITS区rDNA序列进行同源性比对(表1),结果表明菌株A与Fusariumoxysporum,Fusariumoxysporumf. sp.melonis的同源性分别达到了100%和99%,而菌株A与Fusariumchlamydosporum的同源性达到了95%。
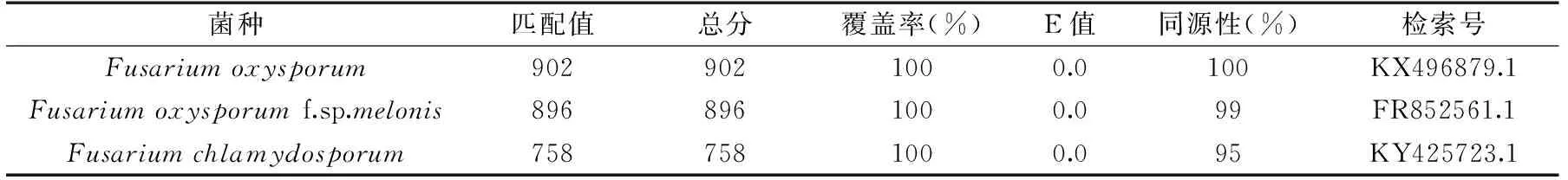
表1 菌株A ITS rDNA序列在NCBI同源性比对结果Table 1 NCBI alignments of ITS rDNA gene sequence of strain A
由图5的系统进化树结果可以看出,菌株A与Fusariumoxysporumf. sp.melonis在同一分枝上,且通过Bootstraps的验证表明它们具有较高的置信度,支持率达94%。在菌株A和Fusariumoxysporumf. sp.melonis菌种的进化枝上,进化分支长度均为0.00,而Fusariumoxysporum的进化分支长度为1.35。结合形态特征以及与《真菌鉴定手册》中的尖孢镰孢菌(Fusariumoxysporum)描述进行比较,发现结果基本一致,因此可将本研究分离到的菌株A确定为尖孢镰刀菌甜瓜转化型。

图5 基于菌株A ITS rDNA基因序列的系统进化树Fig.5 Phylogenetic tree based on ITS rDNA sequence of strain A
根据Biolog表型鉴定得到的相似度最高的几个菌种(Alternariaalternata,Phomasorghina和Curvularialunata),菌株B与链格孢菌、茎点霉菌和月状弯孢菌相似度最高,因此将分离得到的菌株B的ITS区rDNA基因部分序列与GenBank内登录的相应序列进行比对,构建鉴定菌株与已知菌株的ITS区rDNA序列进行同源性比对(表2),结果表明菌株B与Alternariaalternata的同源性均达到了100%,而菌株B与Phomasorghina和Curvularialunata的同源性都只达到了89%。
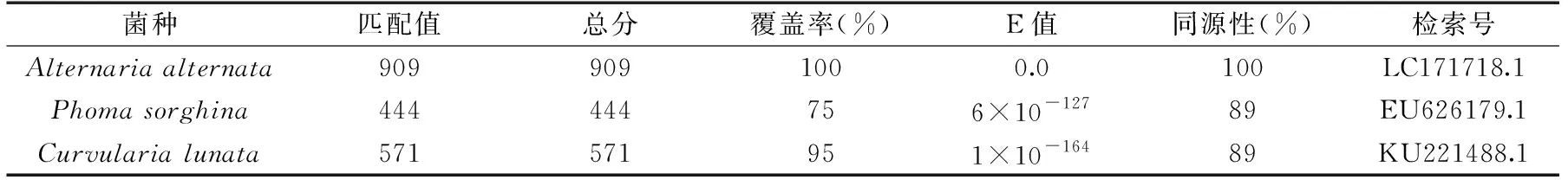
表2 菌株B ITS rDNA基因序列的NCBI同源性比对Table 2 NCBI alignment of the ITS rDNA gene sequence of strain B
由图6的系统进化树结果可以看出,菌株B与AlternariaalternataLC171718.1 在同一分枝上,且通过Bootstraps的验证表明它们具有较高的置信度,支持率可达99%。在菌株B和Alternariaalternata菌种的进化枝上,进化分支长度均为0.00,而菌株B与Phomasorghina和Curvularialunata的进化分支长度分别为3.08和2.26。因此,结合形态特征(图1d、图1f)以及与《真菌鉴定手册》中的链格孢菌(Alternariaalternata)描述进行比较发现结果基本一致,因此可将本研究分离到的菌株B确定为链格孢菌。

图6 基于菌株B ITS rDNA 基因序列的系统进化树Fig.6 Phylogenetic tree based on ITS rDNA sequence of strain B
3 结论
从哈密瓜上分离纯化出两株具有引起果实腐烂能力的菌株A和菌株B,其中菌株A可利用碳源包括杏苷、糊精、D-半乳糖、D-葡萄糖酸、麦芽糖、肝糖、L-鼠李糖、L-山梨糖、L-乳酸等72种碳源;其ITS rDNA序列与尖孢镰刀菌甜瓜转化型(Fusariumoxysporumf. sp.melonis)的同源性为99%,分支长度为0.00。菌株B可利用碳源包括L-阿拉伯糖、D-果糖、丙三醇、蔗糖和木糖醇等54种碳源;其ITS rDNA序列与链格孢菌(Alternariaalternata)的同源性为100%,分支长度为0.00。结合形态学、表型鉴定以及分子生物学鉴定推测,菌株A为尖孢镰刀菌甜瓜转化型,菌株B为链格孢菌。

