有机溶剂萃取高效液相色谱法检测玉米浆中黄曲霉毒素B1
, ,
(湖北工业大学发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北武汉 430068)
黄曲霉毒素(Aflatoxins,AFs)是一类以黄曲霉和寄生曲霉为代表的霉菌产生的次级代谢产物,人类通过玉米、坚果或牛奶等食品可能摄入不定量的黄曲霉毒素,而导致营养不良、免疫抑制和肝细胞癌变等症状。在18种黄曲霉毒素中,黄曲霉毒素B1(Aflatoxin B1,AFB1)的毒性最强,且广泛存在于各类粮食和经济作物中,所以AFB1被世界卫生组织(World Health Organization,WHO)列为毒物之首,2002年被国际肿瘤研究机构(International Agency for Research on Cancer,IARC)列为Ⅰ级强致癌物[1-3]。
玉米浆是利用湿法工艺生产玉米淀粉的副产物,其含有可溶性蛋白、游离脂肪酸、可溶性糖类和维生素等多中营养物质。玉米浆是微生物和动物的重要营养原料,被广泛用作优质氮源添加到微生物的培养基中[4],或作为蛋白质来源直接添加到动物饲料中[5]。玉米浆中的毒素来源主要是原材料玉米,另外由于玉米浆的生产工艺耗时长,其过程中可能产生霉变,也能导致霉菌毒素的产生,最后影响所得到产品的安全性[6-7]。根据我国GB 2761-2011《食品安全国家标准食品中真菌毒素限量》规定,玉米及其制品中AFB1限量标准为20 μg/kg,而且在饲料中的限量标准低于10 μg/kg[8]。目前,在我国的饮食、饲料等加工产品中,AFB1的存在是个亟待解决的问题[9-10],所以针对于原料中的AFB1的检测,需要一个简单有效的方法。
目前有很多检测AFB1的方法,主要有薄层层析法(TLC)[11]、液相-质谱联用法(LC-MS)[12-13]、酶联免疫吸附层析法(ELISA)[14-15]、高效液相色谱法(HPLC)[16],其中HPLC具有检测效率高、操作简便、定量准确的特点,受权威机构认可。在我国的国家标准AFB1检测方法主要有HPLC法。但是国标法中柱前衍生容易导致检测的重复性差,导致结果缺乏可信度,而且操作复杂,容易受样品中其他物质的干扰。
因此本文通过简单预提取净化方法,利用不同的有机溶剂萃取AFB1,并分析了温度、流动相等各种影响因素[17-18],选择合适的高效液相色谱条件利用简单的紫外检测即可检测AFB1,建立了简单、廉价的检测玉米浆中黄曲霉毒素B1的方法,为食品安全提供进一步的保障。
1 材料与方法
1.1 材料与仪器
玉米浆(包括玉米浆湿样和干样) 收集山东潍坊盛泰药业有限公司;黄曲霉毒素标品 以色列Fermentek公司;甲醇、乙腈 Sigma;二氯甲烷 国药集团科技有限公司;氯仿 国药集团科技有限公司。
LC-20AD高效液相色谱仪(配SPD-20A紫外检测器) 日本Shimadzu公司;真空干燥箱 上海精宏实验设备有限公司;BILON-6000Y喷雾干燥机 上海比朗仪器制造有限公司;恒温电磁搅拌水浴锅 河南予华仪器有限公司。
1.2 实验方法
1.2.1 玉米浆中毒素的提取与净化 称取玉米浆干样和湿样各20 g分别置于100 mL三角瓶,再加入20 mL有机溶剂(甲醇、乙腈、二氯甲烷、氯仿)萃取,利用磁力搅拌器100 r/min搅拌20 min,25 ℃,9000 r/min离心5 min,吸取离心管最下层有机溶液,重复上述萃取步骤2次,并将收集的有机层溶液溶液集中于一管。将萃取收集的溶液至于真空干燥箱,45 ℃真空干燥2 h,干燥后加入1 mL甲醇得到AFB1甲醇溶液,-20 ℃保存待检测。
1.2.2 色谱条件 高效液相色谱仪:LC-20AD;紫外检测器:SPD-20A;色谱柱:C18Shim-pack VP-ODS(250 mm×4.6 mm,5 μm);初始流速:0.7 mL/min;进样量:20 μL。检测波长:365 nm;初始流动相∶甲醇/水=50∶50。初始柱温:25 ℃。
1.2.3 萃取剂的筛选 取空白玉米浆干粉样按1 μg/mL的AFB1标准加标,分别用甲醇、乙腈、二氯甲烷和氯仿4种有机溶剂按1.2.1方法萃取,按1.2.2 HPLC条件检测,计算标样萃取后的回收率。
1.2.4 色谱条件的优化 流动相优化:柱温25 ℃,流速0.7 mL/min,先用了甲醇/水(50∶50)、乙腈/水(50∶50)体系,在甲醇/水(50∶50)的基础上,甲醇占比不变的条件下,加入5%乙腈代替5%水,以5%为梯度逐步增加乙腈的占比至甲醇/乙腈(50∶50),观察AFB1峰型及出峰时间。柱温优化:在流动相甲醇/乙腈/水(50∶30∶20)、流速0.7 mL/min条件下,在25、30、35 ℃柱温条件下,观察AFB1峰型及出峰时间。流速:在优化的流动相甲醇/乙腈/水(50∶30∶20),柱温30 ℃条件下,在流速为0.5、0.6、0.7、0.8、0.9、1.0 mL/min观察AFB1峰型及出峰时间。所检测的AFB1来源于混有1 μg/mL AFB1标样的空白玉米浆中的AFB1峰型和出峰时间。
1.2.5 标准曲线的绘制 配制0.4、0.8、1.2、1.6、2.0 μg/mL的AFB1标准溶液,HPLC检测,以AFB1浓度为横坐标,峰面积为横坐标绘制标准曲线。
1.2.6 对照试验 用本研究的方法和GB/T 5009. 22-2016检测5个不同批次干样和湿样中的AFB1,每个批次5个平行,取平均值作为对应批次检测的AFB1含量[19]。
1.3 数据处理
实验中每组实验重复三次以上,采用SPSS 19.0软件进行数据的显著性分析,应用Croeldraw X4.0软件进行作图。
2 结果与分析
2.1 萃取剂选择
4种有机溶剂萃取后的AFB1回收率如表1所示,可以发现4种有机溶剂萃取标样的回收率都很高,同时根据4种萃取后所呈现的色谱图(图1)分析,由甲醇和乙腈所萃取的样品的杂质含量较高,可能因为有其他一些偏水溶性物质同样溶于甲醇和乙腈,而不溶于二氯甲烷和氯仿这些极性相对较弱的有机试剂。为了减少检测中杂质的干扰,同时考虑到有机溶剂的安全性(氯仿相对于二氯甲烷更不稳定,毒性更大),二氯甲烷的沸点较氯仿要低,更易挥发,选用二氯甲烷做萃取剂。
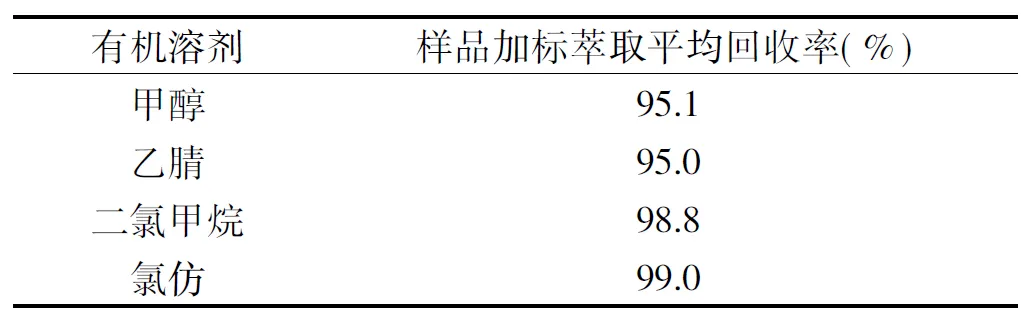

图1 不同有机溶剂萃取玉米浆中标样色谱图Fig.1 Chromatogram of standard sample extracted from corn syrup by different organic solvents注:A:甲醇;B:乙腈;C:二氯甲烷;D:氯仿。

图2 不同流动相组成呈现的AFB1色谱图Fig.2 Chromatogram of AFB1 presented by different mobile phases注:A:甲醇/水=50∶50;B:乙腈/水=50∶50;C:甲醇∶乙腈∶水=50∶30∶20。
2.2 色谱条件优化
2.2.1 流动相 目前,AFB1检测用的常用流动相组合会因为仪器、样品等其他条件而异,常用的有机溶剂主要包括甲醇、乙腈、异丙醇、三氯甲烷。根据GB/T 5009.22-2016规定流动相为水、乙腈和甲醇,并采用等梯度洗脱,但是在检测过程中,基线容易发生偏移,导致定量的准确性下降。
本文首先考虑等梯度洗脱,分别应用了甲醇/水(50∶50)、乙腈/水(50∶50)体系,乙腈/水体系出峰慢,响应相对较差,而甲醇/水体系的洗脱效果欠佳,所以当甲醇/乙腈/水形成三元混合流动相有了更好的分离效果,且响应效果好。以空白玉米浆为样品按1 μg/mL标准加入AFB1标样,其他条件不变的情况下进行了流动相配比优化,并最终确定了以甲醇/乙腈/水(50∶30∶20)为流动相。经过此流动相的洗脱,AFB1峰基本可以和杂峰分离开(图2)。
2.2.2 柱温 在一定情况下,柱温会影响到分离效率,也可能改变检测物质的成分。因此,在其他的色谱条件不变的前提下,比较了25、30、35 ℃柱温下的色谱图,结果发现在30 ℃时呈现峰型较好,分离度高,且没有多的杂峰,而当温度过低,出峰时间过晚,温度过高,杂峰数明显增多,影响检测定量的准确性(图3)。
2.2.3 流速 在其他条件不变的前提下,比较了流速0.5、0.6、0.7、0.8、0.9、1.0 mL/min时样品所呈现的色谱图的峰,结果如图4,在流速为0.7 mL/min时,出峰时间相对适宜,且分离效果比较理想。
2.3 标准曲线及线性范围
如前所述,分别配制0. 4、0. 8、1.2、1.6、2.0 μg/mL AFB1标准系列溶液,在所优化的色谱条件下测定,用峰面积与标准溶液的质量浓度绘制标准曲线,AFB1的质量浓度在0.4~2.0 μg/mL的范围内呈线性关系,线性回归方程为y=83564x+1648,相关系数r为0. 9988,其线性范围0.4~2.0 μg/mL。
2.4 样品检测的回收率和精密度
用上述方法分别提取湿玉米浆和玉米浆干粉按表所示量添加AFB1,然后进行萃取净化、HPLC检测,每个样品3个平行,重复5次。根据标准曲线计算出回收率和相对标准偏差(RSD),根据表中数据可证明本方法检测玉米浆中的黄曲霉毒素B1具有可行性。

图3 不同柱温下呈现的AFB1色谱图Fig.3 Chromatogram of AFB1 presented by different column temperatures注:A:25 ℃;B:30 ℃;C:35 ℃。

图4 不同流速下呈现的AFB1色谱图Fig.4 Chromatogram of AFB1 presented by different flow rates注:A:0.5 mL/min;B:0.6 mL/min;C:0.7 mL/min;D:0.8 mL/min;E:0.9 mL/min;F:1.0 mL/min。

表2 检测样品的回收率和精确度Table 2 Recovery and precision of the tested samples
2.5 对照实验
选取污染的玉米浆5个批次湿样和干样,根据GB/T 5009. 22-2016所规定的样品提取净化方法和本实验的提取净化方法,然后进行HPLC检测,所得结果如表3所示。对两种方法进行线性回归分析的回归方程:y=0.9878x+0.123,R2=0.9949,经过t检验(p>0.05)和F检验(F=0.002 目前,还没有对玉米浆中AFB1的检测及去毒方法的明确报道。在AFB1的提取和净化方面,本方法没有通过制作净化柱来提取并净化样品中的AFB1,而用有机溶剂萃取净化,更为便捷。在检测方面,本方法和国标法相比,省去了复杂的衍生步骤,而且设备成本更加低廉,得到的结果具有准确性、可靠性。 表3 本方法与国标方法检测玉米浆的结果对比Table 3 Comparison of the results of testing corn syrup by this method and the national standard method 图5 AFB1的标准曲线Fig.5 Standard curve of AFB1 注:p=0.9609>0.05,F=0.0025 本文优化了一种检测玉米浆中黄曲霉毒素B1的方法,结果发现该方法与国标法检测结果无显著差异(p>0.05),该方法更简单、廉价,安全性好,适用于玉米浆中AFB1的检测,有助于对玉米制品、饲料等制品的质量安全的有效控制。该方法同样还可以适用于一些非油类食品或者食品原料(玉米粉、豆粕粉等)中的AFB1检测,但不适用于一些油类物质中的毒素检测,油类物质可能会影响到AFB1的萃取效率,也可能会有一些易溶于有机溶剂的其他天然化合物对AFB1的检测产生干扰,针对不同类型的样品,需要找到对应的适宜的处理方法[20],才能更快、更精确地保障一些产品的质量问题。3 结论



